Що се отнася до визуализирането на протеини в гела, се утвърдиха две основни стратегии: неспецифичното оцветяване на протеини с багрила като комаси в брилянтно синьо [4] или специфичното откриване на даден протеин чрез Western blotting [5]. В допълнение, SDS-PAGE вариант, по-късно наречен зимография, беше въведен за визуална визуализация на протеини, снабдени с хидролитична активност, особено протеази. Този метод се основава на включването в полиакриламидния гел на специфичен субстрат за изследваната протеаза. След електрофоретично разделяне гелът се инкубира в подходящ буфер, за да се гарантира, че протеазите, евентуално присъстващи в оригиналната проба, придобиват отново своята ензимна активност и смилат субстрата на място. След това гелът се оцветява, например с комаси синьо и местата на протеолиза се появяват като бели ленти на син фон [6].
SDS-PAGE, като метод за разделяне на протеини според тяхната маса, е допълнително подобрен от Улрих К. Лаемли през 1970 г. [7]. В новия протокол протеиновите проби се денатурират със SDS в присъствието на 2-меркаптоетанол, редуциращ агент, който разцепва всяка дисулфидна връзка, независимо дали е естествена или изкуствено индуцирана, между цистеиновите остатъци в протеините. Съединението също така предотвратява последващото окисляване на цистеините и ги поддържа в редуцирано състояние. Една година по-късно, Grant Fairbanks et al. допълнително усъвършенства протокола за анализ на мембранните протеини на еритроцитите, като замества 2-меркаптоетанол с дитиотреитол, димеркаптан редуциращ агент, по-мощен от самия 2-меркаптоетанол [8].
Общоприето е, че по време на електрофоретичното разделяне при стандартните условия, описани по-горе, протеините са достатъчно добре запазени от окисляване, но това се оказва невярно. Всъщност електрофоретичният гел е силна прооксидантна среда, поради неизбежното присъствие на остатъчни следи от амониев персулфат, който се използва по време на приготвянето на гела за катализиране на полимеризацията на акриламид. Освен това, при стойността на рН на електрофоретичните гелове, 2-меркаптоетанолът и дитиотреитолът са в незаредено състояние. Следователно те не мигрират заедно с протеините и не могат да изпълняват защитната си функция по време на електрофоретичното бягане. Обикновено това явление се появява по време на фазата на подреждане на SDS-PAGE [9], когато протеините са силно концентрирани в много малък обем. Последицата е образуването на аномални високомолекулни протеинови агрегати, които остават на границата между подреждането и разделянето на геловете.
Тези артефакти могат да доведат до погрешно тълкуване на експерименталните резултати. За да се предотврати появата им, може да се възприеме защитата на тиоловите групи от различни алкилиращи агенти [10]. Алтернативно, по-опростен метод е третирането на пробата с тиогликолова киселина. Това съединение, благодарение на ниското си рКа, е в анионно състояние при стойността на рН на подреждащите и разделителни гелове и може да се движи към анода по време на електрофореза. Нещо повече, тиогликолатовият йон е с ниско молекулно тегло и мигрира по-бързо от всички протеини, премахвайки остатъчния амониев персулфат, преди да може да реагира със самите протеини [11].
Скоростта на окисление зависи от достъпа до окислители на цистеиновите остатъци в протеина, като явлението е предпочитано за протеини с високо съдържание на цистеин. За човешкия хемокин IP-10 беше ясно демонстрирано, че повишената склонност към омрежване, медиирано от окисление на цистеин по време на SDS-PAGE, може да бъде противодействано чрез превантивно алкилиране на цистеини [9]. Съвсем наскоро бяха открити доказателства за окисление в гел и за два различни β-дефензина на бозайници. Това обаче не е доказано със задоволителни експериментални тестове [12,13].
Съдържанието на цистеин в протеините е по-променливо от това на която и да е друга аминокиселина. Извънклетъчните протеини на бозайниците имат средно съдържание на цистеин 4,1% (като процент от общите аминокиселини). И обратно, вътреклетъчните протеини имат средно съдържание на цистеин 1,6% [14]. Вътреклетъчен протеин на бозайник, който представлява изключение за високото му съдържание в цистеините, е метионин сулфоксид редуктаза В1 (MsrB1, първоначално наречен SelR), който е един от 25-те селенопротеини на човешкия геном и един от малкото селенопротеини, чиято функция е известна [15 ]. MsrB1 принадлежи към голямо семейство ензими (MsrAs и MsrBs), отговорни за редукцията на метионин сулфоксид обратно до метионин, както свободен, така и вмъкнат в полипептидни вериги [16]. MsrB1, който е снабден с един каталитичен селеноцистеин и пет цистеина, единият от които участва в каталитичния механизъм заедно с остатъка от селеноцитеин, има съдържание на цистеини (включително селеноцистеин) от 5,2%, много над средното съдържание на вътреклетъчни бозайници протеини.
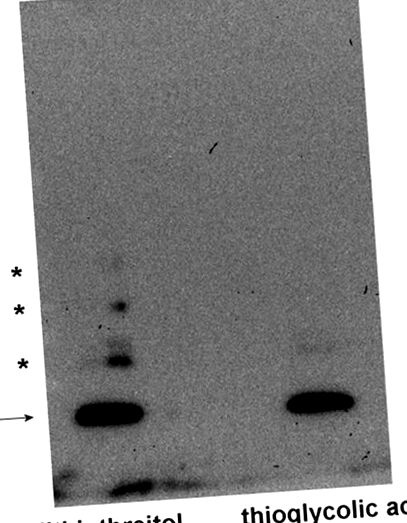
В Фигура 1 , разкрихме, че рекомбинантният човешки MsrB1 (носещ цистеин вместо селеноцистеин), когато се редуцира с дитиотреитол и се подлага на SDS-PAGE и Western blotting, показва основна лента при видимата молекулна маса от 13 kDa. Обаче се виждат и други, по-малко интензивни ленти, които най-вероятно представляват протеинови агрегати с молекулни маси от около 25, 40 и 50 kDa (предполагаеми димерни, тримерни и тетрамерни форми на MsrB1). Използването на тиогликолова киселина вместо дитиотреитол напълно потиска образуването на тези допълнителни ленти, ясно показващи, че това явление се появява по време на електрофореза и включва окисление на цистеин.
Процедурите се извършват по същество, както беше съобщено по-рано [19]. MsrB1 се третира с 1% (w/v) дитиотреитол или 0.01% (w/v) тиогликолова киселина (крайни концентрации) и се подлага на 5% -15% градиент SDS-PAGE (2 ng MsrB1 за всяка проба). След електрофореза протеините бяха електропрехвърлени в PVDF мембрана чрез Western blotting и след това третирани със заешки поликлонален анти-MsrB1 (Abcam, Кеймбридж, Великобритания) и с подходящото конюгирано антитяло, конюгирано с пероксидаза от хрян, за откриване на MsrB1 с подобрения реагент за откриване на хемилуминесценция (GE Healthcare, Чикаго, САЩ). Стрелката показва MsrB1, а звездичките обозначават агрегати MsrB1.
MsrB1 принадлежи към малка група протеини, които показват критики по време на електрофоретичен анализ поради изключителната реактивност, предоставена от високото им съдържание на цистеин. Може обаче да не е всичко. Всъщност MsrB1, наред с други MsrB изоформи, проявява най-висока ензимна активност поради присъствието на селеноцистеин в неговия активен център. Рекомбинантният MsrB1, в който цистеинът е заместен със селеноцистеин, показва 800 пъти по-ниска ензимна активност от естествения селеноензим [17]. Тази особеност зависи от интензивната нуклеофилност на селенолат, която е със седем порядъка по-висока от тази на тиолат [18]. Повишената химическа реактивност на селеноцистеин може да направи MsrB1 още по-податлив на окисляване по време на SDS-PAGE.
Тези необичайни характеристики на MsrB1 не се вземат предвид при електрофоретични изследвания на този протеин. Доколкото ни е известно, само стандартни протоколи SDS-PAGE са приети във всички публикации, изготвени по тази тема, включително тази, публикувана от нас, относно Msr ензимите в кръвните клетки [19].
Образуването на описаните артефакти, не винаги разпознаваеми ictu oculi, може да доведе до погрешни интерпретации на резултатите. Според нас разделянето на SDS-PAGE на протеини с високо съдържание на цистеин, като MsrB1, не трябва да се извършва с редуциращи агенти като 2-меркаптоетанол или дитиотреитол, които не могат да гарантират адекватна защита. Тиогликолевата киселина, благодарение на описаните по-горе благоприятни химични свойства, би могла да бъде най-добрата алтернатива за осигуряване на поддържането на протеиновите тиолови и селенолови групи в редуцираната им форма чрез предотвратяване на окисляването през целия електрофоретичен цикъл.
В заключение препоръчваме внимателно превантивно разследване, за да разберем дали рутинно използваните протоколи могат да бъдат подходящи за изследване на „специални“ протеини като MsrB1. По-голямото натоварване, произтичащо от тази стратегия, гарантира по-строг подход и може да позволи получаването на по-надеждни резултати.
- Протеини и отслабване как влияят протеините на загуба на тегло GymBeam Blog
- Прилагането на лазерна електрофореза на биологично активни вещества за комбинираното
- Протеини за отслабване 4 причини, поради които трябва да ги ядете всеки ден за закуска
- Протеини, променени от хирургично отслабване, подчертават биомаркери на инсулинова резистентност в
- Орбакайте показа как е израснал синът й - Newsy Today