Амарджит Сайни
1 Училище за спорт, упражнения и здравни науки, Loughborough University, Loughborough, UK;
Сарабджит Мастана
1 Училище за спорт, упражнения и здравни науки, Loughborough University, Loughborough, UK;
Фиона Майърс
2 Училище за биологични науки, Университет Портсмут, Портсмут, Великобритания
Марк Питър Луис
1 Училище за спорт, упражнения и здравни науки, Loughborough University, Loughborough, UK;
Резюме
ВЪВЕДЕНИЕ
Ефектите от стареенето имат сериозни физиологични последици върху скелетните мускули. Терминът „саркопения“ се използва за описание на бавната, прогресивна загуба на мускулна маса с напредване на възрастта [1]. Оперативно саркопенията се определя като апендикулярна скелетна мускулна маса, разделена на височина в метри, повече от две стандартни отклонения под младата нормална средна стойност. С това състояние е свързано постепенното намаляване на функционалните свойства на мускулите, включително намаляване на капацитета за производство на сила и максимална скорост на скъсяване и общо забавяне на свиването и отпускането [1].
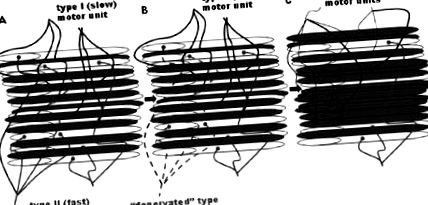
Смята се, че свързаният с възрастта спад на мускулната функция е свързан с намаляване както на мускулното количество (маса), така и с намаляването на мускулното качество (термин, обхващащ много фактори, включително сила на мускулна площ на напречното сечение (CSA), пропорции на влакната и метаболитни характеристики). Загубата на мускулно количество се случва чрез намаляване на съдържанието на съкратителни протеини чрез загуба на отделни мускулни влакна и намаляване на размера на останалите мускулни влакна (Фиг. 1 1 ) [2]. Тези промени засягат селективно различните видове мускулни влакна, процес, наречен „свързано с възрастта ремоделиране на двигателни единици (Фиг. 1 1 ) [3]. В допълнение към ремоделирането на остарелия мускул към по-бавен фенотип, CSA намалява значително във влакна тип II (бързи), докато влакната тип I (бавни) остават относително незасегнати [4]. По същия начин най-вече влакната от тип II се губят с остаряването, оставяйки по-голям дял от влакна от тип I в мускулите [5].
Реконструкция на двигателна единица, свързана с възрастта [2]. Смята се, че процесът на денервация и реиннервация на мускулните влакна продължава през целия живот и се ускорява със стареенето [2, 85]. С напредването на стареенето се смята, че има селективна загуба на бързи двигателни единици тип II, като денервираните влакна или се губят, или се ренервират от бавни двигатели от тип I. Белите влакна са тези, които са денервирани наскоро и които или ще умрат, или ще бъдат ренервирани от друг (тип I) двигателен неврон. Смята се, че CSA на останалите влакна също намалява. По този начин мускулите стават по-малки (поради общата загуба на влакна) и по-бавни (поради увеличения дял на влакна от тип I) с увеличаване на възрастта [1, 2]).
Предложени са различни механизми, които обясняват промяната в общата мускулна маса (виж таблица 1 1 ). Предлаганите механизми обикновено включват липса на редовна физическа активност (заседнал начин на живот), промени в ендокринната функция (инсулин, тестостерон, растежен хормон, кортизол), загуба на нервно-мускулна функция (денервация или реиннервация), промяна в протеиновия метаболизъм (дефицит между синтез на протеини срещу разграждане), хранене (предимно аминокиселини), апоптоза и заболяване или травма [2, 6].
маса 1.
Потенциални причини за свързана с възрастта загуба на мускулна маса (адаптирано от [2])
| Повишен заседнал начин на живот |
| Намалени нива и реакция към трофични хормони |
| Намалени нива на хормона на растежа |
| Намалени андрогени (тестостерон) |
| Намалено сигнализиране за подобен на инсулин растежен фактор-I и растежен фактор |
| Намален дехидроепиандростеронов сулфат (DHEAS) |
| Намалени естрогени (естрон, естрадиол) |
| Намален 25-хидрокси ергокалциферол (витамин D) |
| Намаляване или дисбаланс в протеиновия метаболизъм |
| Увеличение на невродегенеративния процес |
| Атрофия на мускулните влакна |
| Възпаление |
| Повишено разпространение на увреждане |
| Намален функционален капацитет |
| Намалена базална скорост на метаболизма |
| Промяна в генната експресия |
С напредване на възрастта (> 85 години) загубата на маса и сила може да окаже значително влияние върху функционалната независимост [7]. Данните от установените популации за епидемиологични изследвания на възрастните хора (EPESE) показват, че дори загуба от 10% или повече от общото телесно тегло между 50 и 67 години е свързана с 60% увеличение на смъртността в сравнение с хората със стабилно тегло [ 8]. При институционализирани обитатели на старчески домове 10% загуба на общото телесно тегло за 6-месечен интервал силно прогнозира смъртността през следващите 6 месеца [9]. При жителите, загубили най-малко 5% от телесното си тегло, се съобщава за 5 до 10 пъти повишен риск от смърт [10]. Свързаната с възрастта загуба на мускулна маса изглежда сравнително постоянна, със скорост приблизително 1-2% годишно на възраст над 50 години [11]. Този спад в мускулната маса се наблюдава както при заседнали, така и при активно застаряващи възрастни [6]. За разлика от това, няма здрава промяна в скоростта на протеинов синтез и разграждане при здрави млади възрастни. Въпреки че ефектите от стареенето върху скелетните мускули са неизбежни, не е ясно дали тези вътрешни промени са неизменни или обратими.
РЕМОНТ НА СКЕЛЕТНИ МУСКУЛИ
Сателитна клетъчна реакция към миотравма (адаптирано от [86]). Покойните сателитни клетки в мускулите на възрастни се характеризират с експресия на Pax7. При нараняване или натоварване сателитните клетки се активират и се делят асиметрично, като по този начин генерират самообновяваща се клетка и отдаден предшественик, който започва да изразява мускулния регулаторен фактор Myf5. Клетките, експресиращи Myf5, навлизат в клетъчния цикъл, преминават през кръгове на пролиферация, превръщайки се в миоД-експресиращи миобласти, които по-късно ще експресират миогенин и понижават регулирането на Pax7. Този набор от клетки ще се диференцира и ще се слее, за да образува нови миофибри по време на регенерацията на мускулите на възрастни.
ЕПИГЕНЕТИЧНИ ПРОМЕНИ: ПИВОТАЛЕН МЕХАНИЗЪМ ЗА РЕГУЛИРАНЕ НА САТЕЛИТНИ КЛЕТКИ В РЕГЕНЕРАЦИЯТА НА СКЕЛЕТНИТЕ МУСКУЛИ ПО ВРЕМЕ НА СТАРЕНЕТО?
Свързаните с възрастта промени в стволовите клетки и тяхната среда могат да бъдат категоризирани в две групи: необратими срещу обратими (Таблица 2 2 ) [30]. Необратимите увреждания на стареещите стволови клетки включват присъщи промени, които могат да бъдат свързани с увреждане на ядрена/митохондриална ДНК и съкращаване на теломерите, които преди това бяха подробно прегледани [30-35]. За разлика от това, промените в системната и локалната сигнална среда, които също се случват по време на стареенето, могат да бъдат обратими.
Таблица 2.
Механизми на стареене на сателитните стволови клетки: необратими спрямо обратими промени [30]
| Сигнални пътища | |
| ДНК увреждане | Активност на транскрипционния фактор |
| Теломерна ерозия | Хроматинов щат |
| Митохондриална дисфункция | ДНК метилиране |
Предлага се свързаните с възрастта промени в възрастните стволови клетки, като мускулните сателитни клетки, да бъдат силно повлияни от факторите на околната среда по време на стареенето. Както беше обсъдено по-горе, липса на редовна физическа активност (заседнал начин на живот), промени в ендокринната функция (инсулин, тестостерон, растежен хормон, кортизол)/сигнализиране за растежен фактор, загуба на нервно-мускулна функция (денервация или реиннервация), промяна в метаболизма на протеините ( дефицит между синтеза на протеини срещу разграждането), храненето (предимно аминокиселини), апоптозата и заболяването или травмата (Таблица 1 1 ) [2, 6] може да повлияе върху скелетните мускули и капацитета на активиране на сателитните клетки, което предполага, че зависимите от възрастта промени могат да бъдат обратими в тези тъкани и намаленият регенеративен капацитет на застаряващия скелетен мускул може да е резултат от остарялата скелетна среда върху функцията на сателитните клетки а не предимно присъщо стареене.
Следователно, ако репликите на околната среда наистина играят ключова роля във функцията на стволовите клетки, струва си да се разгледат механизмите, чрез които епигенетичната модификация може да медиира тези отговори. „Епигенетика“, в стриктната дефиниция на термина, е изследване на фенотипни или генни експресионни модели, наследяващи се чрез клетъчно делене, които са независими от ДНК последователността [36]. Съвсем наскоро беше предложено по-широко определение на епигенетиката като динамично регулиране на генната експресия чрез независими от последователността механизми, които включват промени в метилирането на ДНК и модификациите на хистона [37-39]. В следващия раздел на този преглед ние обсъждаме епигенетичната регулация на сателитните стволови клетки със специфичен фокус върху регулирането на състоянието на хроматина чрез модифициращи хроматин комплекси и ролята на ДНК метилирането, които са ключови за сателитната пролиферация и сливане на стволови клетки. Предлагаме, че епигенетичните механизми могат да координират контрола на програмите за експресия на гени на възрастни стволови клетки по време на стареенето и че интегрираните стимули на околната среда за предизвикване на промени в стволовите клетки чрез метилиране на хроматин и ДНК могат да бъдат обратими и по този начин в идеалния случай да бъдат молекулни ефекти на подмладяването на сателитните клетки и мускулна регенерация.
РЕМОДЕЛИРАНЕ НА ХРОМАТИН В САТЕЛИТНИ КЛЕТКИ
При определянето на мрежата от транскрипционни фактори, участващи в сателитната клетъчна активация, пролиферация и диференциация, стана ясно, че участват различни елементи на епигенетичната и хроматиновата техника. На молекулярно ниво ДНК е обвита около нуклеозома, състояща се от сърцевина от четири хистонови протеина (хистон 2А, 2В, 3 и 4) (Фиг. 3 3 ) за образуване на хроматин, който не само играе роля в хромозомната стабилност, но и регулира експресията на околните гени [40]. Механизмите на хистоновата регулирана генна експресия могат да бъдат приписани на пост-транслационни модификации на хистоновите опашки [40]. Тези модификации или „епигенетични белези“ включват метилиране, ацетилиране, сумоилиране и фосфорилиране на аминокиселинни остатъци в хистоновите опашки. Типът марка и аминокиселинният остатък, който е маркиран, са ключови фактори, определящи или транскрипционното активиране, или репресията [40].
Разположение на нуклеозомата. Хистоновите опашки, изпъкнали от нуклеозомните субединици, позволяват свързването на химични групи. Метиловите групи кондензират нуклеозомите по-плътно, предотвратявайки генната транскрипция. Ацетилирането разхлабва опаковката на нуклеозомите, излагайки ДНК на РНК полимераза и транскрипционни фактори, които ще активират гени.
МЕТИЛИРАНЕ НА ДНК В САТЕЛИТНИ КЛЕТКИ
В допълнение към посттранслационната модификация на хистоните, метилирането на CpG динуклеотид е основен източник на епигенетична информация и метилирането на съдържащи CpG промотори потиска експресията на специфични гени. ДНК метилирането за предпочитане се случва при позицията С5 на цитозина (Фиг. 4 4 ) в контекста на CG, образувайки второстепенните основи, 5-метилцитозини, които представляват приблизително 1% в генома на бозайниците [56, 57].
- Корекция на индуцирана от диетата хипергликемия, хиперинсулинемия и инсулинова резистентност на скелетните мускули
- Ефекти от физическата активност и отслабването върху скелетните мускулни митохондрии и връзката с
- Съображения за подходящо използване на скелетни мускулни релаксанти за лечение на остри ниски
- Преглед на електрическата мускулна стимулация; Опитах електрическа мускулна стимулационна терапия за възстановяване след тренировка
- ЕЛЕКТРИЧЕСКА МИСУЛНА СТИМУЛАЦИЯ - Марион Мици