Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Катедра по ядрена медицина и радиобиология, Университет на Шербрук, Квебек, Канада
Катедра по ядрена медицина и радиобиология, Университет на Шербрук, Квебек, Канада
Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Катедра по ядрена медицина и радиобиология, Университет на Шербрук, Квебек, Канада
Отдел по ендокринология, Медицински отдел, Университет на Шербрук, Квебек, Канада; и
Адрес за заявки за повторно отпечатване и друга кореспонденция: A. Carpentier, Отдел по ендокринология, Centre hospitalier universitaire de Sherbrooke, Sherbrooke, Québec, Canada J1H 5N4 (e-mail: [имейл защитен]).
Резюме
анормалният метаболизъм на мастните киселини играе основна роля в развитието на инсулинова резистентност и нарушена хомеостаза на глюкозата (11). Проучванията на метаболитни проследяващи при хора предполагат, че мастните тъкани от преддиабетни и диабетици показват неефективно съхранение на хранителни мастни киселини по време на постпрандиалното състояние (3, 6). Това от своя страна е свързано с повишени нива на постпрандиален триглицерид (TG) и/или нестерифицирани мастни киселини (NEFA) от „преливане“ на диетични мастни киселини към системно кръвообращение, в резултат на което се увеличава потокът от хранителни мастни киселини към постните тъкани (5, 33 ). Това преливане на мастни киселини изглежда е пряко свързано с наличието на коремно затлъстяване при пациенти с диабет тип 2 (29). Не е задължително обаче, че приемането на мастни киселини ще бъде повишено във всички постни тъкани по време на постпрандиалното състояние (20).
Наскоро разработихме неинвазивен метод, използващ перорално приложение на 14 (R,С) - [18 F] -флуоро-6-тиа-хептадеканова киселина (18 FTHA), аналог на дълговерижна мастна киселина, с позитронно-емисионна томография (PET) за оценка на органо-специфично разпределение на хранителните мастни киселини при хората (21 ). Използвайки този метод, ние показахме, както при диабетични плъхове (26), така и при пациенти с нарушен глюкозен толеранс (22), увеличаване на поглъщането на мастни киселини в миокарда, свързано с намалена функция на лявата камера и енергийна ефективност.
Целта на настоящото проучване е да се определи дали промяната в начина на живот, която води до умерена загуба на тегло и подобрен глюкозен толеранс и инсулинова чувствителност (10, 14), може да подобри сърдечните постпрандиални метаболитни и функционални аномалии, наблюдавани при пациенти с нарушен глюкозен толеранс.
Участници в проучването.
Таблица 1. Характеристики на участниците и ефект от намесата в начина на живот
Стойностите са средни стойности с 95% доверителен интервал (CI) в скоби. 6MWT, 6-минутен тест за ходене; ИТМ, индекс на телесна маса; HOMA-IR, хомеостатичен модел на инсулинова резистентност; NEFA, нестерифицирана мастна киселина; TG, триглицерид; AUC, площ под кривата. P стойностите са от теста на Wilcoxon.
Експериментални протоколи.
Субектите са инструктирани да следват изокалорична диета (0% алкохол, 15% протеин, 30% мазнини и 55% въглехидрати) 48 часа преди всеки експериментален протокол. При пристигане се измерва телесното тегло, височината и обиколката на талията и чистата телесна маса се определя чрез електрически биоимпеданс (Hydra ECF/ICF; Xitron Technologies, Сан Диего, Калифорния). Интравенозен катетър се поставя в едната предмишница за инфузии, а друг се поставя в дисталната вена в контралатералното рамо, поддържано в нагревателна подложка (∼55 ° C) за вземане на кръв.
Всеки участник е преминал набор от два 6-часови експериментални протокола след хранене в рамките на 4 седмици преди (А1 и В1) и 52 ± 4 седмици след (А2 и B2) началото на интервенцията за начина на живот. Двата протокола (А1 или А2 и В1 или B2) са извършени в произволен ред. И в четирите метаболитни протокола след хранене беше приготвено стандартно течно хранене, както е описано (29), и консумирано от участниците. Оралният прием на хранене съответства на 400 ml за 20 минути за общо 906 kcal [∼1/3 от средния дневен калориен прием на възрастни американци (16), 33 g или 33% като мазнини, 34 g или 17% като протеини и 101 g или 50% като въглехидрати]. Протоколите започват с 30 минути почивка в леглото, след което се вземат кръвни проби на интервали от 30 минути по време на експеримента. Кръв се събира в епруветки, съдържащи Na2EDTA и Orlistat (30 μg/ml; Roche, Mississauga, Канада), за да се предотврати in vitro TG липолиза.
В протоколи B1 и B2, 90 минути след прием на храна, [11 C] ацетат (~ 185 MBq) се прилага интравенозно в продължение на 30 s с динамично получаване на PET в режим на списък за 30 минути (18 × 10, 6 × 30 и 6 × 240 s), центрирано върху торакоабдоминален сегмент за определяне на сърдечна перфузия и оксидативен метаболитен индекс с помощта на многокомпонентно моделиране (17, 22). При седем от деветте участници тези придобивания бяха затворени с ЕКГ, което ни позволява да прилагаме PET вентрикулография и да определяме сърдечната функция (22, 26). При един от деветте участника възникна технически проблем по време на процедурата за инжектиране на [11 C] ацетат в проучването след интервенцията на начина на живот, което направи динамичните данни от PET невъзможни за интерпретация. Следователно този обект беше изключен от тези анализи.
Общото излагане на радиоактивност на участниците е 18 FTHA и [11 С] ацетатни последователности на изображения. Фракционното поглъщане на мастни киселини в миокарда (Ki) се определя с помощта на Patlak линеаризация (32). Функцията за въвеждане беше взета от аортата и показахме, че в този случай не е необходима корекция за ефект на преливане и частичен обем, тъй като диаметърът на аортата е достатъчно голям (8). След това изчисляването на миокардната диетична мастна киселина се изчислява чрез умножаване на Ki по нивата на хиломикрон-TG. За това изчисление се приема, че всички циркулиращи хранителни мастни киселини и 18 FTHA циркулират в хиломикрон TG между по 90 пъти да се 120 мин (2, 21). За сканиране на цялото тяло се записва средна стойност на пикселите [средна стандартна стойност на усвояване (SUV)] за всички тъкани, които представляват интерес. ROI са изтеглени върху черния дроб, сърцето, квадрицепса на бедрената кост, бедрото и предната коремна подкожна мастна тъкан и дясната периренална мастна тъкан (депо на висцералната мастна тъкан; това депо е избрано, за да се избегне стомашно и чревно разпространение на активност 18 F, което се е случило в повечето други складове за мастна тъкан със спланха) (21).
Индексът на сърдечния кръвен поток (първото преминаване на фракционна екстракция на тъкани, K1 за min -1, [11 C] ацетат) и индексът на окислителния метаболизъм (бързият фракционен клирънс на тъканите, k2 за min -1, [11 C] ацетат) бяха изчислено с помощта на модел с три отделения (17), както е публикувано преди това от нашата група (8, 20). За определяне на К1 (42) беше приложена корекция за първо преминаване на фракционна екстракция на тъкан на артериален [11 С] ацетат. За анализ на вентрикуларната функция, PET данни от [11 C] ацетатни изображения са получени като поредица от 16/сърдечен ритъм затворени ЕКГ рамки и са реконструирани като поредица от съседни двуизмерни срезове, използвайки 20 повторения на очакването за максимална вероятност алгоритъм за максимизиране. Клиничният софтуер Corridor4DM v5.2 (Segami; Invia) е използван за преориентация и за изчисляване на обеми на лявата камера, фракция на изтласкване на лявата камера, ударен обем и сърдечен обем. Сърдечният индекс се определя чрез разделяне на сърдечния дебит на телесната повърхност, което се получава с помощта на уравнението на Мостелер.
Лабораторни анализи.
Глюкозата, инсулинът, общият и индивидуалният NEFA, TG и глицеролът се измерват, както е описано по-горе (29). Хиломикроните и плазмените липиди се разделят чрез ултрацентрифугиране и се анализират за 18 F активност и концентрация на TG, както е описано (8). Индексът на индекса на инсулинова резистентност за оценка на модела на хомеостазата се изчислява като: глюкоза (в mmol/l) × инсулин (в mU/l)/22,5.
статистически анализи.
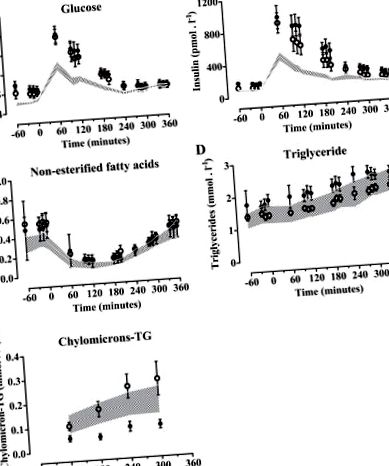
Данните са изразени като средни стойности с 95% доверителни интервали (CI). Непрекъснатите променливи бяха анализирани с помощта на сдвоени тестове на Wilcoxon, за да се сравнят резултатите преди спрямо след интервенцията и корелациите на Spearman за изследване на асоциациите между променливите. Двупосочен ANOVA за повтарящи се мерки с ефект на интервенция в начина на живот, време след хранене и взаимодействие като независими променливи се използва за анализ на разликите в плазмените метаболити и инсулина през периода след хранене. Дву опашка P стойност 2, 95% CI -1,7 до -0,8, P = 0,004) и обиколката на талията (-5 cm, 95% CI -8 до -3, P = 0,009) (Таблица 1). Постпрандиални екскурзии на плазмена глюкоза, инсулин, NEFA, TG и хиломикрон-TG преди и след интервенцията са показани на фиг. 1, A-Е.. След интервенцията беше установено, че площта на глюкозата под кривата (AUC) и AUC инсулин са по-ниски (-3,5%, P Активността на 18 F обикновено е по-висока преди 180 минути, но след това е по-ниска (двупосочен ANOVA P 18 F активност в плазмата NEFA след интервенцията (двупосочен ANOVA P Активността на 18 F в общия плазмен TG и хиломикрон не е значително по-ниска след интервенцията (Фиг. 2, ° С и д).
Фиг. 1.Постпрандиални плазмени метаболити и инсулин. Плазмена глюкоза (A), инсулин (Б.), нестерифицирани мастни киселини (NEFA) (° С), общо триглицериди (TG) (д) и хиломикрон-TG (Е.) преди (затворени кръгове) и след (отворени кръгове) 1-годишната интервенция за начина на живот. Данните са средно ± SE. Пунктираната зона представлява 95% доверителен интервал (CI) на данните за здрави субекти, публикувани в Ref. 22.
Фиг. 2.Активност след хранене 18 F в циркулиращите липиди. Обща плазма (A), NEFA (Б.), общо TG (° С) и хиломикрон (д) 18 F активност преди (затворени кръгове) и след (отворени кръгове) 1-годишната намеса в начина на живот. P стойностите са от двупосочни ANOVA за повтарящи се мерки с намеса в начина на живот, време след хранене и взаимодействие като независими променливи. % ID, процент погълната доза. Данните са средно ± SE. Прекъснатата област представлява данните от 95% CI за здрави индивиди, публикувани в Ref. 22.
Орган-специфично разпределение на хранителните мастни киселини и усвояването на миокарда.
Преди (фиг. 3A) срещу след (Фиг. 3Б.) интервенцията, относителното биоразпределение на орално приложени 18 FTHA 6 часа след поглъщане на храна е показана на фиг. 3. Относително поемане на диетични мастни киселини в миокарда (фиг. 3)° С) е намалена при всичките девет участника, средно с 50% (95% ДИ 34–67%, P = 0,004), от среден SUV от 2,13 (95% CI 1,65–2,62) до 1,02 (95% CI 0,69–1,35). Това намаление на относителното усвояване на мастните киселини в миокарда има тенденция да корелира с намалена AUC TG (ρ = 0,633, P = 0,08). Намаляването на усвояването на черния дроб (Фиг. 3д) не беше толкова последователен и не беше значим от SUV от 3,57 (95% CI 2,48-4,66) до 2,61 (95% CI 1,95-3,27) (P = 0,07). Също така няма значителни промени в скелетните мускули (Фиг. 3Е.) и депата на подкожната мастна тъкан (фиг. 3, F и G). Отбелязахме обаче значително увеличаване на поглъщането на трасери в периреналната (висцерална) мастна тъкан (фиг. 3З.) след интервенцията, от SUV от 0,17 (95% CI 0,09–0,25) до 0,22 (95% CI 0,13–0,31) (P = 0,04). Намаляването на сърдечния SUV обикновено корелира с увеличения висцерален мастен SUV (r = -0,54, P = 0,14), но не и с промяна в теглото или обиколката на талията.
Фиг. 3.Органично специфично разпределение на хранителните мастни киселини. Придобиване на позитронно-емисионна томография на цялото тяло отзад, извършено 6 часа след перорално приложение на 14 (R,С) - [18 F] -флуоро-6-тиа-хептадеканова киселина (18 FTHA) преди (A) и след (Б.) 1-годишната интервенция за начина на живот. Стандартна стойност на поглъщане (SUV) от позитронно-емисионна томография на цялото тяло в сърцето (° С), черен дроб (д), скелетни мускули (Е.), мастна подкожна (SC) мастна тъкан (F), предна подкожна мастна тъкан на корема (G) и в периреналната мастна тъкан (З.). Данните от всички участници са показани преди (затворени кръгове) и след (отворени кръгове) 1-годишната намеса в начина на живот. Зелена стрелка показва изхода на гръдния канал, синя стрелка показва стомаха, червена стрелка показва черния дроб, а черна стрелка показва пикочния мехур. *P
С използването на процедурата за линеаризация на Patlak (фиг. 4A), фракционно усвояване на мастна киселина с диети в миокарда (Фиг. 4Б.) е значително намален след намеса в начина на живот от 0,060/мин (95% ДИ: 0,029–0,091) до 0,016/мин (95% ДИ: 0,008–0,024) (P = 0,01). Въпреки че преди интервенцията повече от половината от циркулиращата активност 18 F все още се възстановява в хиломикрони 2 часа след прием на храна, съответната цифра след интервенцията е ∼1/5. Това е свързано с повишена рециркулация на 18 F в плазмения басейн NEFA. Това прави невъзможно точното изчисляване на нетното поглъщане на сърдечни диетични мастни киселини. Ако приемем, че хиломикрон-специфичният принос към сърдечното поемане е възможно най-ниската оценка, а приносът на хиломикрон + NEFA като най-високата възможна оценка, нетното сърдечно поемане варира от 35 до 85 nmol · g −1 · min −1 (95% CI).
Фиг. 4.Фракционен хранителен прием на мастни киселини в сърцето. Анализ на линеаризация на Patlak при един от субектите (A) и степен на частично усвояване на мастните киселини в миокарда (Ki) преди (затворени кръгове) и след (отворени кръгове) 1-годишната интервенция в начина на живот (Б.). *P 18 F радиоактивност; ROI (t)/ROI (p), тъканна/плазмена радиоактивност. Прекъснатата област представлява данните от 95% CI за здрави индивиди, публикувани в Ref. 22.
Индекси на сърдечната функция, притока на кръв и окислителния метаболизъм.
Крайно-систоличният обем на лявата камера е значително намален, докато крайният диастоличен обем не се различава след намесата в начина на живот (Таблица 2). Това доведе до значително увеличение на ударния обем на лявата камера, сърдечния обем и сърдечния индекс. Сърдечната честота, систолното и диастоличното кръвно налягане и продуктът на скоростта и налягането не се променят. Индексите на притока на кръв и окислителния метаболизъм (k2) от [11 C] ацетатната кинетика са значително намалени след намесата в начина на живот.
Таблица 2. Обеми на лявата камера, функция, индекс на кръвния поток и индекс на окислителния метаболизъм
Стойностите са средни (95% CI). P стойностите са от теста на Wilcoxon. EDV, краен диастоличен обем; ESV, краен систоличен обем; k2, индекс на окислителния метаболизъм на миокарда; LVEF, фракция на изтласкване на лявата камера; RPP, продукт със скорост и налягане.
* В н = 7 участника.
† В н = 8 участника.
Настоящото проучване показва, че умереното намаляване на теглото и обиколката на талията, предизвикано от промени в начина на живот, е свързано с значително подобрение на сърдечната функция и метаболизма при пациенти с нарушен глюкозен толеранс. Тези забележителни промени са свързани с важно намаляване на миокардното разпределение на хранителните мастни киселини. Въпреки че други вече съобщават за ефекта от интервенциите в начина на живот върху метаболизма на NEFA в сърдечната плазма, настоящото проучване е първото, доколкото ни е известно, което демонстрира ефекта от промяната в начина на живот със загуба на тегло върху поглъщането на диетични мастни киселини в сърцето и органите. Последният интегрира поглъщане от липопротеинова липазна хидролиза на хиломикрон-TG в микроциркулацията и поглъщане от рециклиране на хранителни мастни киселини в плазмата NEFA и липопротеин с много ниска плътност (VLDL).
Експериментите в сърца на гризачи предполагат важен принос за циркулирането на хиломикрон TG към потока на мастните киселини в сърцето (38). Наскоро показахме увеличено разпределение на мастните киселини в миокарда при модел на плъх от диабет тип 2 (26) и при субекти с нарушен глюкозен толеранс, участващи в настоящото проучване (22). В последното проучване съобщихме за много тясна корелация между увеличеното разпределение на мастните киселини в миокарда и субклиничното намаляване на фракцията на изтласкване на лявата камера. Ние обаче не наблюдаваме корелация между увеличеното фракционно усвояване на диетични мастни киселини в миокарда и намаленото усвояване на диетични мастни киселини в мастната тъкан в корема. Повишено съхранение на мастни киселини в мастната тъкан е показано след загуба на тегло (35), в съответствие с настоящата констатация за повишено относително усвояване на висцералната мастна тъкан 18 FTHA след загуба на тегло. По този начин по-голямата част от доказателствата по този начин подкрепят схващането, че нарушеното съхранение на мастна киселина в хранителната мастна тъкан допринася за разпространението на мастните киселини към други органи и развитието на липотоксичност (6). В настоящото проучване обаче не е възможно да се докаже причинно-следствена връзка между намалено висцерално и увеличено разпределение на мастните киселини в диетата на миокарда.
Увеличението на сърдечния дебит след загуба на тегло в настоящото проучване би предполагало увеличаване на енергийното търсене в постпрандиалното състояние, което е противоположно предвид известното намаление на теглото, свързано с намаляването на енергийните разходи в покой (т.е. адаптивна термогенеза) (27). В нашето проучване не сме измервали общите енергийни разходи на тялото. Дали индуцираната от диетата термогенеза е модифицирана и може ли да изиграе значителна роля в модулирането на енергийните разходи след хранене, е предмет на дебат и не може да се изключи в момента, особено като се има предвид преоткриването на ролята на кафявата мастна тъкан в енергийните разходи при хората (31 ).
Таблица 3. Модел на множествена линейна регресия за прогнозиране на относителното усвояване на мастните киселини в диетата на миокарда и ранното ниво на усвояване на диетични мастни киселини в миокарда от IGT статус, пол, възраст, ИТМ и дата на метаболитно проучване
IGT, нарушен глюкозен толеранс; SUV, стандартна стойност на усвояване; Ki, фракционен прием на мастни киселини в миокарда;. 18 F-FTHA, 14 (R,С) - [18 F] -флуоро-6-тиа-хептадеканова киселина; ß, стандартизиран коефициент.
- Диети с ниско съдържание на въглехидрати Отслабване, метаболизъм и промени в настроението
- Объркване на метаболизма Как да заблудите метаболизма си в изгаряне на мазнини, отслабване Отслабване
- Подобряване на уринарната инконтиненция при жени с наднормено тегло и затлъстяване чрез умерено отслабване
- Нарушената чернодробна функция по време на бременност може да доведе до нарушен метаболизъм и наддаване на тегло;
- Диета за хибернация - малко за това - индийски блог за отслабване