Jingying Wang
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Хенг Ма
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Чао Тонг
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Ханинг Джанг
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Гавин Б. Лоулис
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Юанда Ли
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Mengwei Zang
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Джун Рен
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Марк Дж. Ниджланд
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Стивън П. Форд
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Питър У. Натаниелс
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Джи Ли
* Катедра по фармакология и токсикология, Факултет по медицина и биомедицински науки, Университет в Бъфало - Държавен университет в Ню Йорк, Бъфало, Ню Йорк, САЩ;
Свързани данни
Резюме
Затлъстяването на майката по време на бременност предразполага потомството към инсулинова резистентност и свързаните с това сърдечно-съдови заболявания. Тук използвахме добре установен модел на овце, за да изследваме ефектите на майчиното затлъстяване върху сърдечните функции. Многоплодните овце-майки са назначени на контролна (CON) диета [100% от препоръките на Националния изследователски съвет (NRC)] или обезогенна (OB) диета (150% от препоръките на NRC) от 60 d преди зачеването до аутопсия на d 135 от бременността. Феталната кръвна глюкоза и инсулин бяха повишени (P Ключови думи: сърдечна дисфункция, сигнална трансдукция, инсулинова резистентност
Честотата на майчиното затлъстяване се е увеличила драстично през последните 20 години, с 42% при афро-американските жени и 29% при белите жени (1). Понастоящем е ясно, че затлъстяването при майките представлява важен проблем за общественото здраве, тъй като е свързано с много акушерски усложнения, като гестационен захарен диабет, диабет тип 2 и високо кръвно налягане. В допълнение, затлъстяването при майките води до по-висока пренатална заболеваемост (1,2,3), по-специално макрозомия с положителна корелация на теглото при раждане с индекса на телесна маса на майката (ИТМ) (4). Освен това се предлага, че промененият фетален растеж в условията на майчиното затлъстяване увеличава риска от заболявания на потомството за инсулинова резистентност, диабет, затлъстяване, хипертония и други сърдечно-съдови заболявания (3, 5,6,7).
Инсулиновата резистентност, индуцирана от затлъстяване, се счита за основен фактор за сърдечно-съдовите заболявания (8,9,10). Инсулиновата резистентност в мастната тъкан влошава усвояването на мастни киселини от мастните клетки, което води до поток на мастни киселини в черния дроб и свръхпроизводство на липопротеини с много ниска плътност (VLDL) (10). Повишените нива на циркулираща VLDL водят до натрупване в стената на кръвоносните съдове, образувайки атеросклеротични плаки (11), предразполагащи индивида към коронарна артериална болест (CAD). В допълнение към съдовите промени, затлъстяването и инсулиновата резистентност са свързани със структурни и функционални аномалии на миокарда, често наричани „диабетна кардиомиопатия“ (12). Kenchaiah et al. (13) съобщават за 5% повишен риск от клинична сърдечна недостатъчност (напр. Инфаркт на миокарда) при мъжете и за 7% повишен риск при жени с увеличение на ИТМ на всеки 1 kg/m 2 (13). Сърдечната фракция на изтласкване (EF%) се увеличава при категориите с влошена инсулинова чувствителност при леко затлъстели пациенти, което показва наличието на сърдечно увреждане (14). Тези характеристики на нарушената сърдечна функция се дължат поне отчасти на много усложнения, произтичащи от инсулинова резистентност, включително ремоделиране на лявата камера (LV), както и промени в сърдечния метаболизъм и хемодинамиката (15).
Последните проучвания показват, че активността на c-Jun N-терминалната киназа (JNK), протеин, активиран в отговор на физиологичен стрес, е повишена в затлъстелите тъкани, което предполага решаваща роля за затлъстяването и инсулиновата резистентност (16). Повишаването на JNK би фосфорилирало неговия целеви, субстрат 1 на инсулиновия рецептор (IRS-1) при Ser-307, което от своя страна нарушава индуцираното от инсулин IRS-1 тирозин фосфорилиране и отслабва чувствителността към инсулин (17, 18). Провокираната JNK сигнализация се дължи на различни фактори, като възпаление, оксидативен стрес и стрес на ендоплазмен ретикулум (ER) (19, 20), които обикновено са повишени при затлъстели индивиди (21). Влиянието на възпалението и оксидативния стрес върху пътя JNK-IRS-1 пречи на инсулиновата сигнализация, като по този начин предизвиква инсулинова резистентност, характеристика на диабет тип 2.
Ясното разбиране на механизмите, които влияят на инсулинозависимите пътища в сърцето на плода, свързани с майчиното затлъстяване и гестационния диабет, е от основно значение за необходимостта от информация за разработване на стратегии за превенция за клинично управление. Към днешна дата няма доклад за промени в тези пътища в сърцата на плодовете на затлъстели майки. Моделът на бременни овце е широко използван за изследване на развитието на плода поради сходството му с човешката бременност (22). В сравнение с гризачите, овцете са монотокозни (рядко носят повече от близнаци) и са предкосови, както и бременните жени. Настоящото проучване е предназначено да тества хипотезата, че затлъстяването на майките в резултат на прекомерно хранене променя сигналните пътища JNK-IRS-1 в сърцето на плода по начини, които биха намалили инсулиновата чувствителност.
МАТЕРИАЛИ И МЕТОДИ
Животни
Всички грижи и лечение на животните се извършват в съответствие с насоките на Комитета за грижа и употреба на животните в Университета на Уайоминг. Многоплодните овце-майки Rambouillet/Columbia бяха хранени или с много вкусна диета при 100% от препоръките на Националния съвет за научни изследвания (NRC) като контролна (CON) група (n = 8), или със 150% от препоръчаните енергийни нужди като обезогенна (OB) група (n = 8), започвайки 60 d преди зачеването и продължавайки до d 135 от бременността (първи ден на чифтосване: d 0). Всички овце-майки се претеглят седмично и се постига оценка на телесното състояние (BCS) на месечни интервали, за да се оценят промените в затлъстяването. BCS от 1 (изнемощял) до 9 (затлъстял) е назначен независимо от 2 обучени лица. BCS е силно свързан с липидите на кланичните трупове и може да се използва за оценка на енергийните запаси, налични за овцете (23). Подробности за управлението и резултатите от майката и плода са докладвани другаде (24).
На 135 г. от бременността овцете, носещи едноплодни плодове, са успокоявани с кетамин (10 mg/kg) и се поддържат под обща анестезия за инхалация с изофлуран (2,5%). Непосредствено след лапаротомията се взема проба от майчината кръв чрез югуларна венепункция и се събира фетална кръв от пъпната вена. Проба от кръв се събира в предварително охладена епруветка (хепарин плюс натриев флуорид; Sigma, Сейнт Луис, МО, САЩ) за измерване на глюкозата в плазмата. За инсулинов анализ кръвната проба се събира в предварително охладена нехепаринизирана епруветка Vacutainer (Sigma). Серумът и плазмата на пъпната вена се събират и съхраняват при -80 ° C. Овцете и плодовете бяха евтаназирани чрез обезкървяване, докато все още бяха под обща анестезия. Сърцата на плода и майката бързо бяха отстранени от 5 CON и 5 OB животни, а пробите от сърцето на LV бяха събрани и замразени при -80 ° C, докато се изследва за концентрация на протеин.
Изолирано измерване на сърдечна и сърдечна функция на плода
След отстраняване на плода от майчиното тяло, сърцето бързо се изрязва и ретроперфузира в перфузионната сърдечна система (Radnoti Glass Technology Inc., Монровия, Калифорния, САЩ) с 95% O2 и 5% CO2 уравновесен буфер на Krebs-Henseleit (KHB ), съдържащ 118 mM NaCl, 4,75 mM KCl, 1,2 mM KH2PO4, 1,2 mM MgSO4, 25 mM NaHCO3, 1,4 mM CaCl2, 10 μU/ml инсулин, 7 mM глюкоза, 1% BSA и 0,4 mM олеат. След 15 минути перфузия на изходното ниво, сърцата бяха предизвикани с 10 μM изопреналин за стимулиране на високо натоварване. Софтуерът LabChart6 (ADInstruments, Колорадо Спрингс, Колорадо, САЩ) е използван за наблюдение на сърдечната честота и налягането, развито в лявата камера (LVDP).
Имуноблотинг
Пробите от сърдечна тъкан се хомогенизират със 700 μl ледено-студен буфер за лизис (25). Концентрацията на протеин в лизат се определя по метода на Брадфорд (Bio-Rad Laboratories, Hercules, CA, USA) (26). След това сърдечните хомогенатни протеини се разтварят чрез SDS-PAGE и се прехвърлят върху мембрани от поливинилиден дифлуорид (PVDF). За повторно сондиране мембраните се отстраняват с 50 mM Tris-HCl, 2% SDS и 0,1 М-меркаптоетанол (рН 6,8). Заешки поликлонални антитела срещу JNK, фосфор-JNK при Thr 183/Tyr 185, инсулинов рецептор (IR) β, IRS-1, фосфор-IRS-1 при Ser 307, p38/MAPK, фосфор-p38 при Thr 180/Tyr 182, Akt, фосфор-Akt при Ser 473, мишена за рапамицин при бозайници (mTOR), фосфор-mTOR при Ser 2448, АМР-активирана протеин киназа (AMPK), фосфор-AMPK при Thr 172, PP2Cα, GLUT1, GLUT4 и хрян свързаните вторични антитела са закупени от Cell Signaling (Danvers, MA, USA). Антитела срещу фосфор-IR при Tyr 1150/Tyr 1151, протеини на транспортьори на мастни киселини FATP1 и FATP4 и CD36 са закупени от Santa Cruz Biotechnology (Санта Круз, Калифорния, САЩ).
Имунопреципитация
Имунопреципитацията се провежда, както е описано по-горе (27). Сърдечните хомогенати се инкубират с подходящото антитяло, предварително свързано към протеин G/A-Sepharose (GE Healthcare, Piscataway, NJ, USA) при 4 ° С за една нощ. Зърната се измиват 3 пъти с лизисен буфер и след това два пъти с лизисен буфер, съдържащ 0,5 М LiCl. Протеините се елуират в SDS пробен буфер за имуноблотинг анализ.
Съотношение глутатион/глутатион дисулфид (GSH/GSSG)
Съотношението GSH/GSSG на овче сърце се измерва чрез общ комплект за откриване на GSH (Assay Designs, Ann Arbor, MI, USA) (22). Сърдечните проби се претеглят и хомогенизират в ледено студена 5% (w/v) метафофорна киселина (20 ml/g). Хомогенатът се центрофугира при 12 000 g в продължение на 15 минути при 4 ° С и супернатантата се събира за измерване на общия GSH и окисления GSSG, съгласно инструкциите на производителя. Намаленият GSH се изчислява чрез изваждане на окислената стойност на GSSG от общата стойност на GSH.
IRS-1-зависима активност на PI3-киназа (PI3K)
IRS-1-зависимата активност на PI3K се анализира чрез имунопреципитация с анти-IRS-1 антитяло (22). Накратко, 800 μg проба от общ протеинов хомогенат се имунопреципитира с 5 μl IRS-1 антитяло (Santa Cruz Biotechnology) и 60 μl 50% суспензия от протеин A-Sepharose. Пелетата се суспендира в буфер за анализ, съдържащ 50 mM HEPES (рН 7), 25 mM MgCl2 и 250 цМ ATP. PI (4,5) P2 субстратът се инкубира в продължение на 3 часа и продуктът PI (3,4,5) P3 се открива чрез PI (3,4,5) P3 детектор, предоставен в комплекта PI3K ELISA (Echelon, Salt Lake City, UT, САЩ). Количеството PI (3,4,5) P3, получено от извлечен PI3K от пробата, е пропорционално на активността на PI3K.
Измерване на активността на Akt
Активността на Akt киназата се анализира чрез имунопреципитация Akt от 300 μg общ протеин от пробен хомогенат с 5 μl анти-Akt антитяло (Santa Cruz Biotechnology) и 60 μl 50% суспензия от протеин A-Sepharose (28). Пелетата се промива със студен PBS 3 пъти и след това се суспендира в буфер за разреждане на анализ на киназа. Akt киназната активност беше измерена въз основа на инструкциите на производителя на комплекта за анализ на Akt киназна активност (Assay Designs).
Статистически анализ
Фетални плазмени метаболити и сърдечен фенотип
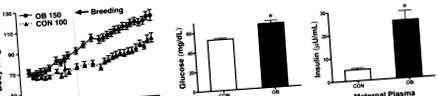
Феталните плазмени концентрации на глюкоза и инсулин са повишени в групата с OB ( Фиг. 3А, Б ). Съотношението на теглото на сърцето към телесното тегло не се различава между двете групи (фиг. 3C), докато съотношението на масата на LV към теглото на сърцето е по-голямо при OB, отколкото при CON фетални овце (фиг. 3D). Въпреки това, оцветяването с хематоксилин и еозин на феталната овца LV не показва сърдечна хипертрофия или фиброгенеза (допълнителна фигура 1). Тези резултати предполагат, че фетусите на OB майките са изложени на висок риск от развитие на хипергликемия и хиперинсулинемия.
Телесно тегло (BW), сърдечно тегло (HW), LV маса, плазмени метаболитни параметри на LV от CON (n = 8) и OB (n = 8) фетални овце при d 135 от бременността. А) Фетална глюкоза. Б) Фетален инсулин. В) Съотношение на фетален HW към BW. D) Съотношение на масата на феталния LV към HW (D). Стойностите са средни стойности ± se. * Р Фиг. 4А ). Когато е бил подложен на голямо натоварване от изопреналин (ISO; 10 μM) предизвикателство, първоначалното увеличение на сърдечната честота-LV продукт на налягане е ∼50% в CON и OB фетални сърца (фиг. 4А). Въпреки това, след 20 минути предизвикателство с голямо натоварване, сърцата на феталните плодове не можеха да поддържат повишената контрактилна производителност (фиг. 4А), както се демонстрира от продукта на сърдечната честота и LV на налягането на сърдечните сърца на феталния плод, намаляващ с 24% при край на предизвикателството с голямо натоварване (P # P se (n = 3/група).
Нарушението на сърдечната съкратителна функция в сърдечните сърца на плода е допълнително изследвано чрез анализ на сърдечната честота и LVDP, съответно. По време на условията на базална перфузия сърдечната честота на 2-те групи е ~ 105 удара в минута (фиг. 4В). След третиране с ISO (10 μM), както CON, така и OB феталните сърца успяха да постигнат сърдечен ритъм от ∼150 удара в минута и тази стойност се запази през целия период на голямо натоварване (фиг. 4В). Увеличението на LVDP обаче в отговор на лечение с ISO е слабо, но значително по-малко при OB в сравнение с CON фетални сърца (фиг. 4C). Освен това, максималната положителна стойност на първото производно на налягането (+ dp/dt) показва същия модел като LVDP, което показва скоростта на сърдечната систолна контракция в сърдечните сърца на феталния плод не се увеличава в същата степен като тази в CON феталните сърца когато са подложени на голямо натоварване (фиг. 4Е). Няма разлика в скоростта на сърдечната диастолна контракция (-dp/dt) между двете групи (фиг. 4D). Взети заедно, тези открития предполагат, че затлъстяването на майките може да не повлияе на нормалните сърдечни функции в късния фетален живот, а по-скоро да доведе до по-малко способност за адаптиране към условията на високо натоварване, като стрес от околната среда или упражнения.
Нарушена JNK-IRS-1 и инсулинова сигнализация в сърцето на ОВ плода
Променени JNK-IRS-1 сигнални каскади, повишен оксидативен стрес и нарушени сигнални пътища за инсулин в сърдечните органи на феталния плод. A, B) Протеинови нива на JNK (A) и p38/MAPK (B) и тяхното фосфорилиране в сърцата на CON и OB фетални сърца. Фосфорилираните JNK и p38 се определят количествено по отношение на общото ниво на JNK или p38, съответно. В) Съотношение GSH/GSSG във фетални сърца на CON и OB овце. Г) Имуноблоти на фосфор-IRS1 при Ser-307. Д) Фосфор-IRβ при Tyr 1150/1151 на сърцата на плода. F, G) Фосфорилиране на Akt при Ser-473 (F) и mTOR при Ser-2448 (G) в сърдечната тъкан на CON или OB плода. Фосфорилираните Akt и mTOR се определят количествено по отношение на общото ниво на Akt или mTOR протеин, съответно. З) IRS-1-зависима активност на PI3K. I) Акт киназна активност в сърцата на плода, измерена чрез имунопреципитационни киназни анализи. Стойностите са средни стойности ± se (n = 5). * Р Фиг. 6А ) са свързани с по-висока експресия на PP2C в сърцето на плода на OB (фиг. 6B) и пораждат подозрението, че метаболизмът на субстрата на феталното сърце е пренасочен в условията на майчино затлъстяване по време на бременност, тъй като Akt и AMPK са важни кинази, участващи в метаболитната регулация, 33,34). Интригуващо е, че резултатите от това проучване не показват разлика в съдържанието на протеин в транспортерите на глюкоза GLUT1 и GLUT4 (допълнителна фигура 2) и на протеините на транспортьори на мастни киселини FATP1 и FATP4 (фиг. 6C). Въпреки това, транспортерът на мастни киселини CD36 е значително намален в сърцата на плода с OB срещу CON (фиг. 6), докато CD36 е увеличен в сърцата на майките в отговор на диетично лечение с високо съдържание на мазнини (допълнителна фигура 4). Едно от обясненията може да бъде, че по време на феталния и неонаталния стадий основното енергийно снабдяване е глюкозата, но в сърцето на възрастния субстратният метаболизъм преминава от глюкоза към мастни киселини (35,36,37). Следователно, различният модел на транспортера на мастни киселини CD36 в сърцето на майката и плода може да се дължи на незрялостта на развиващото се сърце на плода. От друга страна, дефицитът на CD36 е свързан с хипертрофична кардиомиопатия (38, 39). Поради тази причина намаленото ниво на експресия на CD36 може също да бъде свързано с отслабената адаптивна способност в сърцето на плода на OB (Фиг. 4).
- Роля на лептина при бременност Последици от майчиното затлъстяване - ScienceDirect
- Затлъстяването при майки по време на бременност е свързано със изоставане в развитието на синовете и IQ - ScienceDaily
- Затлъстяване и бременност Мичиганска медицина
- Затлъстяване и бременност HealthLink BC
- Затлъстяване и бременност - Курс за сестрински грижи