Профилактика и терапевтични ефекти на малина (Rubus idaeus) върху образуването на бъбречни камъни при мишки Balb/c
Ибрахим Ф. Галайини; Мохамед А. Ал-Газо; Мохамад Н. А. Харфейл
Отдел по урология, Университетска болница "Крал Абдула", Йордански университет за наука и технологии - Irbid, Йордания
Ключови думи: камъни в бъбреците; Rubus idaeus; глиоксилати; калциев оксалат
ВЪВЕДЕНИЕ
Малина (Rubus idaeus), която принадлежи към семейство Розоцветни, е търговска овощна култура, широко отглеждана във всички региони на света по света. R. idaeus е много енергичен и може да бъде инвазивен. Те се размножават с помощта на базови издънки, разширени подземни издънки, които развиват корени и отделни растения. Той се разпространява широко в средиземноморските страни и се използва в народната медицина в Йордания, Сирия и Палестина за лечение на бъбречни камъни. В настоящото проучване способността на младите корени на R. idaeus е изследвана като терапевтично средство за предотвратяване образуването на камъни в бъбреците при миши модел на хипероксалурия.
МАТЕРИАЛИ И МЕТОДИ
Приготвяне на екстракти
Младите корени на Rubus idaeus са събрани от град На'ор, който е близо до столицата Аман през месец май 2007 г. Той е идентифициран и съхранен от професор Даууд Асауи, растителен таксономист в отдела по хербарий на Департамента по биология в Йорданския университет. Тук 200 g млади корени бяха извлечени в екстракционен апарат Soxhlet (ACMS технокрация, Индия) с помощта на дестилирана вода и концентрирани на ротационен изпарител. Полученият филтрат се лиофилизира и лиофилизатът се съхранява при -20 ° С в сушители, докато се използва. Средният (w/w) добив е 11,5% (майчин екстракт).
Модел на мишка за образуване на камъни
Проучването на всички животни е следвало препоръките на Ръководството на NIH за грижа и употреба на лабораторни животни. За да се индуцират CaOx бъбречни камъни при мишки, глиоксилатът, който е оксалатен предшественик, беше въведен, използвайки преди това докладвания метод в експериментални модели на нефролитиаза на плъхове (9). Интраабдоминално инжектиране се извършва според теглото на всяка мишка. Четиридесет и осем C57BL/6 мъжки мишки (на възраст 8 седмици), с тегло 25-30 g, бяха разделени по равно на 4 групи от по 12 мишки всяка. На всички с изключение на контролната група са прилагани 80 mg/kg глиоксилат чрез ежедневно интраабдоминално инжектиране. Използваният метод на приложение, използван в това проучване, е оптимизиран от предварителни експерименти според Okada et al. (10). Всички животни имаха свободен достъп до питейна вода (ad libitum) и редовно чау всеки ден и бяха държани под контролиран 12-часов цикъл светлина/тъмнина при 22 ± 2 ° C. Приемът на вода и храна е измерен за всички групи.
Билколечение
Животните бяха разделени на 4 групи. Група I се използва като отрицателна контрола (не се допълва с глиоксилат или билколечение). На група II се прилага само ежедневно интраабдоминално инжектиране на глиоксилат (80 mg/Kg), както беше споменато по-горе. На III и IV група са дадени съответно 100 mg/kg/ден и 200 mg/kg/ден воден екстракт от млади корени на R. idaeus чрез сонда в допълнение към инжектирането на глиоксилат. Всички мишки се хранят със стандартна лабораторна диета и се претеглят ежедневно. Експериментът се провежда през следващите 12 дни. След това мишките бяха подложени на следните тестове: серумни тестове, тестове на урина, определяне на калций в бъбреците и бъбречна хистология. Тестовете за серум и урина се повтарят три пъти по време на умъртвяването, като се използват различни проби.
Тестове за серум
В края на експеримента всяка мишка се анестезира чрез интраперитонеално инжектиране на уретан (2 g/kg телесно тегло). Възстановена е кръв от всички животни за анализ на серумен калций, оксалат, фосфор и креатинин, определени с автоматичен анализатор след центрофугиране. Процентът на намаление се изчислява за различните параметри, като се използва формулата: (средни стойности на нетретирани животни - средни стойности на третираните животни) × 100/средни стойности на третираните животни.
Откриване на образуване на камъни в бъбреците
Десните бъбреци на животните бяха отстранени и разрязани надлъжно. Бъбречните проби бяха фиксирани в 4% параформалдехид и вградени в парафин. Четири микрометра с дебелина напречни сечения бяха оцветени с описания по-рано метод за оцветяване Pizzolato за откриване на оксалатосъдържащи кристали (11). Накратко парафиновите секции бяха обезпаразитени и изплакнати в дестилирана вода. Водороден пероксид (30%) и сребърен нитрат (5%) се смесват еднакво, по 1 ml, и се изсипват върху предметните стъкла с тъканни участъци (рН на тази смес е 6,0). Всеки предметно стъкло беше изложено на светлина от 60-W лампа с нажежаема жичка на разстояние 15 cm (6 in.) За 15-30 min. Слайдовете бяха измити обилно с дестилирана вода и оцветени със сафранин и след това дехидратирани по обичайния начин. Бяха подготвени тънки срезове за хистология на тъканите, включително бъбречната папила и съществуването и честотата на отлагане на кристали в бъбречната тъкан бяха наблюдавани във всяка група чрез светлинна микроскопия.
Определяне на калция на бъбреците
Лявите бъбреци бяха отстранени от мишките за определяне на калций. Бъбреците се сушат при 100 ° С в продължение на 24 часа и се претеглят. Те се смилат в бехерова чаша, към която се добавят 7 ml 0,5 N азотна киселина. След това бехеровата чаша се нагрява, докато течността стане прозрачна. След калибриране, използвайки стандартния калциев разтвор, съдържанието на калций се определя чрез атомно-абсорбционна спектроскопия. Съдържанието на калций в бъбреците се изразява като mg/g мокра тъкан на бъбрека (12).
Оксидативен стрес
Маркери на оксидативен стрес бяха съдържанието на малондиалдехид (MDA), представляващо липидна пероксидация (LPO), определена чрез реактивен метод с тиобарбитуровата киселина (13). Протеиновите карбонили се измерват съгласно метода на Levine et al. (14). Антиоксиданти, съставени от витамин Е, определени по метода на Arnuad et al., С помощта на високоефективна течна хроматография (15). Супероксиддисмутазата (SOD) беше измерена, както е описано от Мисра и Фридович (16), и каталаза, използвайки метода на Синха (17). Съдържанието на глутатион, анализирано по метода на Tietze (18), и активността на глюкозо-6-фосфат дехидрогеназата (G6PD) се определя по метода на Deutsch (19).
Резултатите от всички групи са сравнени статистически с помощта на Student's-t-test с P
Таблица-1 показва, че са получени статистически значими намаления на стойностите на оксалат в урината, калций и фосфор в третираните с билки групи спрямо нелекувани животни (Р
Таблица 2 показва, че серумният оксалат, калций и креатинин са значително намалени (съответно 17,5%, 187,8% и 19,5%) (P
Теглото на всеки бъбрек на нетретирани животни е значително по-високо (0,27 ± 0,04 g) от това на третираните животни (0,19 ± 0,03 g и 0,18 ± 0,03 g, съответно за 100 g/Kg и 200 g/Kg R. idaeus) (стр
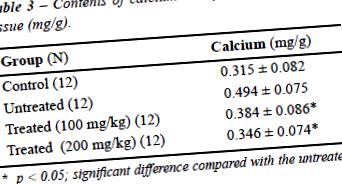
Бъбречното съдържание на калций е показано в Таблица-3 за различните групи мишки. Той е значително по-висок в нелекуваната група от останалите (P
За да се изследва ефектът на антиоксидантите върху индуцираните от хипероксалурия промени в бъбреците, бяха оценени ензимните и неензимни антиоксидантни нива в кръвта на всички животни (Таблица-4). Мишките в група III и IV на 12 дни са имали значително повече активности на SOD, каталаза, глутатион редуктаза (GSH) и G6PD, отколкото в нелекуваната с билки група (група II) (p
Пероксидацията на бъбречната тъкан се оценява като ниво на MDA, а протеиновите карбонили се оценяват като индикатор за продуктите на пероксидация на протеини (Таблица-4). Мишките в третираните групи III и IV са имали значително по-ниски нива на MDA и протеинови карбонили, отколкото в група II (p
За да се установи дали витамин Е може да играе защитна роля срещу индуцирано от хипероксалурия бъбречно пероксидативно увреждане, са измерени и нивата на алфа-токоферол в бъбречната тъкан. Както е показано в Таблица-4, R. idaeus има значително по-високо съдържание на витамин Е в третираните с билки групи III и IV за разлика от група II.
Хистологията също така показва повече отлагане на CaOx във всички части на бъбреците на нетретирани мишки (Фигура-1В), но почти никакво отлагане при отрицателните контролни и третирани мишки (Фигура-1А, С и D). Обаче отлагането е било по-малко при третирани с по-висока доза мишки (Фигура-1D), отколкото при мишки, третирани с по-ниска доза (Фигура-1С).
Фитотерапията е често срещана в народната медицина като алтернатива на първичното здравеопазване в много страни. R. idaeus е растение, принадлежащо към семейство Rosaceae със световно разпространение. Листата се използват от векове като народно лекарство за лечение на афти, херпес и гингивит при лица от всички възрасти, както и за лечение на анемия, крампи на краката, диария и сутрешно гадене при бременни жени и като маточен релаксант.
От показанията на билкари и пациенти с литиаза, растението е широко известно със способността си да подпомага изхвърлянето на камъни от пикочните пътища след няколко дни лечение. Доколкото ни е известно, ефикасността на R. idaeus при лечението на уролитиаза не е оценявана по-рано. Съответно предприехме настоящото проучване, за да оценим ефективността на R. idaeus като профилактично средство за CaOx камъни при експериментално индуцирана нефролитиаза при мишки.
В това проучване мъжете са избрани, тъй като по-ранни проучвания показват, че количеството отлагане на камъни при мъжки мишки е значително по-често (20). В отговор на 12-дневен период на приложение на глиоксилат, млади мишки образуват бъбречни камъни, съставени главно от CaOx (9,10).
Прилагането на малък обем воден екстракт от R. idaeus индуцира значително намаляване на растежа на зъбния камък, а при някои животни дори семената на CaOx почти не са намерени, което предполага, че тези животни елиминират матрицата на CaOx при липса на каквато и да е промяна в скоростта на диуреза.
Freitas et al. изследва ефекта на водния екстракт от Phyllanthus niruri (Pn), растение, използвано в народната медицина за лечение на литиаза, върху отделянето на урината на ендогенни инхибитори на литогенеза, цитрат, Mg и GAGs (7). Резултатите от тях показват, че Pn има инхибиторен ефект върху растежа на кристалите, който е независим от промените в екскрецията на цитрат и Mg с урината, но може да е свързан с по-голямото включване на GAG в калкула.
Atmani и Khan, изследват ефективността на екстракт, получен от Herniaria hirsuta върху CaOx кристализация in vitro (22). Нуклеацията и агрегирането на кристали CaOx се измерват отделно, като се използват спектрофотометрични методи. Резултатите показват, че има повече кристали с нарастваща концентрация на екстракт, но че те са пропорционално по-малки. Те стигнаха до заключението, че екстрактът от H. hirsuta насърчава зародиша на кристали CaOx, увеличавайки техния брой, но намалявайки техния размер.
В друго проучване Atmani et al. предположи, че H. hirsute може дори да съдържа вещества, които разтварят вече съществуващи частици (6), които ние изследваме с екстракт от R. idaeus в проучване, което е в процес на обработка. Всички опити за постигане на относително големи камъни при модели на мишки и плъхове се провалиха и следователно не можехме да твърдим, че екстрактът от R. idaeus разтваря или дезагрегира кристалите CaOx. Необходимо е по-нататъшно проучване на ефекта на екстракта от R. idaeus върху взаимодействието на кристалите CaOx с бъбречните епителни клетки в културата, за да се оцени механизмът, чрез който кристалните отлагания са елиминирани. Също така са необходими експериментални изследвания, за да се изяснят химичните съставки на активните съставки на това интересно растение.
В заключение, R. idaeus има мощен профилактичен ефект върху образуването на камъни CaOx, потвърждавайки фолклора за неговата антилитиазна активност. Възможна е ролята на липидната пероксидация в образуването на камъни CaOx, което може да има връзка с основните рискови фактори в урината, включително оксалат, калций, фосфор и MDA. Изглежда, че антиоксидантната терапия може да предотврати утаяването на CaOx в бъбреците и намалената екскреция на оксалат при камъни. Следователно съдържанието на витамин Е може да осигури защита срещу отлагането на CaOx камъни в бъбреците на хората. Необходими са допълнителни експериментални проучвания, за да се изяснят химичните съставки на активните съставки на това интересно растение.
КОНФЛИКТ НА ИНТЕРЕСИ
1. Finlayson B: Симпозиум по бъбречна литиаза. Бъбречна литиаза в преглед. Urol Clin North Am. 1974; 1: 181-212. [Връзки]
2. Khan SR: Структура и развитие на калцифични пикочни камъни. В Bonucci E, (ed.), Калцификация в биологични системи. Бока Ратон, CRC Press. 1992; стр. 345-63. [Връзки]
3. Khan SR: Взаимодействия между образуващи камък калциеви кристали и макромолекули. Urol Int. 1997; 59: 59-71. [Връзки]
4. Bellakhdar J, Claisse R, Fleurentin J, Younos C: Репертоар на стандартни билкови лекарства в мароканската фармакопея. J Етнофармакол. 1991; 35: 123-43. [Връзки]
5. Hennequin C, Lalanne V, Daudon M, Lacour B, Drueke T: Нов подход за изучаване на инхибитори на растежа на калциев оксалат. Urol Res. 1993; 21: 101-8. [Връзки]
6. Atmani F, Slimani Y, Mimouni M, Hacht B: Профилактика на калциево-оксалатни камъни от Herniaria hirsuta върху експериментално индуцирана нефролитиаза при плъхове. BJU Int. 2003; 92: 137-40. [Връзки]
7. Freitas AM, Schor N, Boim MA: Ефектът на Phyllanthus niruri върху уринарните инхибитори на кристализация на калциев оксалат и други фактори, свързани с образуването на бъбречни камъни. BJU Int. 2002; 89: 829-34. [Връзки]
8. Miyaoka R, Monga M: Използване на традиционната китайска медицина при лечението на пикочно-каменна болест. Int Braz J Urol. 2009; 35: 396-405. [Връзки]
9. Khan SR: Експериментална калциево-оксалатна нефролитиаза и образуване на човешки пикочни камъни. Сканиране Microsc. 1995; 9: 89-100; дискусия 100-1. [Връзки]
10. Okada A, Nomura S, Higashibata Y, Hirose M, Gao B, Yoshimura M, et al .: Успешно образуване на отлагане на кристали калциев оксалат в бъбреците на мишка чрез интраабдоминална инжекция с глиоксилат. Urol Res. 2007; 35: 89-99. [Връзки]
11. Pizzolato P: Хистохимично разпознаване на калциев оксалат. J Histochem Cytochem. 1964; 12: 333-6. [Връзки]
12. Economou C. Thomus J, tombelem G, Arvis G: Preominance gauche de la lithiase renale. Сем Хоп Парис. 1987; 63: 277-80. [Връзки]
13. Buege JA, Aust SD: Микрозомно липидно пероксидиране. Методи Ензимол. 1978; 52: 302-10. [Връзки]
14. Levine RL, Williams JA, Stadtman ER, Shacter E: Карбонилни анализи за определяне на окислително модифицирани протеини. Методи Ензимол. 1994; 233: 346-57. [Връзки]
15. Arnaud J, Fortis I, Blachier S, Kia D, Favier A: Едновременно определяне на ретинол, алфа-токоферол и бета-каротин в серума чрез изократична високоефективна течна хроматография. J Chromatogr. 1991; 572: 103-16. [Връзки]
16. Misra HP, Fridovich I: Ролята на супероксидния анион в автоокислението на епинефрин и прост анализ за супероксиддисмутаза. J Biol Chem. 1972; 247: 3170-5. [Връзки]
17. Sinha AK: Колориметричен анализ на каталаза. Анален Biochem. 1972; 47: 389-94. [Връзки]
18. Tietze F: Ензимен метод за количествено определяне на количеството нанограми от общия и окислен глутатион: приложения върху кръвта на бозайници и други тъкани. Анален Biochem. 1969; 27: 502-22. [Връзки]
19. Deutsch J: Глюкоза-6-фосфат дехидрогеназа. В Bergmeyer HV (ed.), Методи в ензимен анализ. 3-то изд. Том 3. Ню Йорк, Academic Press. 1983; с. 190-7. [Връзки]
20. Prasad KV, Bharathi K, Srinivasan KK: Оценка на Musa (Paradisiaca Linn. Sort) - сок от стъбла "Puttubale" за антилитична активност при плъхове албиноси. Индийски J Physiol Pharmacol. 1993; 37: 337-41. [Връзки]
21. Osswald H, Weinheimer G, Schutt D: Ефективно предотвратяване образуването на кристали на калциев оксалат in vitro и in vivo от пентозан полисулфат. В Walker VR, Sutton RAL, Cameron ECB, Pak CYC, Robertson WG. (съст.), уролитиаза. Ню Йорк, Plenum Press. 1989: с. 141-4. [Връзки]
22. Atmani F, Khan SR: Ефекти на екстракт от Herniaria hirsuta върху кристализация на калциев оксалат in vitro. BJU Int. 2000; 85: 621-5. [Връзки]
23. Selvam R: Калциево-оксалатна каменна болест: роля на липидната пероксидация и антиоксидантите. Urol Res. 2002; 30: 35-47. [Връзки]
24. Huang HS, Ma MC, Chen CF, Chen J: Липидна пероксидация и нейните корелации с нивата на оксалат, лимонена киселина и остеопонтин в урината при пациенти с камъни в бъбречния калциев оксалат. Урология. 2003; 62: 1123-8. [Връзки]
25. Huang HS, Ma MC, Chen J: Диетата с ниско съдържание на витамин Е влошава образуването на кристали на калциев оксалат чрез засилен оксидативен стрес при хипероксалуричен бъбрек на плъхове. Am J Physiol Бъбречен физиол. 2009; 296: F34-45. [Връзки]
26. Thamilselvan S, Menon M: Терапията с витамин Е предотвратява отлагането на кристали от калциев оксалат в бъбреците, предизвикано от хипероксалурия, като подобрява антиоксидантния статус на бъбречната тъкан. BJU Int. 2005; 96: 117-26. [Връзки]
27. Huang HS, Chen J, Chen CF, Ma MC: Витамин Е отслабва образуването на кристали в бъбреците на плъхове: роли на бъбречната тубулна клетъчна смърт и инхибитори на кристализацията. Бъбрек Int. 2006; 70: 699-710. Грешка в: Bidney Int. 2007; 71: 712. [Връзки]
Прието след ревизия: 30 юли 2010 г.
Адрес за кореспонденция:
Д-р Ибрахим Фати Галайни
Професор по урология
П.О. Кутия 940165
Аман, 11194, Йордания
Факс: +00 962 6568-7422
Имейл: [email protected]
РЕДАКЦИОНЕН КОМЕНТАР
Билковата медицина се използва като алтернатива за лечение на камъни в бъбреците в различни региони на света от векове. Докато навлизаме в ерата на доказателствената медицина, от изключителна важност е да се докажат технически и обективни благоприятни ефекти за тази линия терапия, улесняваща нейното приемане и практическа употреба (1).
Rubus ideaus в тази елегантна творба от Ghalayini et al. е показано, че е в състояние не само да намали количеството литогенни съставки в урината на мишките (по-специално оксалат), но също така и да елиминира съществуващата матрица на калкула, дори когато животните са били държани на непрекъснато инжектиране на глиоксилат. Лечението на хипероксалурия не винаги е ефективно, тъй като пациентите се борят с ограниченията в диетата и не се придържат към адекватна медицинска терапия като приложение на пиридоксин (2).
Rubus idaeus може да се окаже подходяща алтернатива, тъй като може да се намери повсеместно и особено ако отварата може да се постигне по домашен начин. Клиничните изпитвания могат да дадат този отговор, заедно с определянето на идеалната доза за хората, нейното въздействие върху 24-часовия анализ на урината и наличието на някакви странични ефекти.
1. Miyaoka R, Monga M: Използване на традиционната китайска медицина при лечението на пикочно-каменна болест. Int Braz J Urol. 2009; 35: 396-405. [Връзки]
2. Ortiz-Alvarado O, Miyaoka R, Kriedberg C .: Пиридоксин и диетични консултации за лечение на идиопатична хипероксалурия в камъни. Урология. 2011 г. [Epub пред печат] [Връзки]
Д-р Рикардо Мияока
Отделение по урологична хирургия
Университет в Минесота
1420 Delaware St. SE, (MMC 394)
Минеаполис MN 55455, САЩ
Имейл: [email protected]
Цялото съдържание на това списание, с изключение на случаите, когато е отбелязано друго, е лицензирано под лиценз Creative Commons Attribution
- Нанобактерии Инфекциозна причина за образуване на камъни в бъбреците - ScienceDirect
- Разкъсаната баба, на 73, хвърля четири камъка - като се научи да използва iPhone - Световни новини - Mirror Online
- Спането късно е лошо за вашата диета - странични ефекти от спането късно
- Управлява ме салата от прошуто и козе сирене с малина винегрет
- Защитни ефекти на разтвор на мед и алкохолен екстракт от Fagonia indica срещу индуциран от етанол