От катедрата по вътрешни болести, отдели по нефрология и хипертония (ARC, OPM, XZ, SCT, LOL) и сърдечно-съдови заболявания (MR-P., AL, LOL) и лабораторна медицина и патология (JPG), Mayo Clinic College of Медицина, Рочестър, Мин.
От катедрата по вътрешни болести, отдели по нефрология и хипертония (ARC, OPM, XZ, SCT, LOL) и сърдечно-съдови заболявания (MR-P., AL, LOL) и лабораторна медицина и патология (JPG), Mayo Clinic College of Медицина, Рочестър, Мин.
От катедрата по вътрешни болести, отдели по нефрология и хипертония (ARC, OPM, XZ, SCT, LOL) и сърдечно-съдови заболявания (MR-P., AL, LOL) и лабораторна медицина и патология (JPG), Mayo Clinic College of Медицина, Рочестър, Мин.
От катедрата по вътрешни болести, отдели по нефрология и хипертония (ARC, OPM, XZ, SCT, LOL) и сърдечно-съдови заболявания (MR-P., AL, LOL) и лабораторна медицина и патология (JPG), Mayo Clinic College of Медицина, Рочестър, Мин.
От катедрата по вътрешни болести, отдели по нефрология и хипертония (ARC, OPM, XZ, SCT, LOL) и сърдечно-съдови заболявания (MR-P., AL, LOL) и лабораторна медицина и патология (JPG), Mayo Clinic College of Медицина, Рочестър, Мин.
От катедрата по вътрешни болести, отдели по нефрология и хипертония (ARC, OPM, XZ, SCT, LOL) и сърдечно-съдови заболявания (MR-P., AL, LOL) и лабораторна медицина и патология (JPG), Mayo Clinic College of Медицина, Рочестър, Мин.
От катедрата по вътрешни болести, отдели по нефрология и хипертония (ARC, OPM, XZ, SCT, LOL) и сърдечно-съдови заболявания (MR-P., AL, LOL) и лабораторна медицина и патология (JPG), Mayo Clinic College of Медицина, Рочестър, Мин.
От катедрата по вътрешни болести, отдели по нефрология и хипертония (ARC, OPM, XZ, SCT, LOL) и сърдечно-съдови заболявания (MR-P., AL, LOL) и лабораторна медицина и патология (JPG), Mayo Clinic College of Медицина, Рочестър, Мин.
Преглеждате най-новата версия на тази статия. Предишни версии:
Резюме
Хиперхолестеролемията е често срещан сърдечно-съдов рисков фактор. Приблизително 50% от възрастното население на средна възраст има общ холестерол над желаните нива, 1 силен, независим предиктор за прогресията на атеросклерозата. 2 Дислипидемията също често придружава и влошава ранно и напреднало бъбречно заболяване. 3,4 По-рано сме показали в модел на свине, че 10 до 12-седмична хиперхолестеролемия, предизвикана от диета, рисков фактор за ранна атеросклероза, предизвиква бъбречна дисфункция, възпаление и фиброза, частично медиирана от повишен оксидативен стрес. 5-8 Повишеният оксидативен стрес може да допринесе за бъбречно увреждане при хиперхолестеролемия и атеросклероза благодарение на увеличеното генериране на реактивни кислородни форми (ROS) и окисляването на LDLs, 8-12, което може да предизвика ендотелна дисфункция и да активира редокс-чувствителните растежни фактори и цитокини. В допълнение, натрупването на липиди или клетъчното увреждане може да насърчи бъбречна дисфункция, гломерулно увреждане и интерстициална фиброза. 13,14
Динамичен и сложен процес, при който растежът на тъканите се компенсира чрез разграждане и отстраняване, запазва нормалната структура на бъбреците и може да бъде частично модулиран от ендотелни фактори. Бъбречните заболявания и нормалното бъбречно развитие се характеризират с висок процент на оборот на извънклетъчния матрикс (ECM). В този процес са замесени няколко фиброгенни фактора, като трансформиращ растежен фактор -β (TGF-β), ангиотензин II и ендотелин-1 (ET-1), 15 докато основните регулатори на бъбречната ECM деградация са матричните металопротеинази (MMP) ) семейство. 16 Наблюдавахме по-рано, че в стенозиращия бъбрек едновременната хиперхолестеролемия усилва бъбречно увреждане и образуване на белези, 9,12, но пътищата, по които дислипидемията модулира бъбречната фиброза, не са напълно определени. Това проучване е предназначено да провери хипотезата, че хиперхолестеролемията не само насърчава фиброгенната активност, но също така понижава бъбречната MMP, като по този начин притъпява разграждането на ECM и улеснява бъбречните белези. Освен това тези механизми могат да бъдат манипулирани чрез диетична интервенция за понижаване на липидите.
Методи
Институционалната комисия за грижи и употреба на животните одобри всички процедури. Двадесет и едно домашни кръстосани свине (65 до 75 kg) са изследвани след наблюдение от 16 седмици. Моделът на прасето е избран поради сходството между физиологията на сърдечно-съдовата и бъбречната система на свинете и хората, липидния профил и размера на тялото. При 14 прасета ранната атеросклероза е симулирана чрез хранене с 2% диета с висок холестерол (HC) (TD-93296; Harlan-Teklad). 6–9 От тях 7 животни бяха хранени в продължение на 10 седмици с HC диетата и след това преминаха към нормална свиня чау през останалите 6 седмици (HC-N; n = 7), докато в останалите 7, HC диетата се поддържа през всичките 16 седмици (HC-HC; n = 7). По-рано показахме, че 10 до 12-седмична HC диета при свинете води до ендотелна дисфункция и активиране на увреждащи механизми 8,17,18 при липса на обструктивни атеросклеротични плаки в различни съдови легла (напр. Аорта, бъбреци или коронарни артерии), подобно на хората с ранна атеросклероза. 19 Допълнителна група прасета, хранени с нормална диета в продължение на 16 седмици, бяха използвани като контроли (норма; n = 7). Проби от венозна кръв са взети от всички прасета след 10 и 16 седмици диета, а in vivo и in vitro проучвания са проведени на 16 седмици.
Експресия на бъбречни протеини
Западно петно
Стандартните протоци за попиване се провеждат в хомогенизирана бъбречна тъкан (главно кортикална), както е описано по-горе. 6,9 За подробности вижте онлайн добавката, достъпна на http://www.hypertensionaha.org.
Количествена PCR в реално време
Общата РНК се изолира от бъбреците, използвайки метода TRIZOL (Invitrogen ™). cDNA беше синтезирана с помощта на InvitrogenTM SuperScripTM комплект за синтез на първа верига, както описахме наскоро. 24 Да се изследва експресията на рецепторите ET-1, –ET-A и –ET-B и MMP-2, MMP-9, TIMP-1 и TIMP-2 иРНК, RT-PCR (ДНК двигател OPTICON; MJ Research) беше извършено с помощта на SYBR Green JumpStart ™ Taq Комплект ReadyMix ™ (Sigma). За подробности вижте онлайн добавката.
Имунохистохимията за CD-3 и ED-1 се извършва върху депарафинизирана бъбречна тъкан и за колаген IV в замразени напречни сечения. 12 За подробности вижте онлайн добавката.
Желатинова зимография
ММР-2 и ММР-9 бяха изследвани за желатинолитична активност чрез желатинова зимография, следвайки стандартни процедури. За подробности вижте онлайн добавката.
Анализ на данни
Ръчно проследени региони от интерес бяха избрани в изображенията на EBCT в аортата, бъбречната кора, медулата и папилата и бяха взети проби от тяхната плътност. RBF с един бъбрек, GFR и регионална бъбречна перфузия (mL/g на минута на кубична тъкан) преди и след Ach инфузия са изчислени с помощта на предварително валидирани методи. 7,8,20,21 За подробности вижте онлайн добавката.
Хистология
Средно-хиларните напречни сечения на бъбреците (включително кортикалната и медуларната област) и трансмуралния миокард на лявата камера (1 на животно) бяха изследвани 5,6,8,9, като съотношението съдова среда към лумена беше оценено при 20 до 30 на случаен принцип избрани интраренални и интрамиокардиални съдове, както е описано по-горе. 6,8 За подробности вижте онлайн добавката.
Статистически анализ
Резултатите са изразени като средна стойност ± SEM. Сравненията в групите бяха извършени с помощта на сдвоени Student т тест и сред групи, използващи ANOVA, с корекцията на Bonferroni за множество сравнения, последвани от несдвоен студент т тест. В случай на ненормално разпределение бяха приложени непараметрични (Wilcoxon/Kruskal – Wallis) тестове за сравнение между групите. Статистическата значимост беше приета за P≤0.05.
Резултати
След 10 седмици HC диета, общите и LDL холестерол, както и нивата на Ox-LDL бяха значително и по подобен начин повишени в групите HC-HC и HC-N в сравнение с нормалната група, докато активността на SOD беше значително по-ниска (Таблица). Всички те бяха нормализирани в HC-N след преминаване към 6 седмици нормална диета, но останаха повишени в HC-HC. HDL холестеролът беше подобно подобрен в HC-HC и HC-N в сравнение с контролите на 10 седмици, както показахме по-рано, 25 и остава повишен в HC-HC на 16 седмици. Освен това, след 16 седмици, общите изопростани бяха значително повишени само в HC-HC, докато средното артериално налягане не се различаваше между групите (Таблица). По-рано показахме в нашия модел, че 12-седмичната HC диета постоянно не повишава и кръвното налягане. 8,17,25
Системни характеристики и базална хемодинамика на едно бъбреци (средно ± SEM) при прасета Normal (N), HC (HC-HC) и HC-N
Бъбречна ендотелна функция и оксидативен стрес
Базалният обем на един бъбрек, RBF, GFR и регионалната перфузия, измерени след приключване на протокола, са сходни сред групите (Таблица). Инфузията на Ach при нормални и HC-N животни е свързана със подобно значително увеличение на RBF, GFR (Фигура 1; P≤0,05 спрямо изходно ниво) и корова перфузия (съответно до 5,5 ± 0,5 и 5,7 ± 0,5 ml/g на минута на кубичен кубик; P≤0,05 спрямо изходното ниво), докато медуларната и папиларна перфузия са значително повишени само при нормални животни (P 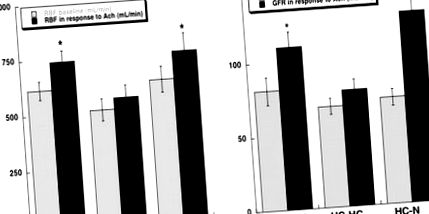
Фигура 1. RBF (a) и GFR (b) на изходно ниво (сиви ленти) и в отговор на Ach (mL/min; черни стълбове) при нормални, хиперхолестеролемични (HC-HC) и HC прасета след понижаване на липидите (HC-N). Обръщането на диетата нормализира притъпените отговори при HC-HC. *P
Съпътствайки притъпената бъбречна функция в HC-HC, експресията на NAD (P) H-оксидаза (субединици gp91phox и p22phox) беше повишена, докато eNOS беше атенюиран в сравнение с нормалните животни (Фигура 2а), което предполага повишен потенциал за генериране на супероксид и намален БЕЗ бионаличност. Освен това, HC-HC показа значително увеличение на експресията на бъбречната иРНК на рецепторите пре-ET-1 и –ET-A, което предполага повишено регулиране на ендогенната ET система (Фигура 2b).
Фигура 2. Експресия на бъбречни протеини на gp91phox, p22phox и eNOS (a) и експресия на иРНК на препро – ET-1, –ET-A и –ET-B рецептори (b) при нормални, хиперхолестеролемични (HC-HC) и хиперхолестеролемични прасета след понижаване на липидите (HC-N). Диетичната интервенция за понижаване на липидите нормализира експресията на gp91phox, p22phox и eNOS и намалява иРНК на рецепторите пре-ET-1 и –ET-A, което предполага намален потенциал за вазоконстрикция. *P
Бъбречна морфология и фиброгенни фактори
HC-HC бъбреците показват повишено периваскуларно и тубулоинтерстициално натрупване на CD-3 + и ED-1 + възпалителни клетки, което е по-очевидно в кората (Фигура 3а и 3b). В допълнение, HC-HC също показва значително увеличение на кортикалната периваскуларна и тубулоинтерстициална фиброза (колаген IV и трихром; Фигура 3c и 3d) и повишено съотношение между лубуларната и дъгообразната артерия към лумена (Фигура 3c, отдолу). Гломерулосклероза не се наблюдава при никоя група.
Фигура 3. Типично бъбречно оцветяване (× 40) за CD-3 (a), ED-1 (b), периваскуларно отлагане на колаген IV (d) и трихром (c; × 20) и бъбречна морфометрия при нормална хиперхолестеролемия (HC-HC) и хиперхолестеролемични прасета след понижаване на липидите (HC-N). Диета-индуцирана хиперхолестеролемия увеличава присъствието на интраренални CD-3 + (кафяво оцветяване; стрелка) и ED-1 + (черно оцветяване; стрелка) възпалителни клетки, както и периваскуларно натрупване на колаген (c, дебела стрелка), тубулоинтерстициална фиброза (d ) и съотношението на средата към лумена (c, отдолу), които бяха върнати след диета за понижаване на липидите. *P
Извънклетъчна матрица
Бъбречната кортикална експресия на профибротичния TGF-β, неговите медиатори Smad-2/3 и Smad-4 и колаген IV са значително увеличени в HC-HC, докато PAI-1 остава непроменен (Фигура 4). За разлика от тях, експресията на протеини MT1-MMP, MMP-2 и MMP-9 е атенюирана в HC-HC, присъствана от повишена експресия на MMP инхибиторите TIMP-1, TIMP-2 и TSP 1/2, което предполага затъпено Влошаване на ECM (Фигура 4). Забележително е, че HC-HC бъбреците също показват намалена активност на MMP-2 и MMP-9, въпреки че експресията на MMP и TIMP иРНК не се различава сред групите (Фигура 5).
Фигура 4. Представителни ленти (отгоре) и денситометрия (отдолу) на бъбречната експресия на протеин на TGF-β, фосфорилирани Smads 2/3 и Smad 4, PAI-1, колаген IV, MMP-9, TIMP-1, MT1-MMP, MMP- 2, TIMP-2 и TSP 1/2 при нормални, хиперхолестеролемични (HC-HC) и хиперхолестеролемични прасета след понижаване на липидите (HC-N). HC-HC бъбреците показват повишено активиране на TGF-β пътя и TSP 1/2 и увеличен TIMP и намалена експресия на MMP протеин, което предполага фиброгенна активност. Обръщането на диетата в HC-N подобри повечето от тези промени. *P
Фигура 5. Бъбречна ензимографска активност (отгоре) и експресия на иРНК (отдолу) на MMP-9 и MMP-2 при нормални, хиперхолестеролемични (HC-HC) и хиперхолестеролемични прасета след понижаване на липидите (HC-N). HC-HC бъбреците показаха намалена активност на MMP-9 и MMP-2 (но не и експресия на mRNA), които бяха подобрени след намеса за понижаване на липидите.
За целите на сравнението ние също изследвахме експресията на MMP в сърцето на същите животни. Интересното е, че MMP-9 е непроменен, но MMP-2 показва силна тенденция към увеличаване на HC-HC в сравнение с нормалното (P= 0,08; допълнителна фигура, достъпна онлайн на адрес http://www.hypertensionaha.org), която е била придружена от значителна миокардна интерстициална фиброза, но запазено съотношение медия-лумен (P= NS).
Интервенция за понижаване на липидите
След 6-седмичната нормална диета, експресията на gp91phox, p22phox, eNOS (Фигура 2), TGF-β/Smads, MMPs/TIMP и TSP 1/2 в HC-N не се различава от нормалната (Фигури 4 и 5 ). Експресията на prepro – ET-1 и –ET-A е значително намалена (макар и не нормализирана) и интрареналното възпаление и фиброза при HC-N намаляват в сравнение с HC-HC (Фигура 3).
Дискусия
Това проучване предполага, че бъбречната фиброза в ранния стадий на атеросклероза е резултат от едновременна модулация на редица пътища на нараняване. HC индуцирана бъбречна ендотелна дисфункция, повишено регулиране на интрареналния ендотел, TIMP и TGF-β системи и притъпени MMPs, като цяло благоприятства бъбречните белези, като улеснява отлагането на ECM и разграждането на матрицата. Важното е, че настоящото проучване също така показва, че диетичната интервенция може отчасти да върне вредните ефекти на хиперхолестеролемията и да намали бъбречните функционални и структурни увреждания.
През последните години бяха положени значителни усилия за изясняване на механизмите на хроничното бъбречно заболяване - все по-често срещано състояние, което често води до разрушаване на бъбреците. 26 Липидните аномалии все повече се признават като основен рисков фактор за прогресия на бъбречното заболяване. 4,27 По-специално, дори краткотрайно излагане на холестерол може да наруши съдовата ендотелна функция, което от своя страна може да улесни увреждането на тъканите, като благоприятства вазоконстрикцията, повишената активност на митогени като ET-1 и намалените буферни ефекти на ендогенния вазодилататор и антимитотик НЕ, което обикновено ограничава възпалението и фиброзата. В действителност, ние по-рано показахме, че 10- до 12-седмична HC диета е била достатъчна, за да наруши значително реноваскуларната функция 18,25 и да предизвика интраренално възпаление, съдово ремоделиране и периваскуларна и тубулоинтерстициална фиброза. 5,6,8,9,12 Настоящото проучване разширява предишните ни наблюдения, като изследва механизмите надолу по веригата, които медиират бъбречно увреждане при хиперхолестеролемия. Наблюдавахме, че хиперхолестеролемията модулира пътища, участващи в динамичния процес на ремоделиране на тъканите, който включва ECM синтез, отлагане и отстраняване.
Редокс-чувствителният TGF-β регулира много основни биологични процеси и е ключов медиатор при хронично бъбречно заболяване. 36 Наблюдавахме по-рано в ранната атеросклероза повишена експресия на тубуларна и гломерулна TGF-β, 8 която може да бъде манипулирана чрез фармакологична намеса. 5,6 Настоящото проучване допълнително показва, че повишената експресия на TGF-β в хиперхолестеролемичния бъбрек е придружена от регулиране и активиране на неговите Smad ефектори, подчертавайки фиброгенната активност. Фосфорилирането на TGF-β рецепторите активира неговите вътреклетъчни сигнални ефектори, Smad протеините, които след това се транслоцират в ядрото, за да регулират транскрипцията. Регулираните с рецептор Smad-2 и Smad-3 се фосфорилират от TGF-β рецептора, процес, който е необходим за свързване със Smad-4 (кооперативен Smad) и следователно инициира набиране на транскрипционни кофактори, участващи в клетъчната пролиферация и растежа на тъканите. 37,38
Перспективи
Настоящото проучване предполага отделен път на бъбречно увреждане при ранна атеросклероза, което изглежда е резултат от координирано увеличение на производството на ECM и притъпена деградация, като цяло благоприятства бъбречните белези. По-голямата продължителност и по-напредналата атеросклероза могат да продължат тези механизми и да ускорят влошаването на бъбречната функция. Независимо от това, обръщането на HC диетата при свинете отслабва бъбречното възпаление, нормализира експресията на повечето фиброгенни фактори и регресира съдова и бъбречна фиброза. По този начин много от тези пътища могат да бъдат обратими, поне в ранната фаза и следователно дават основание за използването на стратегии за понижаване на липидите за запазване на бъбреците при хиперхолестеролемия.
Тази работа беше подкрепена с безвъзмездни средства HL-63282 и HL-77131 от Националните здравни институти и от Американската асоциация по сърдечни заболявания. Благодарим на Stephen S. Cha (Отдел по биостатистика, Медицински колеж Mayo Clinic) за техническа подкрепа със статистическия анализ, представен в това проучване.
- Генетично-епигенетичната модулация на гена CRTC1, предизвикана от психотропни лекарства, е свързана с ранната
- Патофизиология на хипертонична бъбречна хипертония
- Royal Canin Ветеринарна диета Бъбречна поддръжка Суха котешка храна - Отзиви на клиенти
- Royal Canin Veterinary Diet Feline Renal with Fish Страхотни оферти
- Модулация на свързаната с холестерола генна експресия от ергостерол и обогатени с ергостерол екстракти
