Владимир Н. Анисимов
От катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Марк А. Забежински
От Катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Ирина Г. Попович
От катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Татяна С. Пискунова
От катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Анна В. Семенченко
От катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Маргарита Л. Тиндик
От Катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Мария Н. Юрова
От катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Марина П. Антох
От Катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Михаил В. Благошклони
От катедрата по канцерогенеза и онкогеронтология, * N.N. Петров изследователски институт по онкология, Санкт Петербург, Русия; и отделите по молекулярна и клетъчна биология, † и биология на клетъчния стрес, ‡ Розуел Парк Институт за рак, Бъфало, Ню Йорк
Резюме
Стареенето е свързано със затлъстяването и рака. Ограничаването на калории едновременно забавя стареенето и забавя рака. Появиха се доказателства, че чувствителната към хранителни вещества мишена на бозайниците по пътя на рапамицин (mTOR) участва в клетъчното и организмовото стареене. Тук показваме, че mTOR инхибиторът рапамицин предотвратява увеличаването на теглото, свързано с възрастта, намалява скоростта на стареене, увеличава продължителността на живота и потиска канцерогенезата при трансгенни HER-2/neu рани мишки. Рапамицин драматично забавя началото на тумора, както и намалява броя на туморите на животно и размера на тумора. Предлагаме, като забавя стареенето на организма, рапамицинът забавя рака.
Материали и методи
Животни и експериментален дизайн
Хомозиготни FVB/N HER-2/neu трансгенни мишки, първоначално получени от река Чарлз (Холистър, Калифорния) от Италианския национален изследователски център за стареене (INRCA), бяха настанени и отглеждани в Департамента по канцерогенеза и онкогеронтология, Н.Н. Петров изследователски институт по онкология. Мишките получават стандартна лабораторна чау и вода от чешмата ad libitum. 23, 24 Всички проучвания са проведени в съответствие с етичните стандарти и в съответствие с националните и международни насоки и са одобрени от институционалния съвет за преглед на авторите.
Изследване на дълголетието
Петдесет и осем 2-месечни женски мишки FVB/N HER-2/neu бяха разделени на случаен принцип в две групи. Първата група животни са получавали 1,5 mg/kg рапамицин (LC Laboratories, Woburn, MA) подкожно (s.c.) 3 пъти седмично за период от 2 седмици, последвани от двуседмични интервали без рапамицин. Мишките от втората група получиха s.c. 0,1 ml разтворител без рапамицин и служи като контрола. Рапамицинът се разтваря в 95% етанол и след това се разрежда с апирогенна стерилна вода до крайна концентрация 38 μg в 0,1 ml 2% етанол.
Веднъж седмично всички мишки се палпират за откриване на появата на тумори на млечната жлеза. Регистрирани са локализацията и големината на туморите. Неопластичните маси се измерват с дебеломер и прогресивно нарастващи маси със среден диаметър> 3 mm се считат за тумори. Средният брой осезаеми карциноми на млечната жлеза на мишка се изчислява като кумулативен брой тумори на общ брой мишки, носещи тумор. Животните се претеглят веднъж месечно и се наблюдават през целия им живот. 23, 24
Патоморфологично изследване
Всички животни са били аутопсирани. Всички тумори, както и тъканите и органите със съмнение за развитие на тумор, бяха изрязани, фиксирани в 10% буфериран формалин и вградени в парафин. Хистологичните срезове от пет μm бяха оцветени с хематоксилин и еозин и бяха изследвани микроскопски. Туморите са класифицирани според препоръките на Международната агенция за изследване на рака, както е описано. 23, 24
Статистика
Експерименталните резултати бяха обработени статистически по методите на статистиката на вариациите с използването на STATGRAPH статистически програмен комплект, както беше описано по-горе. 23, 24 Значимостта на несъответствията е дефинирана според критерия Student на t, точен метод на Fischer, χ 2, непараметрични Wilcoxon – Mann-Whitney и Friedman RM ANOVA за ранговете. Методът Student-Newman-Keuls е използван за всички двойни многократни сравнения. Коефициентът на корелация е изчислен по метода на Спирман. 23, 24 Разликите в честотата на тумора са оценени чрез Mantel – Haenszel log-rank тест.
Параметрите на модела Gompertz бяха изчислени с помощта на метод на максимална вероятност, нелинейна процедура за оптимизация и самонаписан код в ‘Matlab’; доверителните интервали за параметрите са получени с помощта на метода bootstrap (вж. Anisimov et al. 23, 24).
За експериментална група е използван регресионният модел на Кокс за оценка на относителния риск от смърт и развитие на тумора при лечението в сравнение с контролната група: h (t, z) = h0 (t) exp (zβ), където h (t, z) и h0 (t) означават съответно степента на опасност и изходната степен на опасност, β е неизвестният параметър за третираната група, а z приема стойности 0 и 1, като е индикаторна променлива за две проби - контролната и третираната група.
Полупараметричен модел на хетерогенна смъртност 23, 24 е използван за оценка на влиянието на лечението върху разпределението на немощността и изходния риск.
Математическо моделиране на резултатите
За групата, лекувана с рапамицин (група с рапамицин), регресионният модел на Кокс е използван за оценка на относителния риск от смърт и развитие на тумора при лечението в сравнение с контролната група: h (t, z) = h0 (t) exp (zβ), където h (t, z) и h0 (t) означават съответно степента на опасност и базова степен на опасност, β е неизвестният параметър за групата на лечение, а z приема стойности 0 и 1, като е индикаторна променлива за две проби - контролата и група за лечение. За групата на рапамицин относителният риск от смърт и първото туморно развитие е по-нисък (exp (β) 1 показва натрупване на немощни индивиди в популацията в сравнение с контролната група. Параметър γ ≠ 1 показва увеличение (γ> 1) или намаляване (γ 2 ≠ 0). Групата мишки, лекувани с рапамицин, има леко повишен изходен риск в сравнение с контролната група (параметри α> 0, β> 0). Експерименталната група е средно по-слаба (r> 1) и по-хетерогенна (γ> 1), в сравнение с контролната група.
Резултати
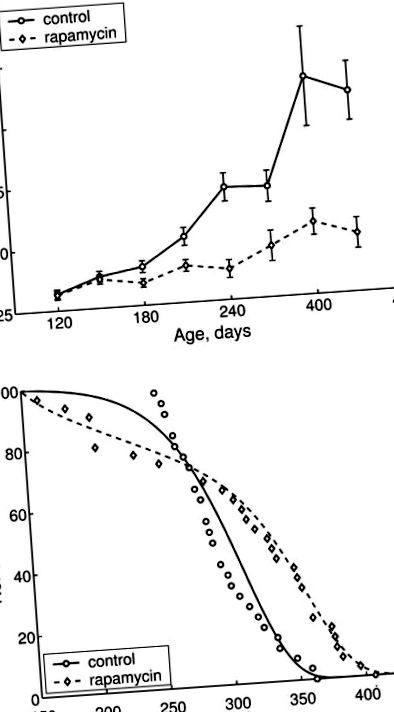
Лечението с рапамицин значително инхибира свързаното с възрастта наддаване на тегло (Фигура 1А). Докато контролните мишки непрекъснато натрупват тегло по време на живота си, мишките, получавали рапамицин, демонстрират много скромно увеличение на теглото. В резултат на това за периода между 4 и 10 месеца теглото на контролните животни се е увеличило с 62% и само със 17,5% в групата, лекувана с рапамицин (P> 0,05; Фигура 1А). Най-важното е, че в контролната група само 4 мишки оцеляват до 11 месеца (14,3%) в сравнение с 13 животни (43,3%) в групата, лекувана с рапамицин (Р Фигура 1В и Таблица 1). Лечението с рапамицин увеличава средната стойност (+ 4,1%) и максималната продължителност на живота (+ 12,4%; Таблица 2). За отбелязване е, че увеличението на средната продължителност на живота е относително умерено, тъй като е притъпено от независимата от стареенето смъртност (Фигура 1В, дни от 150 до 250). Средната продължителност на живота на дългоживеещите животни (последните 10% от оцелелите) е значително по-голяма в групата, получавала рапамицин (+ 11%) в сравнение с контролата. Параметър α на модела Gompertz, който се интерпретира като скорост на стареене, е 1,8 пъти по-нисък в групата, подложена на лечение с рапамицин, отколкото при контрола. Всички разлики между контролната и експерименталната групи са статистически значими (Таблица 2) .
Ефекти на рапамицин върху свързаното с възрастта наддаване на тегло и продължителността на живот на женски трансгенни HER-2/neu мишки. A: Ефект на рапамицин върху телесното тегло при женски трансгенни мишки HER-2/neu. Групата на рапамицин животни получава 1,5 mg/kg рапамицин три пъти седмично за период от 2 седмици, последвани от 2-седмични интервали без рапамицин. Мишките от контролната група получиха разтворител без рапамицин. Мишките се претеглят веднъж месечно. Б: Ефект на рапамицин върху оцеляването на мишките. Мишките бяха наблюдавани през целия им живот и всички животни бяха аутопсирани. Разпределението на продължителността на живота в контролната и експерименталната група е значително различно (log-rank тест, P = 0,00588). Динамиката на оцеляване показва значителни разлики.
маса 1
Ефект на рапамицин върху разпределението на оцеляването при женски HER-2.neu мишки
| Контрол | 28 | 28 | 28 | 28 | 21. | 9 | 4 | 0 | 0 | 0 |
| Рапамицин | 30 | 29 | 24 | 23. | 22. | 19 * | 13 * | 6 * | 2 | 0 |
Разликата със съответната възраст в контролната група е значителна:
Разликата с контролите е значителна,
Кинетиката на туморната честота при мишки, лекувани с рапамицин, е значително по-бавна от кинетиката при контролни животни (Фигура 2, А и В). По този начин, 50% от контролните мишки развиват аденокарцином на млечната жлеза до 206-ия ден, докато в групата, лекувана с рапамицин, този период е удължен до 240 дни. Забележително е, че рапамицинът намалява средния брой тумори на тумороносната мишка с 33,7% и средния размер на аденокарцинома на млечната жлеза с 23,5% (Таблица 3) .
Потискане на канцерогенезата от рапамицин. A: Ефект на рапамицин върху кривите на добива на тумор при женски трансгенни мишки HER-2/neu. Б: Ефект на рапамицин върху кумулативния брой тумори при женски трансгенни HER-2/neu мишки. ° С: Ефект на рапамицин върху разпределението на мишки с множество тумори на млечната жлеза при женски трансгенни мишки HER-2/neu. Звездички означава, че според точния тест на Fisher за данни за преброяване разпределението на броя на мишките, носещи 1 до 4, 5 до 7 и 8 до 10 тумори е значително с P = 0,0006959.
Таблица 3
Ефект на рапамицин върху развитието на млечни аденокарциноми (MAC) при трансгенни HER-2/neu мишки
| Брой мишки | 28 | 30 |
| Брой мишки, носещи тумор,% | 28 (100%) | 23 * (76,7%) |
| Средна латентност на първия аденокарцином на млечната жлеза, дни | 206 ± 3,3 | 240 ± 8,9 † (+ 16,5%) |
| Общ брой аденокарциноми на млечната жлеза | 233 | 126 |
| Брой тумори на мишка, носеща тумор | 8,3 ± 0,3 | 5,5 ± 0,6 † (−33,7%) |
| Среден размер на MAC, cm 3 | 1,7 ± 0,04 | 1,3 ± 0,08 † (−23,5%) |
| Брой мишки с MAC метастази в белите дробове,% | 10 (37,0%) | 12 (+ 52,2%) |
| Средно време на смърт на мишки, носещи метастази | 301 ± 10,9 | 357 ± 7,9 † (−18,6%) |
| Среден размер на MAC, cm | 0,5 ± 0,05 | 0,5 ± 0,06 |
Разликата с контролите е значителна,
Дискусия
Важно е, че както демонстрираме тук, рапамицин удължава максималната продължителност на живота, дори когато се прилага периодично (две последователни седмици, последвани от двуседмична почивка). Това е напомняне за удължаване на живота и превенция на рака, причинено от периодична CR. Например, гладуването забавя рака при p53 -/- мишки, дори ако се прилага веднъж седмично и започва късно в живота. 36 Предполагаме, че забавянето на процеса на стареене, причинено от периодично приложение на рапамицин, би било от полза за хората с висок риск от рак. Това е особено важно, като се има предвид, че съществуващите химиопрофилактични методи не са демонстрирали удължаване на живота.
Благодарности
Благодарим на трима анонимни рецензенти за полезни коментари и предложения.
- Руски учени създават хуманизирани мишки за тестване на лекарства и ваксини за COVID-19; Новини-Медицински
- Нова активност за намаляване на теглото на Galega officinalis при мишки - PALIT - 1999 - Pharmacy Journal
- Перинаталното излагане на мишки на пестицида DDT влошава енергийните разходи и метаболизма при възрастни
- Статините и фибратите не влияят върху развитието на спонтанно увреждане на хрущяла при STROrt мишки -
- Изследване върху мишки предполага, че лекарството за превръщането на мазнини в кафяво може да помогне в борбата със затлъстяването - ScienceDaily