Николас Г. Нориц
1 Катедра по физиология, анатомия и генетика, Университет в Оксфорд, Оксфорд, Великобритания
2 Харвардско медицинско училище, Бостън, Масачузетс, САЩ
Вивяне Лох
3 Transform Alliance for Health, Нютон, Масачузетс, САЩ
Свързани данни
Всички набори от данни, генерирани за това проучване, са включени в статията/допълнителния материал.
Резюме
Кетогенните диети с високо съдържание на мазнини и ниско съдържание на въглехидрати напоследък станаха популярни за отслабване и лечение на множество хронични заболявания; въпреки това общата медицинска общност все още изразява загриженост относно въздействието на диетите с високо съдържание на мазнини върху серумните липиди и сърдечно-съдовия риск. Тук докладваме за млад мъж, който е приел кетогенна диета за лечение на възпалително заболяване на червата. Между другото, бяха отбелязани промени в серумните му липиди, които според настоящите стандарти биха били считани за неблагоприятни. По-критичният анализ на липидния му профил предполага, че промените, които е преживял, може да не са опасни и поне по отношение на няколко параметъра да представляват подобрения. Това изследване на случая демонстрира как начинът, по който липидните панели често се докладват и преглеждат, може да доведе до подвеждащи заключения и подчертава, че поне в грижите за тези, които са на кетогенна диета, трябва да се провеждат по-нюансирани анализи на липидните субфракции, за да могат лекарите за осигуряване на оптимални грижи и клинични препоръки.
Въведение
Кетогенните диети са диети с високо съдържание на мазнини и ниско съдържание на въглехидрати, които карат черния дроб да генерира кетонни тела, особено кетонното тяло β-хидроксибутират, метаболитен енергиен източник и сигнална молекула, еволюционно проектирана да захранва мозъка и тялото по време на недостиг на въглехидрати. Въпреки че досега клиничните проучвания за прилагане на кетогенни диети са били трудни за провеждане и все още са необходими повече изследвания, съвкупност от данни показва, че кетогенните диети могат да бъдат полезни при лечението на широк спектър от хронични заболявания, които споделят възпалението като обща основна патология ( 1–7). Едно от тези заболявания е улцерозен колит, възпалително заболяване на червата. Кетогенните диети могат да овладеят възпалението в стомашно-чревния тракт, като инхибират активността на NLRP3 инфламазома (8), насърчават регенерацията на чревните стволови клетки и оздравяването на червата (9) и стимулират освобождаването на жлъчни киселини, които улесняват хомеостазата на чревната имунна система (10, 11 ).
Описание на случая
300 g), 15–20%, получени от протеин (
130 g) и 4-5%, получени от въглехидрати (
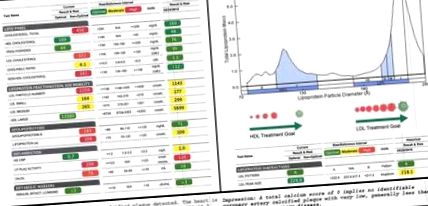
30 g). Основните му източници на мазнини, протеини и въглехидрати включват екстра върджин зехтин и авокадо, морски дарове и зеленчуци с високо съдържание на фибри с ниско съдържание на въглехидрати. В рамките на 1 седмица след приемането на тази кетогенна диета в средиземноморски стил, неговите стомашно-чревни симптоми се подобриха и неговият фекален калпротектин спадна от 123 на 19 μg/g, което е в нормалните граници на Фигура 1А). Тези на пръв поглед неблагоприятни и драматични промени бяха компенсирани в малка част от подобрението на неговия HDL-C от 48 на 109 mg/dL. Тъй като общият холестерол, HDL-C и LDL-C са параметрите на холестерола, отчетени в стандартен липиден панел, това са мерките, които обикновено се използват за насочване на грижата на субекта. В действителност, според модифицируемите критерии за оценяване на рисков фактор, подобни на тези, получени от Framingham, но установени за лица на възраст 15–34 години, тези промени привидно представляват четирикратно увеличение на риска на субекта за атеросклероза (16). В този обект обаче беше преследван пълен фракциониран панел, който допълнително включваше разбивка на основата на размера на липопротеиновите частици LDL и HDL на субекта, броя на LDL и HDL частиците, маса Apo (B), oxLDL, Lp (a) и PL -PLA2 активност (Фигури 1А, В).
Субфракциониране на липидите. (А) Изходните липиди на субекта, преди да започне кетогенната си диета, са показани вдясно. Неговите 7-месечни проследяващи липиди са показани вляво. Зеленото, жълтото и червеното означават съответно оптимален, среден и висок сърдечно-съдов риск въз основа на стандартни референтни диапазони на изолирани променливи. (Б) Разпределението на липопротеините по размер на субекта се характеризира с мултимодално разпределение на HDL, като най-големият пик е в големия HDL и силно пристрастие в LDL далеч от атерогенни, малки LDL и към големи LDL. (° С) Резултати от сканирането на калци на коронарните артерии на субекта, извършено по време на 7-месечното проследяване, показващо малко до никакво натрупване на калцирана плака.
Трябва да се отбележи, че по време на 7-месечното проследяване също беше извършено сканиране на калций на коронарните артерии като функционален анализ на образуването на плака. Не разкрива значими открития и отчита резултат от 0, което предполага липса на признаци на калцирани атерогенни плаки (Фигура 1С).
Дискусия
Стандартен липиден панел би разкрил, че по този въпрос кетогенната диета предизвиква голямо увеличение на общия холестерол и LDL-C, измествайки двата параметъра от „оптималния” диапазон до повече от два пъти прага за „високорисковия” обхват. Дори по отношение на субфракционирането, визуалните ефекти на самия доклад посочват причина за клинична загриженост: огромна промяна в цветовите параметри от нормализиране на зелено/жълто до тревожно жълто/червено (Фигура 1). Следователно е вероятно, ако този субект е бил анализиран само от стандартен липиден панел или ако резултатите от субфракционирането не са били цялостно и критично изследвани, клиничната препоръка би била субектът да прекрати своята кетогенна диета, предполагаем агент на неговия ремисия на колит. Освен това на този субект може също да е предписан статин на 24 години. Предвид смесените доказателства за употребата на статини за първична профилактика и възможността дългосрочната употреба на статини при лица с нисък риск (включително тези с оценка на калция на коронарните артерии 0) може да допринесе за атеросклероза (17), такава препоръка би могла да са имали отрицателни дългосрочни последици за здравето на сърдечно-съдовата система.
Това, което следва, е по-нюансиран анализ и обсъждане на най-важните промени в липидния панел на субекта, които ние предлагаме да не осигуряват толкова голямо увеличение на риска, колкото бегъл анализ на някои изолирани мерки и цветовата схема на доклада, в противен случай предполагат. Може дори да се направи аргумент, че тези промени представляват подобрение.
След това можем да изследваме LDL холестерола като основен фактор за увеличаване на общия холестерол на субекта. Между изходното ниво и проследяването LDL-C на субекта се е увеличил от 90 на 321 mg/dL, като първата мярка е маркирана като „оптимална“, а втората, в тревожно червено, е два пъти прага на „високорисков“ ( Фигура 1А).
Не всички LDL частици обаче са равни. Връзката между LDL-C и сърдечно-съдовия риск се определя от връзката между LDL-C и атерогенен малък плътен и/или окислен LDL (12, 13). Това са предимно малките плътни и/или окислени LDL частици, които могат да проникнат в ендотелната стена, да бъдат погълнати от циркулиращи макрофаги и да допринесат за образуването на пяна и плака (31, 32). За разлика от това, големите LDL частици не показват връзка със сърдечно-съдовия риск и всъщност могат да бъдат кардиопротективни (13, 33). Прегледът на промяната на субекта в LDL-P (от 1143 на 2259) и субфракционирането на LDL въз основа на размера разкрива, че увеличаването на неговия LDL се обуславя изключително от увеличаване на големи LDL. И неговият малък и среден LDL дори показват намаления съответно от 8 и 11% (Фигура 1А).
Тъй като биологичната функция на LDL е поне отчасти да пренася триглицериди от черния дроб до периферните тъкани като източник на гориво, изобщо не е изненадващо, че субектът показва увеличение на големи LDL предвид диетата си с високо съдържание на мазнини. Освен това фактът, че само неговият голям LDL се увеличава, предполага, че големите LDL частици на субекта не са склонни да се разпадат с течение на времето в средни и малки LDL. Посочено по-директно, специфичното увеличение на субекта в големи LDL е в съответствие с увеличаване на скоростта на оборот на LDL и усвояването на черния дроб.
Това представлява положителен и адаптивен отговор на преминаването на субекта от метаболитни горива на базата на въглехидрати към метаболитни горива на базата на мазнини. Този анализ и дискусия на метаболизма на LDL също обяснява защо увеличаването на LDL-P и Apo (B), и двете, задвижвани от увеличаване на големи LDL-P, също могат да представляват здравословни и положителни адаптации.
На трето място, можем да разгледаме по-малко известна и изследвана липопротеинова частица, Lp (a). Структурно Lp (a) е много подобен на LDL, с изключение на това, че добавен към Apo-B100, той има гликопротеинова опашка, аполипопротеин (a). Самият аполипопротеин (а) е изключително подобен по последователност и форма на плазминоген, ензимът, който, когато се активира, се свързва и разгражда фибрина, за да разгради кръвните съсиреци. Въпреки това, аполипопротеин (а) няма същата протеазна активност като плазминогена. По този начин Lp (a) може да се конкурира с плазминоген за свързване на фибрин (инхибиране на фибринолизата) и да допринесе за образуването на ендотелни съсиреци, т.е. атерогенни плаки (34). Следователно има смисъл, че нивата на Lp (a) корелират положително със сърдечно-съдовия риск (35).
Друга роля за Lp (a) също е хипотезирана, следвайки наблюденията, че 90% от окислените липопротеини (oxLPs), свързани с ApoB-съдържащи липопротеини, всъщност са свързани с Lp (a) и че LP-PLA2, ензим, който разгражда атерогенните oxLPs, се свързва с Lp (a). Предполага се, че Lp (a) -LP-PLA2 действа като чистач на oxLPs (36). Следователно, увеличаването на активността на субекта в Lp (a) и LP-PLA2 може да бъде адаптивна реакция към повишаването на неговия оксидативен статус, белязано от увеличаването на неговия oxLDL (Фигура 2).
Стандартна липидна панел срещу липидна субфракциониране. Лявата колона означава промени, предизвикани от диетата на субекта, които биха били открити на стандартен липиден панел, заедно с вероятния курс на клинично действие. Средната дясна колона обозначава промените, които са били открити чрез субфракциониране, а отдолу - препоръчаният клиничен курс на действие. Червеното показва промените, за които се предполага, че са отрицателни; зелено показва промените, за които се предполага, че са положителни. Apo (B) се поставя в скоби, под големи LDL, тъй като нарастването на масата на Apo (B) на субекта се дължи на неговото увеличаване на големи LDL. Диаграмата в крайната дясна колона илюстрира хипотезата, че повишената активност на Lp (a) и LP-PLA2 на субекта може да представлява адаптивни, защитни отговори на увеличаването на неговия oxLDL.
За да се намеси допълнителен нюанс, преди да се върнете към темата за oxLDL на субекта, възможно е повишената му активност на LP-PLA2 изобщо да не представлява риск, тъй като (i) върху частици, съдържащи Apo-B, LP-PLA2 е най-активен при малки LDL (37, 38) и (ii) свързаната с HDL активност LP-PLA2 може да бъде антиатерогенна (36, 39, 40). Следователно, ниското съотношение на малки LDL към HDL-частици на този субект може да крие кардиопротективен фактор зад прикритието на атерогенен.
Увеличението на oxLDL на субекта е единичната промяна, която според нас най-вероятно е отрицателна. Като се има предвид, че промяната в диетата на субекта включва увеличаване на приема на склонни към окисляване полиненаситени мазнини (под формата на ядки, семена и мазни риби) и намаляване на приема на продукти, съдържащи антиоксиданти (включително съдържащи витамин С) цитрусови плодове) не е изненадващо, че неговият oxLDL се е увеличил. Специално отбелязваме витамин С като антиоксидант, тъй като друга предложена функция на Lp (a) е като заместител на витамин С (34). Тази хипотеза произтича от наблюденията, че (i) животните, които произвеждат ендогенно витамин С, обикновено не притежават Lp (a) или не проявяват сърдечни заболявания; (ii) има обратна връзка между нивата на витамин C и Lp (a), и ( iii) витамин С е от съществено значение в процеса на синтез на колаген и възстановяване на ендотели. По този начин еволюционно адаптивният отговор на недостатъчен витамин С би бил повишаване на нивата на антифибринолитичен фактор, Lp (a), за индуциране на образуването на съсиреци и предотвратяване на излишното кървене (34).
Следователно предполагаме, че този субект е увеличил приема на храни с ниско съдържание на въглехидрати, съдържащи витамин С (като ягоди, чушки, броколи и карфиол) и/или добавка с витамин С, както и да намали приема на полиненаситени мазнини, като ги замени за по-устойчиви на окисляване мононенаситени мазнини и евентуално някои наситени мазнини, които са по-малко склонни да повлияят LDL (включително необработени/сурови кокосови продукти и богато на стеаринова киселина какао), той ще покаже намаляване на oxLDL и последващо намаляване на Lp ( а) и LP-PLA2 активност (Фигура 2). Тези клинични препоръки са направени, но предметът на това проучване е преместен и понастоящем не е достъпен за проследяване.
Нашият доклад има няколко ограничения. Първо, при този пациент не са проследени серумни цитокини (като TNF-α и IL-1β) или серумен ендотоксин. Би било информативно да се документира дали неговата кетогенна диета подобрява тези маркери, въпреки постоянното му ниско ниво на hsCRP, както се съобщава при други пациенти, приемащи кетогенна диета (3). Освен това е жалко, че този обект понастоящем не е достъпен за проследяване, за да се документира дали препоръчаната корекция на диетата му е променила нивата на Lp (a), LP-PLA2 и oxLDL, както предположихме. Независимо от това, нашият анализ на субфракционирането на този субект, във връзка с функционалното наблюдение, че калциевият резултат на коронарната артерия е 0, което показва, че не се образува атеросклеротична плака, твърди, че промените в липидите му може да не са отрицателни, а по-скоро положителни.
Резюме и значение
Тук докладвахме за субект, който е приел кетогенна диета за улцерозен колит, която успешно поставя състоянието му в ремисия, но също така е свързана с привидно неблагоприятна промяна в серумния му липиден профил. По-задълбочен анализ на тези промени в липидния профил разкри, че много параметри всъщност могат да бъдат положителни. Следователно, вместо да препоръчаме на субекта да се откаже от диетата, която се е оказала успешна при лечението на заболяването му, ние препоръчаме лека хранителна адаптация, за да видим дали това оптимизира липидния му профил и здравето.
Значението на този доклад е тройно: (i) Въпреки че клиничните анекдоти разкриват, че кетогенните диети могат да подобрят симптомите на пациенти, борещи се с възпалителни заболявания на червата, има малко публикувани данни по темата (вероятно поради високата вариабилност сред човешките микробиоми и, по този начин, отзивчивостта на пациента). Този доклад документира случай, при който кетогенната диета ясно подобрява симптомите на колит на пациента и лабораторните възпалителни маркери. (ii) Тук предоставяме данни, които категорично предполагат, поне в случай на субекти на кетогенна диета, стандартните липидни панели може да не са достатъчни и че може да са необходими анализи на липидни субфракционирания, за да се предоставят оптимални клинични препоръки. В заключение, (iii) този случай представлява пример за положителната тенденция в медицината далеч от основното лечение и към цялостната, персонализирана и интегративна грижа.
Декларация за наличност на данни
Всички набори от данни, генерирани за това проучване, са включени в статията/допълнителния материал.
Декларация за етика
Етичен преглед и одобрение не се изисква за проучването върху човешки участници в съответствие с местното законодателство и институционалните изисквания. За това проучване не се изисква писмено информирано съгласие за участие в съответствие с националното законодателство и институционалните изисквания. Получено е писмено информирано съгласие от лицето (лицата) за публикуване на всякакви потенциално идентифицируеми изображения или данни, включени в тази статия.
Принос на автора
Всички изброени автори са направили съществен, пряк и интелектуален принос за произведението и са го одобрили за публикуване.
Конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
Благодарности
Quest Diagnostics - Cleveland HeartLab Cardiometabolic Center of Excellence предостави тестването на този доклад. Изследваният субект би искал също да признае подкрепата на семейството си и близък приятел, г-н Томас Делауер.
Терминологичен речник
Съкращения
| Апо (Б) | аполипопротеин В |
| HDL-C | HDL съдържание на HDL частици |
| HDL-P | Брой HDL частици |
| hsCRP | високочувствителен С-реактивен протеин |
| LDL-C | LDL съдържание на LDL частици |
| LDL-P | Брой LDL частици |
| Lp (а) | липопротеин (а) |
| LP-PLA2 | липопротеинова асоциирана фосфолипаза А2 |
| oxLDL | окислен LDL. |
Бележки под линия
Финансиране. NN би искал да благодари на Фондация „Мемориал на Кисби“ за финансирането на изследванията му в Оксфорд.
- Изкуствени подсладители могат ли да причинят увеличаване на теглото SCNM Грижа за пациентите
- Бегач с болка в коляното Грижа за пациента онлайн
- Липиден панел за кръвен тест
- Грижи за пациента на легло в дома HealthCare atHOME
- Допълнена диета с високо съдържание на мазнини и ниско съдържание на въглехидрати за лечение на клиничен рак на глиобластом