Минглун Цай
Катедра по психосоматични вътрешни болести, Висше училище по медицински и дентални науки в Университета Кагошима, Кагошима, Япония
Акихиро Асакава
Катедра по психосоматични вътрешни болести, Висше училище по медицински и дентални науки в Университета Кагошима, Кагошима, Япония
Харука Амитани
Катедра по психосоматични вътрешни болести, Висше училище по медицински и дентални науки в Университета Кагошима, Кагошима, Япония
Акио Инуи
Катедра по психосоматични вътрешни болести, Висше училище по медицински и дентални науки в Университета Кагошима, Кагошима, Япония
Резюме
Лептинът има решаваща роля в регулирането на приема на храна и поддържането на метаболитната хомеостаза. Въпреки че малко се знае за процеса на секреция на лептин, се смята, че инсулинът, който играе важна роля в метаболизма на глюкозата и липидите, регулира секрецията на лептин чрез посттранскрипционен механизъм в краткосрочен план и чрез метаболизма на глюкозата в дългосрочен план. Стомашната лигавица отделя лептин, но този механизъм не е напълно изяснен. Разбирането на механизма на регулиране на инсулиновата секреция на лептин може да доведе до разработването на нови методи за лечение на затлъстяването и съпътстващите го заболявания, които са сериозни опасения за общественото здраве.
ВЪВЕДЕНИЕ
Лептинът, 167 – аминокиселинен хормон, е открит през 1994 г. [1] и се секретира главно от адипоцити. Нивата на плазмен лептин значително корелират с индекса на телесна маса (ИТМ) и общото количество телесни мазнини. [2,3] Неотдавнашно проучване съобщава, че общата мастна маса е най-силният предиктор за циркулиращия лептин. [4] Откритието на лептин стана ясно, че мастната тъкан е не само регулатор на телесното тегло, но и ендокринен орган с обратни връзки между мозъка и периферните тъкани. Лептинът има решаваща роля в регулирането на приема на храна и разхода на енергия. Лептинът се получава от стомашната лигавица и плацентата. [5,6] По-специално, стомашната лигавица е единствената тъкан, секретираща лептин по екзокринен, а не по ендокринен начин. [7]
Плазмените нива на лептин намаляват по време на гладуване [8] или ограничаване на енергията [9] и се увеличават по време на хранене, [10] прехранване, [11] и хирургичен стрес. [12,13] Съобщава се, че инсулинът, глюкокортикоидите, серотонинът и естрогенът стимулират секреция на лептин. [14–17] В тази статия ние се фокусираме върху регулирането на секрецията на лептин чрез инсулин.
ОТНОШЕНИЕ НА БЪЛГАРСКАТА ЕЦЕНТРАЦИЯ НА Л ЕПТИН И НСУЛИН В ХУМАНИ И РОДЕНТИ
Плазменият лептин е свързан с ИТМ при затлъстели лица и с плазмените нива на инсулин на гладно. При хората плазмените нива на лептин показват пулсиращ и циркаден модел, достигайки връх през нощта и достигащ своя най-нисък сутрин. [18–20] Sinha и сътр. Съобщават, че циркадният ритъм на нивата на лептин не е свързан с нивата на инсулин или приема на храна . [18] За разлика от това, Schoeller et al, предполагат, че дневните нива на лептин се променят от времето на хранене. [20] Проведени са много проучвания за връзката между повишаването на инсулина и лептина след хранене; заключенията за ефекта на инсулина върху лептина обаче са противоречиви.
Dagogo-Jack и съавт. Съобщават, че нивата на плазмен лептин не се променят след хранене и стигат до извода, че поне в краткосрочен план инсулинът не увеличава секрецията на лептин при хората. [21] Някои изследователи съобщават за подобни резултати. [22–24] Резултатите от проучвания, използващи глюкозната скоба, подкрепят констатацията, че инсулинът не е краткосрочен регулатор на секрецията на лептин. Физиологичните и супрафизиологичните евгликемично-хиперинсулинемични скоби не променят нивата на плазмен лептин в отговор на инсулин до 120 или 200 минути, независимо от инсулиночувствителния или инсулинорезистентния статус на пациентите, [25,26] и плазмените нива на лептин се увеличава само след повече от 4 часа. [27–29] Подобни находки са докладвани при пациенти със захарен диабет тип 2. [28,30] Vidal и сътр. съобщават, че нито ограничението на калориите, нито 3-часовата евгликемично-хиперинсулинемична скоба променят нивото на лептин иРНК в абдоминалната подкожна мастна тъкан, въпреки промените в метаболитните параметри като намалена инсулинемия, гликемия и метаболизъм в покой и повишени плазмени кетонни тела. Те предполагат, че експресията на лептинов ген или не се регулира остро, или не се регулира от метаболитни фактори, свързани с гладуването. [31]
От друга страна, Saad et al, съобщават за противоречива констатация. Те наблюдават остро повишаване на нивата на лептин в плазмата след хранене [32]. Подобни резултати са докладвани от Saad et al, които са използвали глюкозна скоба при хора. Авторите предполагат, че няколко предишни проучвания очевидно са пренебрегнали намаляването на нивата на лептин поради инфузия на физиологичен разтвор и следователно не са могли да открият острия ефект на инсулина върху лептина. [33] Carlson et al, съобщават, че повишаването на лептина след хранене съответства на нивата на инсулин на 15 и 30 минути [34] Увеличение на лептина след хранене също е отчетено при гризачи. [35,36] Otukonyong и сътр. Заявяват, че секрецията на лептин се влияе от консумацията на храни с високо съдържание на мазнини, като по този начин увеличава инсулина до 200 минути след приема на храна. [36] Koopmans et al, съобщават, че фармакологичната инфузионна инфузия стимулира повишаване на лептина за 2 часа, въпреки че са необходими 4 часа, за да се наблюдава повишаване на нивата на лептинов плазмен разтвор след физиологична инфузионна инфузия при гризачи. Pagano et al, също съобщават, че инсулинът има остър ефект върху секрецията на лептин. [38] Освен това инсулинът е важен за предизвикване на остро повишаване на плазмените нива на лептин при плъхове с диабет, индуциран от стрептозотоцин. [39,40]
В допълнение към евгликемично-хиперинсулинемични скоби, се съобщава и за хипогликемично-хиперинсулинемична скоба. [41] По време на хиперинсулинемична евгликемия, серумните нива на лептин постепенно се повишават след 180 минути. Въпреки това, лептиновият профил, наблюдаван при използване на хипогликемична скоба, се различава от лептиновия профил при евгликемични условия: увеличението е по-малко и се забавя. Освен това, Wellhoener et al, показват по-малко увеличение на серумните нива на лептин по време на хипогликемични състояния, отколкото по време на евгликемични състояния, въпреки идентичните скорости на инфузия на инсулин; общото количество декстроза, вливано по време на скобата, е значително свързано с промените в серумните нива на лептин. [42] Те предполагат, че секрецията на лептин е свързана главно с метаболизма на глюкозата при хората. Намалената секреция на лептин по време на гладуване може да се дължи, пряко или косвено, на спада на нивата на глюкозата. Отслабващият ефект на продължителната хипогликемия върху индуцираната от хиперинсулинемия секреция на лептин може да бъде причинен от отговора на хипогликемия, а не от самата хипогликемия.
КРЕТИРАНЕ НА Л ЕПТИН ОТ ДИПОЦИТИ, СИМУЛИРАНИ ОТ I НСУЛИН
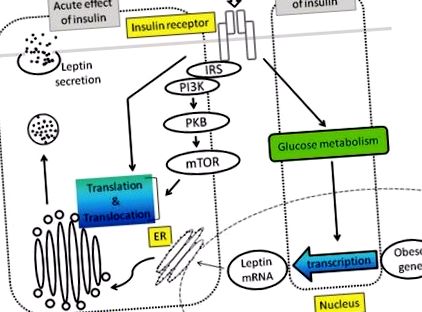
Дали регулирането на инсулиновата секреция на лептин при хора и гризачи е остро, продължаването от минути до няколко часа е противоречиво. От друга страна, in vitro проучвания разкриват, че инсулинът не влияе на нивата на лептин mRNA в продължение на няколко часа. Инсулиновата стимулация на лептиновата секреция е илюстрирана на фигура 1 .
Секреция на лептин Инсулинът стимулира секрецията на лептин чрез посттранскрипционен механизъм, който се медиира главно от пътя PI3K-PKBmTOR или други неизвестни пътища. Предполага се, че хроничният ефект на инсулина се медиира от метаболизма на глюкозата.
IRS: Инсулинов рецепторен субстрат, PI3K: Фосфоинозитид 3-киназа, PKB: Протеин киназа В, mTOR: бозайник мишена на рапамицин, ER: Ендоплазматичен ретикулум
Moreno-Aliaga et al, демонстрираха в клетки 3T3-L1, че mRNA на лептин се повишава след 48 часа лечение с инсулин и се инхибира от 2-дезокси-D-глюкоза (2-DG), конкурентен инхибитор на транспорта на глюкоза и фосфорилиране. Те стигнаха до заключението, че стимулираният от инсулин метаболизъм на глюкозата, а не инсулинът сам по себе си, медиира ефектите на инсулина за повишаване на лептиновата иРНК. [43]
Изследователите често използват 3T3-L1 адипоцити за изследване на адипогенезата, метаболизма на мастните киселини и трафика, регулиран от инсулин. Когато се прилага стандартният протокол за изобутилметилксантин/дексаметазон/инсулин (Ibmx/Dex/Ins), 3T3-L1 фибробластите се диференцират в зрели адипоцити, но експресията на лептин е много ограничена. [44] Zeigerer et al, модифицират стандартния протокол, за да дефинират по-добре молекулните механизми, залегнали в основата на лептиновата секреция на адипоцити. Те добавиха гама агонист с активиран от пероксизомен пролифератор (PPAR) гама агонист към Ibmx/Dex/Ins коктейла за диференциация, което предизвика петкратно увеличение на нивата на лептин иРНК. При тези условия инсулиновата стимулация за 15 минути индуцира двукратно увеличение на секрецията на лептин без нов протеинов синтез. Повишената секреция на лептин не се дължи на промените в метаболизма на глюкозата. Ефектът на инсулина върху лептиновата екзоцитоза се блокира от брефелдин А, но не и от инхибитора на фосфоинозитид 3-киназата (PI3K) вортманин или инхибитора на протеиновия синтез циклохексимид. Това предполага, че лептинът е насочен към регулаторен отделителен отдел в адипоцитите на 3T3-L1, където освобождаването му се стимулира от инсулин чрез независим от PI3K механизъм. [45]
ИРНК на лептин се открива в зрели 3T3-442A клетки, но не и в преждевременни клетки. [46] Освен това нивата на лептин иРНК се нормализират след трансплантация на 3T3-F442A преадипоцити в мишки. [47] Тези открития предполагат, че експресията на лептин иРНК зависи от линиите на клетъчните култури или зрелостта на клетките и някои важни фактори може да липсват ex vivo.
Когато епидидималната мазнина на плъх се инкубира с или без инсулин в продължение на 4 часа in vitro, секрецията на лептин се увеличава с около 80% във всички проучени точки. [48] След 10 минути лечение с инсулин, количеството на свързания с тъканите лептин е намаляло, вероятно поради повишената секреция. По-късно както свързаните с тъкани лептин, така и общото производство на лептин се увеличиха в лекуваната с инсулин мастна тъкан. Преди лечение с инсулин, лептинът се открива в ендоплазмения ретикулум чрез имунооцветяване. След лечение с инсулин, лептиновото оцветяване в много клетки става по-слабо и е ограничено до тясна лента близо до плазмената мембрана. Тези резултати предполагат, че инсулинът увеличава както секрецията, така и производството на лептин и стимулира транспорта на лептин от ендоплазмения ретикулум.
Mueller et al, съобщават, че регулираното от инсулина повишаване на секрецията на лептин е по-тясно свързано с количеството глюкоза, поето от адипоцитите, отколкото с концентрацията на инсулин. Секрецията на лептин се инхибира от 2-DG и се обръща от високи концентрации на глюкоза. Два инхибитора на транспорта на глюкоза, флоретин и цитохалазин-В, и 2 инхибитора на гликолизата, йодоацетат и натриев флуорид, също инхибират секрецията на лептин. [49] В допълнение, те разкриха, че метформин и ванадий, антидиабетни агенти, които увеличават усвояването на глюкозата от периферните тъкани, увеличават усвояването на глюкоза и инхибират секрецията на лептин от култивирани адипоцити. Инхибирането на секрецията на лептин от метформин е свързано с увеличаване на метаболизма на глюкозата до лактат, така че ефектът от увеличаването на лептина чрез усвояване на глюкоза включва метаболизма на глюкозата до съдба, различна от производството на анаеробно лактат. [50] Те стигнаха до заключението, че транспортът и метаболизмът на глюкозата са важни фактори за регулирането на експресията и секрецията на лептин.
РАЗДЕЛИХ ДИПОЗА БРОЙ ОТ РОДЕНТИ
Saladin et al, показват, че нивата на лептин mRNA при плъхове се увеличават с приема на храна и инжектиране на инсулин и намаляват при гладуване; освен това инсулинът повишава експресията на лептин mRNA в адипоцитите. [14] Zheng et al, съобщават, че коремните мазнини (епидидимни и периренални мастни накладки) имат по-високи нива на лептин mRNA от подкожните мазнини. [55] Нивата на мРНК на лептин се повишават след 2,5-часова инфузия на инсулин в гладни плъхове в коремната мазнина, но нивото на лептин иРНК не се променя в подкожната мастна тъкан.
Lee et al, показаха механизмите на повишен серумен лептин в отговор на хранене чрез използване на метаболитно маркиране за директна оценка на биосинтеза, секрецията и оборота на лептина. [56] Гладуването намалява серумния лептин, съдържанието на лептин в мастната тъкан и секрецията на лептин по време на 3 часа инкубация. Инсулинът не увеличава остро биосинтезата на лептин in vitro, но проучванията за импулсно преследване показват, че в мастната тъкан от хранени плъхове инсулинът ускорява секрецията на лептин след 30 и 60 минути преследване. Изследователите, провеждащи тези проучвания, стигат до извода, че храненето, а не гладуването, е повлияло на производството на лептин на множество посттранскрипционни нива: синтез, съхранение в тъканите, оборот и секреция.
РАЗПОЛОЖИХ ДИПОЗА ВЪПРОС ОТ H UMANS
Kolaczynski et al, съобщават, че инсулинът индиректно регулира производството на лептин в човешката мастна тъкан. [30] Те изследват дали лептиновата иРНК се променя в отговор на инсулин in vitro и in vivo при евгликемични и хипергликемични условия. Здрави слаби, затлъстели и захарен диабет тип 2 са инфузирани с инсулин за 5 часа в евгликемична скоба и за 64–72 часа в хипергликемична скоба. Изолирани коремни адипоцити се инкубират с инсулин в продължение на 96 часа. Краткосрочната еугликемична хиперинсулинемия няма ефект върху нивата на циркулиращия лептин. По време на продължителната хипергликемична скоба се наблюдава повишаване на лептина поне 40 часа по-късно. В присъствието на инсулин in vitro, иРНК на лептин се увеличава след 72 часа, последвано от увеличаване на лептина, секретиран в средата. Те стигнаха до заключението, че инсулинът не стимулира остро производството на лептин; обаче дългосрочен ефект на инсулина върху производството на лептин може да бъде демонстриран както in vivo, така и in vitro. [30]
Общоприето е, че дексаметазон стимулира секрецията на лептин. Russell et al, изследва in vitro регулиране на експресията на лептин в мастната тъкан на тежко затлъстели жени и мъже преди и след култивиране с инсулин и/или дексаметазон. Нивата на мРНК на лептин и секрецията на лептин са по-високи в подкожната мастна тъкан преди културата. Дексаметазон временно увеличава иРНК на лептин в двата депа след един ден култивиране, но секрецията на лептин се увеличава само в мастната мастна тъкан. Инсулинът не увеличава лептиновата иРНК в нито едно от депото, но увеличава секрецията на лептин в подкожната тъкан през седемте дни на култивиране. Комбинацията от инсулин и дексаметазон увеличава лептиновата иРНК и секрецията на лептин в двете депа в първия ден и поддържа експресията на лептин през седем дни култура. Инсулинът и глюкокортикоидът имаха специфични за депото ефекти и функционираха синергично като дългосрочни регулатори на експресията на лептин в маточната и подкожната мастна тъкан от затлъстели пациенти. [57] Wabitsch и сътр., Също стигат до извода, че както инсулинът, така и кортизолът са физиологични регулатори на експресията на лептин в човешката мастна тъкан. [58]
Частично противоречиво проучване е докладвано от Casabiell et al., [59] Те съобщават, че инсулинът има двойно действие при регулирането на лептина: ранно (по-малко от 48 часа) инхибиторно действие, последвано (48–96 часа по-късно) от стимулация. Докато инхибиторната фаза се наблюдава при всяка тествана концентрация на глюкоза (диапазон, 1mM-25mM), стимулиращата фаза изисква наличието на физиологични или супрафизиологични концентрации на глюкоза. Отделянето на лептин се елиминира с инхибитори на усвояването на глюкоза. Този двоен ефект на инсулина не се дължи на модификация на нивата на лептин иРНК, което предполага, че зависи изцяло от посттранслационните механизми. Те стигнаха до заключението, че свързаните с инсулина инхибиране и стимулация се дължат на метаболитните промени, предизвикани от индуцираното от инсулина увеличаване на усвояването на глюкоза.
I РЕГУЛИРАНО С НУСЛИН СЕКРЕТИРАНЕ НА Л ЕПТИН ОТ G ASTRIC M UCOSA
Бадо съобщава, че стомашната лигавица секретира лептин [5], а както храненето, така и приложението на холецистокинин-8 увеличават плазмения лептин. Cammisotto et al, показа, че стомашната лигавица до голяма степен допринася за нивата на циркулиращия лептин, особено нивата, измерени по време на приема на храна. [7] Въпреки това се знае много малко за регулираната от инсулина секреция на лептин от стомашната лигавица. Необходими са допълнителни проучвания за изясняване на връзката между лептин и инсулин.
C ЗАКЛЮЧЕНИЕ
Инсулинът е важен фактор за стимулиране на секрецията на лептин. Спорно е дали неговата in vivo активност може да се счита за остра. Инсулинът обаче регулира дългосрочната секреция на лептин на мастните клетки чрез транскрипционен или посттранскрипционен механизъм. Регулацията може да бъде медиирана от метаболизма на глюкозата, но механизмът все още не е напълно изяснен. Малко проучвания през последните няколко години са изследвали регулираната от инсулина секреция на лептин от мастните клетки. Това може да се дължи на много ниските нива на лептин мРНК, изразени от традиционната 3T3-L1 адипоцитна клетъчна линия, или защото клетъчните линии, които имитират тясно in vivo състояние, липсват или защото не е наличен клетъчен щам, силно чувствителен към хормонални сигнали. Разбирането на краткосрочните и дългосрочните регулирани от инсулина механизми на секреция на лептин може да доведе до разработването на нови лечения за затлъстяване и съпътстващите заболявания, които са сериозни опасения за общественото здраве.
Бележки под линия
Източник на подкрепа: Нил
Конфликт на интереси: Никой не е деклариран
- Изследвания на имунореактивната секреция на инсулин при NZO мишки in vivo SpringerLink
- Подготовка за хирургия за дълбока мозъчна стимулация Разстройства на тихоокеанското движение
- Преодоляване на лептиновата резистентност в битката срещу затлъстяването
- Преобладаване на метаболитен синдром при затлъстяване на педиатричната популационна връзка със серумния лептин
- Сестрински интервенции Захарен диабет тип 2 Инсулинова резистентност към кофеин - Opther Diabetes Health