VIVO Патофизиология
Стомашно-чревната бариера
Стомашно-чревната лигавица образува бариера между тялото и лумена среда, която не само съдържа хранителни вещества, но е натоварена с потенциално враждебни микроорганизми и токсини. Предизвикателството е да се осигури ефективен транспорт на хранителни вещества през епитела, като същевременно се изключи строго преминаване на вредни молекули и организми в животното. Изключващите свойства на стомашната и чревната лигавица се наричат "стомашно-чревна бариера".
Ясно е, че редица първични стомашно-чревни заболявания водят до нарушаване на лигавичната бариера, позволявайки ескалация до системно заболяване. Също толкова ясно е, че много системни болестни процеси водят до увреждане на стомашно-чревната бариера, като по този начин добавят допълнителна обида към вече компрометирана система. Разбирането на същността на бариерата може да помогне за прогнозиране на такива събития и да помогне в профилактичните или активните терапии.
Стомашно-чревната бариера често се обсъжда като имаща два компонента:
-
Вътрешната бариера е съставена от епителни клетки, покриващи храносмилателната тръба, и стегнатите връзки, които ги свързват заедно.
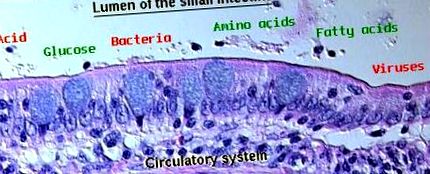
Вътрешната стомашно-чревна бариера
Хранителният канал е облицован от листове епителни клетки, които образуват определящата структура на лигавицата. С малки изключения, епителните клетки в стомаха и червата са периферно обвързани една с друга чрез плътни връзки, които уплътняват парацелуларните пространства и по този начин установяват основната стомашно-чревна бариера. По този начин в храносмилателната тръба поддържането на непокътнат епител е от решаващо значение за целостта на бариерата. Като цяло токсините и микроорганизмите, които са в състояние да нарушат единичния слой епителни клетки, имат безпрепятствен достъп до системната циркулация.
Както може да се очаква, има разнообразие между различните видове епителни клетки в специфични бариерни функции. Например, апикалните плазмени мембрани на стомашните париетални и главните клетки имат нетипично ниска пропускливост за протоните, което помага за предотвратяване на увреждане поради обратна дифузия на киселина в клетките. Клетките на тънките черва на епитела нямат тази специализирана способност и по този начин са много по-податливи на киселинно-индуцирани увреждания.
Тесните връзки, обграждащи стомашно-чревните епителни клетки, са критичен компонент на вътрешната бариера. По-рано тези структури се разглеждаха като пасивни структури, подобни на заварки, но последните проучвания показват, че те са много по-динамични, отколкото се смяташе досега, и тяхната пропускливост може да се регулира от редица фактори, които влияят върху епителните клетки.
Стомашно-чревният епител е населен от множество функционално зрели клетки, получени от пролиферация на стволови клетки. Повечето от зрелите епителни клетки, включително лигавичните клетки в стомаха и абсорбиращите клетки в тънките черва, показват бързи обороти и умират само в рамките на няколко дни след образуването им. Следователно поддържането на епителната цялост изисква точен баланс между клетъчната пролиферация и клетъчната смърт.
Стволовите клетки, които поддържат непрекъснато попълване на стомашно-чревния епител, се намират в средата на стомашните ями и в криптите на тънките и дебелите черва. Динамиката на епителните клетки в тънките черва е особено добре проучена. Тези стволови клетки се размножават непрекъснато, за да доставят клетки, които след това се диференцират в абсорбиращи ентероцити, секретиращи слуз бокалови клетки, ентероендокринни клетки и клетки на Панет. С изключение на клетките на Панет, които остават в криптите, останалите клетки се диференцират в зрелите си форми, докато мигрират нагоре от криптите, за да заместят клетките, екструдирани от върховете на вилисите. Тази миграция отнема приблизително 3 до 6 дни.
Вътрешната стомашно-чревна бариера
Слуз и бикарбонат
Целият стомашно-чревен епител е покрит със слуз, която се синтезира от клетки, които образуват част от епитела. Слузът играе важна роля за смекчаване на напрежението на срязване върху епитела и допринася за бариерната функция по няколко начина. Обилните въглехидрати на молекулите муцин се свързват с бактериите, което помага за предотвратяване на колонизацията на епитела и, причинявайки агрегация, ускорява клирънса. Дифузията на хидрофилни молекули е значително по-ниска в слуз, отколкото във воден разтвор, за който се смята, че забавя дифузията на различни вредни химикали, включително стомашна киселина, към епителната повърхност.
Освен че са покрити със слузен слой, епителните клетки на стомаха и дванадесетопръстника отделят бикарбонатен йон върху апикалните си лица. Това служи за поддържане на неутрално рН по протежение на епителната плазмена мембрана, въпреки че в лумена съществуват силно киселинни условия.
Хормони и цитокини
Известно е, че нормалната пролиферация на стомашни и чревни епителни клетки, както и разпространението в отговор на такова увреждане като улцерация, се влияят от голям брой ендокринни и паракринни фактори. Известно е, че няколко от ентеричните хормони повишават скоростта на пролиферация. Различните форми на нараняване на епитела могат да доведат или до повишени, или до потиснати темпове на клетъчна пролиферация. Например, демонстрирано е, че резекцията на част от кучешкото тънко черво е последвана от епителна клетъчна хиперплазия и увеличена дължина на вилозите при животни, хранени през устата. Животните, хранени парентерално, не са показали същата компенсаторна хиперплазия, което показва, че наред с други фактори, местните хранителни вещества играят важна роля в клетъчната динамика.
Отдавна е известно, че простагландините, особено простагландин Е2 и простациклин, имат „цитопротективни“ ефекти върху стомашно-чревния епител. Често срещан клиничен корелат при много бозайници е, че употребата на аспирин и други нестероидни противовъзпалителни лекарства (НСПВС), които инхибират синтеза на простагландини, обикновено се свързва със стомашни ерозии и язви. Кучетата са особено чувствителни към този страничен ефект. Простагландините се синтезират в лигавицата от арахидонова киселина чрез действието на циклооксигенази. Изглежда, че техният цитопротективен ефект е резултат от сложна способност да стимулира лигавичната слуз и секрецията на бикарбонат, да увеличи кръвния поток на лигавиците и особено в стомаха, да ограничи обратната дифузия на киселина в епитела. Полагат се значителни усилия за разработване на НСПВС, които не успяват да инхибират синтеза на лигавицата на простагландини.
Два пептида, на които е обърнато внимание поради потенциалната им роля в поддържането на бариерата, са епидермален растежен фактор (EGF) и трансформиращ растежен фактор-алфа (TGF-алфа). EGF се секретира в слюнката и от дванадесетопръстните жлези, докато TGF-алфа се произвежда от стомашни епителни клетки. И двата пептида се свързват с общ рецептор и стимулират пролиферацията на епителните клетки. В стомаха те също подобряват секрецията на слуз и инхибират производството на киселина. Доказано е, че други цитокини като растежен фактор на фибробластите и растежен фактор на хепатоцитите подобряват зарастването на стомашно-чревни язви в експериментални модели.
Протеините от трилистник са семейство от малки пептиди, които се секретират обилно от бокаловите клетки в стомашната и чревната лигавица и покриват апикалното лице на епителните клетки. Отличителната им молекулярна структура изглежда ги прави устойчиви на протеолитично разрушаване. Редица проучвания показват, че трилистните пептиди играят важна роля в целостта на лигавицата, възстановяването на лезиите и в ограничаването на пролиферацията на епителните клетки. Доказано е, че те предпазват епитела от широк спектър от токсични химикали и лекарства. Протеините от трилистник също изглеждат централен играч във фазата на възстановяване на възстановяването на увреждане на епитела, където епителните клетки се изравняват и мигрират от ръба на раната, за да покрият оголените области. Мишки с целеви делеции в трилистни гени показаха преувеличени отговори на леко химическо увреждане и забавено заздравяване на лигавицата.
Друга молекула, която играе решаваща роля за целостта на лигавицата и бариерната функция, е азотният оксид (NO). Парадоксално е, че NO също допринася за увреждане на лигавицата при редица храносмилателни заболявания. Тази молекула се синтезира от аргинин чрез действието на една от трите изоформи на синтеза на азотен оксид (NOS). Голяма част от изследванията в тази област са фокусирани върху разбирането на ефектите от прилагането на NO донори като глицерилтринитрат или NOS инхибитори. В няколко модела NO донорите значително намаляват тежестта на увреждане на лигавицата, причинено от токсични химикали (например етанол) или свързано с исхемия и реперфузия. По подобен начин заздравяването на стомашни язви при плъхове е ускорено чрез прилагане на NO донори. Друго интригуващо наблюдение е, че едновременното приложение на NO донори и НСПВС води до противовъзпалителни свойства, сравними само с НСПВС, но с по-малко увреждане на стомашно-чревната лигавица. NOS инхибиторите се разследват за лечение на ситуации, при които NO се свръхпроизводи и допринася за нараняване на лигавицата.
Антибиотични пептиди и антитела
Важна част от бариерната функция е да се предотврати преминаването на бактерии от лумена през епитела. Клетките на Панет са епителни гранулоцити, разположени в тънките чревни крипти на много бозайници. Те синтезират и секретират няколко антимикробни пептиди, главни сред които изоформи на алфа-дефензини, известни също като криптини ("крипт дефензин"). Тези пептиди имат антимикробна активност срещу редица потенциални патогени, включително няколко рода бактерии, някои дрожди и Giardia trophozoites. Механизмът им на действие вероятно е подобен на неутрофилните алфа-дефензини, които проникват в мембраните на целевите клетки.
В допълнение към неспецифичните антимикробни молекули, бариерната функция се поддържа от стомашно-чревната имунна система. Един аспект на тази защитна система е, че голяма част от епитела се къпе в секреторен имуноглобулин А. Този клас антитела се секретират от субепителни плазмени клетки и се трансцитират през епитела в лумена. Lumenal IgA осигурява антигенна бариера чрез свързване на бактерии и други антигени. Тази бариерна функция е специфична за определени антигени и изисква предварително излагане за развитие на отговора.
Нарушаване на бариерната функция
Въпреки здравия си и многостранен характер, стомашно-чревната бариера може да бъде нарушена. Локалните инфекции от бактерии и вируси, излагане на токсини или физически обиди и различни системни заболявания водят до неговото нарушаване. Такива проблеми могат да бъдат леки и лесно ремонтирани, или масивни и фатални.
Микрографиите по-долу показват сериозно разрушаване на бариерата. Вляво е лигавицата от нормално кучешко тънко черво, с големи власинки, покрити с непокътнат епител, разширени в лумена. Изображението отдясно (със същото увеличение) показва лигавицата на тънките черва от куче, което е починало от Salmonella enteritis - забележете напълно оголения епител и унищожаването на вили.
Ишемия и реперфузионно нараняване
Увреждането на стомашно-чревната бариера поради исхемия и реперфузионно нараняване е често и сериозно състояние. Исхемия възниква, когато притокът на кръв е недостатъчен, за да достави количество кислород и хранителни вещества, необходими за поддържане на целостта на клетките. Реперфузионно нараняване възниква, когато притокът на кръв се възстанови в исхемичната тъкан.
Стомашно-чревната исхемия е резултат от два основни типа нарушения, които и двете могат да компрометират епителната бариера:
- Неоклузивна исхемия е резултат от системни състояния като циркулаторен шок, сепсис или сърдечна недостатъчност.
- Оклузивна исхемия се отнася до състояния, които директно нарушават стомашно-чревния кръвен поток, като удушаване, волвулус или тромбоемболия.
Счита се, че реперфузионното увреждане на стомашно-чревната стена, особено на лигавицата, се дължи главно на генерирането на реактивни кислородни видове, включително супероксид, водороден пероксид и хидроксилни радикали. Тези окислители се генерират в лигавицата, а също и в многобройните локални левкоцити, активирани по време на исхемия.
Получените по време на реперфузия свободни радикали, получени от кислород, инициират поредица от събития, които причиняват увреждане на лигавицата и нарушаване на бариерата. Те директно увреждат клетъчните мембрани чрез образуване на липидни пероксиди, което също води до производството на редица възпалителни медиатори, получени от фосфолипиди (напр. Тромбоцитно-активиращ фактор и левкотриени). Тези възпалителни агенти функционират като хемоаттрактанти за неутрофилите, които мигрират в лигавицата, освобождават собствените си реактивни кислородни метаболити и причиняват допълнително увреждане на вътрешната епителна бариера. По този начин първоначално незначителен ефект от исхемия се усилва в много значително увреждане на бариерната функция. Освен това, възпалителните медиатори, генерирани в стомашно-чревния тракт, могат да навредят на отдалечени тъкани, което води до системно заболяване.
Наблюдаваните ефекти от исхемично-реперфузионно увреждане варират от повишена съдова пропускливост и последващ субепителен оток до масивна загуба на епителни клетки и ворсинки. Дори относително лекото увреждане на епитела нарушава бариерната функция и може да доведе до транслокация на бактерии и токсини от лумена в системната циркулация. Разработват се и се тестват редица лечения за предотвратяване на тази каскада от увреждания, включително прилагане на антиоксиданти като супероксиддисмутаза и използване на лекарства като антагонисти на активиращия фактор тромбоцити, за да блокират ефекта на възпалителните медиатори.
Неутрофили и увреждане на лигавицата
Различните обиди на чревната лигавица, включително инфекциозни процеси, исхемия и увреждащи химикали, насърчават инфилтрацията на неутрофили. Тази обща крайна точка води до резултат, тъй като много видове наранявания водят до локално производство на неутрофилни хемоаттрактанти като левкотриени, интерлевкини и активирани компоненти на комплемента. В отговор на хемоаттрактанти неутрофилите мигрират от капилярите, инфилтрират субепителната лигавица и често трансмигрират през стомашния или чревния епител. При пресичане на епитела неутрофилите трябва да разрушават свързващите комплекси между епителните клетки. Това "набиване на кол" през плътни кръстовища непременно причинява преходни увеличения на пропускливостта. Когато обидата е незначителна, кръстовищата се затварят бързо, но трансмиграцията на голям брой неутрофили причинява значително увреждане на бариерната функция.
Ефекти от стреса
Стресът идва в безброй форми и е неразделна част от всички болести и травми. Реакцията на стрес включва модулация на буквално десетки хормони и цитокини, както и значителни ефекти върху невротрансмисията. Въпреки това, най-важният ефект от стреса върху стомашно-чревния тракт е да се намали притока на кръв в лигавицата и по този начин да се наруши целостта на лигавичната бариера. Освен всичко друго, намаленият кръвен поток на лигавицата потиска производството на слуз и ограничава способността за отстраняване на обратно дифузиращите протони. В резултат на това значителен стрес почти винаги е свързан с ерозии на лигавицата, особено в стомаха. Повечето от тези лезии са субклинични, но стомашно-чревният кръвоизлив и сепсис не са редки последици.
Диабетът и затлъстяването са добре известни рискови фактори за дисфункция на стомашно-чревната бариера и продължителната хипергликемия, свързана с тези нарушения, може да бъде основният механизъм за такова нарушение.
Възстановяване и излекуване след нараняване
Първата критична задача след разрушаване на стомашно-чревния епител е да се покрие оголената област и да се възстанови вътрешната бариера. Това бързо възстановяване на епитела се осъществява чрез процес, наречен възстановяване - епителните клетки, съседни на дефекта, се изравняват и мигрират върху откритата базална мембрана. В тънките черва този процес се подпомага от бързото свиване и скъсяване на засегнатите ворсинки, което намалява площта на базалната мембрана, която трябва да бъде покрита.
Реституцията осигурява бърз механизъм за покриване на дефект в бариерата и не включва пролиферация на епителни клетки. В резултат се получава зона, която макар и защитена, не е физиологично функционална. Заздравяването изисква епителните клетки в границите на дефекта да се размножават, диференцират и мигрират в увредената област, за да възстановят нормалната клетъчна архитектура и функция.
Доказано е, че реституцията се стимулира от редица предимно паракринни регулатори. Местните простагландини и трилистни протеини са ясно включени в този процес и потискането на тяхното производство значително забавя възстановяването. Друга група молекули, участващи в възстановяването, са полиамините като спермин, спермидин и путресцин. Тези молекули присъстват в много диети и също се синтезират от стомашно-чревната лигавица. Ентералното приложение на полиамини е показано в експериментални модели за ускоряване на възстановяването и заздравяването на лигавичните лезии.
Препратки и рецензии
Стомах: Въведение и индекс
Стомах: Въведение и индекс
Актуализирано през май 2018. Изпратете коментари на [email protected]
Чешки превод на тази страница е създаден от Максуел Едуард и е достъпен на чешки превод
Френски превод на тази страница е създаден от Erin Melissa и е достъпен на френски превод
Гръцки превод на тази страница е създаден от Дървото на ваучерите и е достъпен на гръцки превод
Превод на хинди на тази страница е създаден от Nikol Barton и е достъпен в превода на хинди
Превод на панджаби на тази страница е създаден от екипа на Bydiscountcodes и е достъпен в превода на панджаби
Превод на тази страница на румънски език е създаден от Сара Ричардс от Essay Writing Service и е достъпен на румънски превод
Украински превод на тази страница е създаден от Сергей Косбук от PickWriters и е достъпен на украински превод
Урду превод на тази страница е създаден от Ahsan Soomro и е достъпен на урду превод
- Язвен колит стомашно-чревни Andrew Weil, M
- Възникващата терапевтична роля на медицинските храни за стомашно-чревни разстройства - PubMed
- Актуализация на управлението на варикозите на стомашно-чревния тракт
- Ефектът на разреден разтвор на натриев хипохлорит и овлажнители върху кожната бариерна функция в
- Какво представлява стомашно-чревният карциноиден тумор