Кристина Цигалу
1 Лаборатория по микробиология, Медицинско училище, Тракийски университет Демокрит, Александруполис, Гърция
Елисавет Ставропулу
2 Service de Médecine Interne, Centre Hospitalier Universitaire Vaudois (CHUV), Лозана, Швейцария
Евгения Безирцоглу
3 Департамент за развитие на селското стопанство, Тракийски университет Демокрит, Орестиада, Гърция
Резюме
Ключови съобщения
Синдромът на Sjogren е многофакторно, автоимунно заболяване, което все още е недостатъчно диагностицирано и недолекувано.
Всички негови патофизиологични и етиологични аспекти не са напълно изяснени.
Последните проучвания се стремят да изследват потенциалните взаимодействия с човешкия микробиом по отношение на всички аспекти на заболяването, използвайки жизненоважна информация от други автоимунни състояния, а именно IBD, T1DM и т.н.
Диетичните интервенции и добавки за пациенти със СС трябва да бъдат внимателно изследвани и изследвани, за да се идентифицират нови терапии и превантивни мерки в контекста на персонализираната медицина.
Въведение
Няколко експериментални подхода демонстрират, че има връзка между измененията на чревната микробиота и проявите на заболяването, тежестта и реакцията на лечение. Например, сега е известно, че чревната дисбиоза с ниско относително богатство на симбионти и високо относително богатство на патобионти влошава SS-подобно заболяване в модела на мишка и корелира с тежестта на SS при хората (6).
Понастоящем под микроскоп са интервенции, насочени към възстановяване на изместването на микробиотата, като се използват например хранителни добавки, за да се изяснят ефектите върху клиничния статус. Пребиотиците и пробиотиците се считат за съвременни стратегии за модулация на чревната микробиота и ние предоставяме мини преглед, фокусиран върху промените в микробиома на пациенти с SS, техните взаимодействия между микробиома и гостоприемника и нови лечения, включващи манипулация на диетата към бъдеща персонализирана медицина.
Кратко обобщение в настоящото проучване на SS
Синдромът на Sjogren е хетерогенно и многофакторно заболяване, включващо генетични, екологични и хормонални параметри, които могат да се появят във всяка възраст със съотношение мъже/жени 1:10 (2). Когато SS съществува само, се нарича първичен SS, за да се направи разграничение от ситуацията на вторичен SS, когато друго автоимунно заболяване съществува едновременно или съществува предварително, а именно, систематичен лупус еритематозус или RA. При лимфоцитната инфилтрация на тъкани, преобладаващата характерна фигура, в повечето случаи, превъзхожда Т-клетките, а в други случаи В-клетките. Страничната ситуация става очевидна с наличието на определени автоантитела първо Ro/SSA и La/SSB и второ ревматоиден фактор, антифодринови антитела и т.н.
Въпреки факта, че патофизиологията на SS е интензивно проучена, тя не е напълно изяснена. Добре установено е, че генетичната предразположеност и различни фактори на околната среда или хормоналната система могат да допринесат и да насърчат дерегулацията на жлезистите епителни клетки. Тези потенциални тригери водят до освобождаване на адхезионни молекули и хемокини като CD54/ICAM-1 и CD40 от епителните клетки (7). Тези молекули набират плазмоцитоидни дендритни клетки и Т-лимфоцити в жлезите. Дендритните клетки освобождават високи нива на IFN-a, което поддържа набирането и задържането на Т-лимфоцитите, главно CD4 +, което води до жлезиста инфилтрация на жлезите, един от акцентите на SS. Активираните Т-клетки произвеждат различни цитокини, а именно IFN-γ, IL-2, IL-6, IL-10 и др., Които са свързани с лезиите на SS (8).
В същото време интерфероните насърчават секрецията на В-клетъчно активиращ фактор (BAFF) от епителните, дендритните и Т клетките. В някои проучвания е добре изобразено увеличаване на серумните нива на BAFF при пациенти със SS, което е свързано с дерегулацията на В клетките. В резултат на това е налице автоантитела като анти-SSA/Ro, анти-SSB/La и др. (9, 10). Генетичната предразположеност според изследователите предполага основните комплекси за хистосъвместимост клас II генен регион, особено алеите HLA-DR и HLA-DQ. Повечето от свързаните проучвания са посветени на специфични гени за протеини, свързани с вроден и адаптивен имунитет като вариант PT-PN22W (11) или вариант TNFAIP3 (12), опитващи се да докажат генетичния произход на SS. Освен това се натрупва голям интерес към различни епигенетични фактори като miRNA, дълга некодираща РНК и метилиране на ДНК (13–15).
Общоприето е, че генетиката в съчетание с фактори на околната среда, особено вируси (вирус на хроничен хепатит, вирус на Epstein-Barr и др.), Провокира инициирането на катаракта, която води до възпаление и автоимунитет с жлезни и допълнителни жлезни прояви (16).
Последните изследвания, проведени SS по отношение на симптомите и диагнозата, са фокусирани върху дискриминацията на различни подтипове на pSS (17), оценката на независимите рискови фактори за развитие на лимфом (напр. RF позитивност, феномен на Рейно) (18), неврологично и бъбречно засягане и съпътстващи заболявания (напр. сърдечно-съдови нарушения, депресия и др.) (17).
Що се отнася до възможностите за лечение, истината е, че учените ходят по тъмната страна на Луната. В зората на 2017 г. Birt et al. в популационно проучване, което включва повече от 10 000 пациенти с pSS, предполага, че лекарствата от първа линия са симптоматичните и имуносупресивните, докато липсват предписания за биологични терапии (19). Според други проучвания потенциалните терапевтични интервенции включват анти-BAFF антитела или BAFF антагонисти (напр. Belimumab, Atacicept, Briobacept и др.). В допълнение, анти-CD20 и анти-CD22 терапията води до изчерпване на В-клетките, което води до подобряване на симптомите на SS (напр. Ритуксимаб), метотрексат като имуносупресивно лекарство, както и наскоро насочено лечение с интерлевкин (напр. IL-6 тоцилизумаб) ( 16, 20–26). За съжаление, всички тези опции все още изискват изпитвания върху хора, за да докажат своята ефективност, особено при пациенти с pSS.
Нов актьор на сцената: Човешкият микробиом
Всички тези взаимодействия са достатъчно сложни и бъдещите изследвания на специфична за пола микробиота и нейните връзки в тандем с предпазливо обяснение на експериментални резултати вероятно ще просветлят тъмните страни на автоимунните състояния.
Двупосочна връзка между микробиома и SS
След като разгледахме всичко по-горе, е повече от очевидно натрупващите се изследвания в момента се фокусират върху приноса на човешкия микробиом за системни автоимунни заболявания (SADS). Бактериите на микробиома влизат в контакт с имунната система на лигавицата и след различни взаимодействия могат да доведат до дисбиоза с локално възпаление и нарушаване на чревната бариера. Като катаракта могат да настъпят многобройни последици, например, провъзпалителни цитокини в системното кръвообращение, отдалечено въздействие на възпаление като стави, по-голяма експозиция на антиген с увеличаване на производството на автоантитела и др. SAD са многофакторни заболявания, засягащи генетично предразположение, фактори на околната среда, хормонални влияния и нарушена имунна система (42).
Проучванията показват, че Т и В клетките в лигавицата значително пречат и насърчават имунната хомеостаза, работеща в две различни области, овладявайки имунния отговор срещу полезните микроби и поддържайки цялостта на чревната бариера (43). Някои бактерии от общностите на микробиотите имат уникални способности да въздействат и стимулират активирането и поляризацията на някои подмножества на лимфоцитите. Например, експерименти с мишки разкриват, че Т хелпер 17 (Th17) се предпочита от сегментирани нишковидни бактерии в тънките черва, водещи до автоимунен артрит (44, 45). Но функционалността на Th17 клетките може да представлява две страни на една и съща монета, тъй като те могат да действат или като предотвратяват инфекцията, или да бъдат патогенни чрез секреция на провъзпалителни цитокини (46–49). Все още е неясен точният механизъм, който управлява тази процедура на Th диференциация.
Друга субпопулация на лимфоцити, която включва голям брой, са Т регулаторните (Treg) клетки. Трегите са безценни за техния принос в имунната толерантност към антигените от диетичен произход и чревните микроби. Проучванията относно степента на влияние на чревната микробиота върху индукцията на Tregs са все още в зародиш. Например, Tregs се индуцират от видове Clostridium в червата с противовъзпалително действие (50, 51).
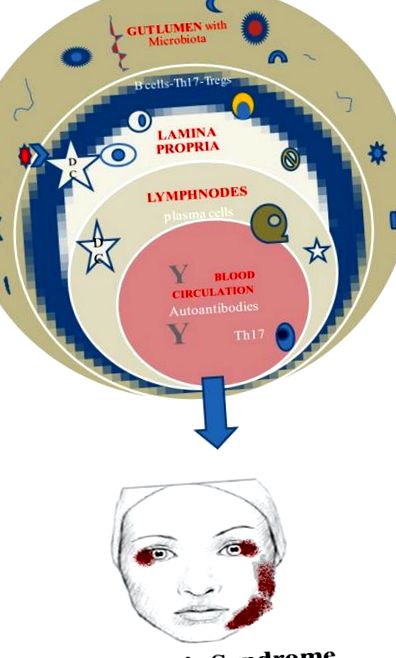
И накрая, жизненоважно изискване за тази полезна роля на микробиотата е нейното установяване в началото на живота. В противен случай разпространението на инвариантни естествени клетки убийци и потискането на Tregs са свързани с колит и астма при мишки (52, 53) (Фигура (Фигура 1 1).
Микробиом и синдром на Sjogren.
Общоприето е патофизиологичната роля на автореактивните В клетки и Th17 клетките в SS и прякото или непрякото въздействие върху човешкия микробиом.
Th17 клетките присъстват в слюнчените жлези на пациенти с SS и в периферната кръв също. Така че може да е солидна хипотеза увеличаването на тази популация поради дисбиоза води до навлизане в кръвообращението и достигане на екзокринните жлези. За съжаление, все още не е ясно дали произходът на Th17 клетките е lamina propria на червата и моделът, по който чревният имунитет задейства автоимунни процедури в дисталните места (т.е. слюнчените жлези) (42).
Микробиомни промени и бъдещи диетични интервенции в SS
Колективно, цялата горепосочена информация набляга на „борбата“ срещу дисбиозата, която очевидно е замесена в появата и продължаването на автоимунитета. Различни проучвания върху СС са представили косвени доказателства за промени в оралния, кожния и чревния микробиом (58, 59), но не и пряка връзка, водеща до хипотезата, че ако микробиомът наистина играе важна роля, тогава нови начини на лечение като диетични интервенции и „ функционална храна “може да предложи алтернатива на традиционните имуносупресивни терапии. Дисбиозата като състояние на анормална функция на микробиотата, което води до дерегулация на имунната и метаболитна хомеостаза, нискостепенното хронично възпаление може да допринесе или да предразположи към широк спектър от възпалителни заболявания като алергия, астма, автоимунни заболявания, затлъстяване и метаболитни нарушения, когнитивни и дисфункция на психичното здраве и др. (60). Насочването към дисбиоза чрез прилагане на диетични промени в микробиома може да повлияе на развитието на автоимунитет. Усилията за коригиране на неправилното функциониране на нарушената чревна бариера включват обикновено пробиотици, пребиотици, диетични фибри и трансплантация на фекална микробиота в зависимост от заболяването.
Пробиотиците са живи микроорганизми, които, когато се прилагат в адекватни количества, дават полза за здравето на гостоприемника (61). Пробиотичните микроорганизми включват предимно бактерии, които произвеждат млечна киселина като Lactobacillus и Bifidobacterium rodovi (LAB). Тяхната употреба е основно за възстановяване на дисбаланса на микробиотата чрез различни механизми, които все още са в процес на проучване (62), въпреки че има много проучвания, които демонстрират благоприятния ефект върху алергични заболявания (напр. Астма и екзема), затлъстяване, метаболитен синдром, стомашно-чревни нарушения и др. (60). Пребиотиците са несмилаеми ферментируеми олигозахариди, които могат да променят състава и/или функционалността на чревната флора и да допринесат за увеличаване на полезните бактерии, а именно лактобацили и бифидобактерии (36, 63, 64). По същия начин е използвана комбинация от пре- и пробиотици (симбиотик) (65).
В действителност има много доказателства, че има някои бактерии, които могат да повлияят индукцията на Treg клетки в червата и да предотвратят разширяването на Th17 като Bacteroides fragilis и Clostridium щамове при експериментален колит, T1DM и IBD. Тези резултати могат да бъдат ценни уроци за бъдещи проучвания върху животни и хора по отношение на СС и оформянето на микробиотата за потискане на автоимунитета. Като се има предвид решаващата роля на полезните бактерии и възможните диетични интервенции с използване на пробиотици и пребиотици, пациентите със SS могат да подобрят тежестта и прогнозата на заболяването. Недостигът на изследвания, засягащи конкретно тази същност, било то проучвания върху животни или хора, разкрива мащаба на проблема. Познанията от други автоимунни заболявания могат да улеснят предположението, че манипулацията с микробиоми може да облекчи тежестта на заболяването.
Заключение
Принос на автора
EB ръководи работата. CT беше отговорен за лабораторните данни и част от работата и ръкописа. ES беше отговорен за клиничните аспекти на този преглед.
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
- Диетични съвети за Sjogren; s Пациенти със синдром - Sjogren; s Новини за синдрома
- Синдром на Даун и хранене NCHPAD - Изграждане на здрави приобщаващи общности
- Синдром на Даун Подпомагане на детето ви да се храни самостоятелно Мичиганска медицина
- Общи терапевтични диети Cheat Sheet - Medical eStudy
- Общи терапевтични диети Cheat Sheet - Medical eStudy