Субекти
Тази статия е актуализирана
Резюме
Има належаща необходимост от разработване на алтернативи на годишните противогрипни ваксини и антивирусни агенти, лицензирани за смекчаване на грипната инфекция. Предишни проучвания съобщават, че острото нараняване на белите дробове, причинено от химически или микробни обиди, е вторично за генерирането на окислен фосфолипид, получен от гостоприемника, който силно стимулира възпаление, зависимо от Toll-подобен рецептор 4 (TLR4) 1. Впоследствие съобщихме това Tlr4 -/- мишки са силно огнеупорни към причинената от грип леталност 2 и предполагат, че терапевтичният антагонизъм на сигнализирането на TLR4 би предпазил срещу предизвиканото от грип остро остро увреждане на белите дробове. Тук съобщаваме, че терапевтичното приложение на Eritoran (известен също като E5564) - мощен, добре поносим, синтетичен антагонист на TLR4 3,4 - блокира индуцирана от грип леталност при мишки, както и белодробна патология, клинични симптоми, цитокин и окислен фосфолипид експресия и намалява вирусните титри. CD14 и TLR2 също са необходими за медиирана от Eritoran защита, а CD14 директно свързва Eritoran и инхибира свързването на лиганд с MD2. По този начин, Eritoran блокадата на TLR сигнализиране представлява нов терапевтичен подход за възпаление, свързано с грип, и вероятно други инфекции.
Грипът продължава да се развива и ежегодно се появяват нови антигенни варианти, пораждащи сезонни огнища. По време на годишните грипни епидемии 5–15% от населението е засегнато от инфекции на горните дихателни пътища, като хоспитализацията и смъртта настъпват главно при възрастни хора и хронично болни. Годишните грипни епидемии се изчисляват като резултат от 3-5 милиона случая на тежки заболявания и 250 000-500 000 смъртни случая годишно по света 5,6. Освен това щамове, към които хората нямат предишен имунитет, могат да се появят внезапно и произтичащите от това пандемии могат да бъдат катастрофални, както е показано от „испанския грип“ от 1918 г., който уби милиони 7,8. Логистичните проблеми, свързани с прогнозирането на бъдещи имуногенни епитопи и проблемите с производството и разпространението, често ограничават ефикасността и/или наличността на ваксини. Освен това, увеличаването на резистентността към съществуваща антивирусна терапия, съчетано с необходимостта от прилагане на тези средства в рамките на 2-3 дни след инфекцията, ограничава тяхната полезност 9,10,11. По този начин има критична необходимост от безопасно и ефективно терапевтично допълнение и/или алтернатива на противогрипните ваксини и антивирусните средства.
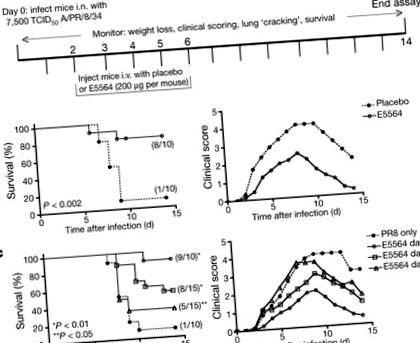
Фигура 1а илюстрира нашия първоначален протокол. На „ден 0“ 6–8-седмични женски мишки C57BL/6J бяха заразени интраназално (i.n.) с доза PR8, която беше определена да убие ∼ 90% от мишките (∼ LD90). Два дни по-късно, TLR4 сигнализиращият антагонист Eritoran (E5564) се прилага ежедневно в продължение на 5 последователни дни (200 μg на мишка; дни 2–6) интравенозно (i.v.). Всяка мишка беше претеглена и клиничните симптоми (например летаргия, пилоерекция, разрошена козина, прегърбена стойка, учестено плитко дишане, звуково тракане) бяха оценявани ежедневно в продължение на 2 седмици. Лекуваните с ериторан мишки бяха значително защитени от причинена от грип леталност, докато 90% от мишките, приемащи плацебо (само носител), умряха (Фиг. 1б, вляво). Това беше успоредно с по-тежки клинични резултати (Фиг. 1b, вдясно) и загуба на тегло (Допълнителна Фигура 1А) при контролни мишки спрямо мишки, лекувани с Eritoran. Лечението на мишки с десетократно по-малко ериторан (20 μg на мишка) намалява преживяемостта до 40% (оцеляват 4/10 мишки; данните не са показани). Ефикасността на лечението с Eritoran намалява от 90% преживяемост при мишки, заразени със 7500 50% инфекциозна доза от тъканна култура (TCID50), до 60% и 25% преживяемост при мишки, заразени съответно с 10 000 и 20 000 TCID50 (допълнителна фигура 1В). Лечението с Eritoran също така защити мишки, заразени със смъртоносна доза от неадаптирания през 2009 г. пандемичен грипен щам A/California/07/2009 H1N1 (допълнителна фигура 1C).
Проведени са допълнителни експерименти, при които лечението с Eritoran е започнало на ден 2, ден 4 или ден 6 след инфекцията. Фигура 1в (вляво) илюстрира, че 90% от заразени с PR8 мишки, които не са получавали лечение с Eritoran, са умрели, докато мишките, които са получавали Eritoran, започвайки на 2, 4 или 6 ден, са имали статистически значими проценти на оцеляване от 90%, 53% и 33%, съответно. Клиничните резултати за същите тези мишки (фиг. 1в, вдясно) илюстрират, че колкото по-късно мишките започват лечение с ериторан, толкова по-тежки са техните клинични резултати. Мишките, които не са получавали Eritoran, са показали най-тежките симптоми и най-високите клинични резултати. По същия начин загубата на тегло е прогресивно по-голяма, по-късно лечението е започнало след инфекция (данните не са показани). По този начин, за разлика от настоящите антивирусни средства, които трябва да се прилагат скоро след инфекцията, лечението с Eritoran значително подобрява преживяемостта, дори когато е започнало най-късно 6 дни след инфекцията.
За да определим дали терапевтичният ефект на Eritoran се разпростира върху други животински модели на човешка грипна инфекция, проведохме експерименти с памучни плъхове (Sigmodon hispidus) 14,15. A/Wuhan/359/95 (H3N2), човешки неадаптиран щам на грипа, се репликира в белите дробове на памучни плъхове на ден 1 и произвежда пикова белодробна патология на ден 4 след инфекцията (фиг. 2г, средна; и фиг. 2д, Само H3N2). Животните, лекувани с Eritoran след предизвикване на H3N2, показват значително намаляване на белодробната патология на ден 4 в сравнение с животни, лекувани с носител (Фиг. 2г, вдясно; и Фиг. 2д, H3N2/E5564).
Фигура 3а показва, че към 6-ия ден след инфекцията лечението с Eritoran води до статистически значимо намаляване на титрите на белодробните вируси, което допълнително е намалено до 7-ия ден (Фиг. 3b) и 8-ия ден (данните не са показани). Това не е пряк ефект на Eritoran върху репликацията на вируса (допълнителна таблица 1). Към 14 ден всички оцелели мишки са изчистили напълно вируса, независимо от лечението. Тъй като ефектите от грипната инфекция са системни 16, нивата на чернодробните ензими аланин аминотрансфераза (ALT) и аспартат аминотрансфераза (AST) са измерени в серуми. Въпреки че инфекцията с PR8 води до значително повишаване на нивата на ALT и AST, те са значително по-ниски при мишки, лекувани с Eritoran 6 дни след инфекцията (допълнителна фигура 2).
Грипната инфекция мощно индуцира експресия както на про-, така и на противовъзпалителни гени in vivo които допринасят за възпалителния отговор 1,17. За да се определи дали Eritoran също така смекчава индуцираната от PR8 генна експресия, групи мишки са заразени на ден 0, третирани с Eritoran, започвайки на ден 2, и убити на ден 2 (3 часа след лечение с Eritoran) и на дни 4 и 6. Обща РНК се екстрахира от белодробни хомогенати и генната експресия се измерва чрез количествена полимеразна верижна реакция с количествена обратна транскрипция в реално време (qRT – PCR). Лекуваните с ериторан мишки показват значително притъпена про- и противовъзпалителна генна експресия във всяка времева точка (фиг. 4а и допълнителна фиг. 3А; P Фигура 4: Лечението с ериторан потиска индуцираната от грип експресия на цитокинов ген.
Ifnb -/- мишките са силно податливи на PR8 и не са защитени от мощния индуктор на IFN-β, 5,6-диметилксантенон-4-оцетна киселина 18. В допълнение, ендогенният IFN-β е необходим за нормална базална и LPS-индуцируема експресия на много проинфламаторни цитокини в макрофаги 19. Заразени с PR8 Ifnb -/- мишките не са били защитени от Eritoran (допълнителна фигура 4). Това показва, че макар и провъзпалително и Ifnb генната експресия е притъпена при заразени с PR8, лекувани с ериторан мишки от див тип (фиг. 4а, б), разработването на някои IFN-β е необходимо за антивирусна защита при липса на значително грундиране.
Най-мощното активиране на TLR4 от LPS зависи от катализирана LPS свързващ протеин (LBP) екстракция и трансфер на отделни молекули LPS от агрегиран LPS към CD14 и след това от CD14 към MD2, последвано от ангажиране и димеризация на TLR4. Кристалографският анализ разкрива, че Eritoran, подобно на LPS липид А мономера, се свързва в дълбокия хидрофобен джоб на MD2; обаче, за разлика от липид А, Eritoran не успява да индуцира димеризация и активиране на TLR4, като по този начин действа като TLR4 антагонист 20 .
Потвърдихме констатацията 2, че индуцираната от PR8 леталност при мишки е зависима от TLR4 (Фиг. 5а), но също така установихме изненадващо, че смъртността от грип не зависи от CD14, както се посочва от подобната смъртност в резултат на PR8 инфекция при див тип и Cd14 -/- мишки срещу съпротивлението на Tlr4 -/- мишки (фиг. 5а). Тези открития показват, че TLR4-зависимата смъртност от грип се медиира от индуцирани от грип агонисти на TLR4, които за разлика от LPS не зависят от CD14 за ангажиране и активиране на TLR4/MD2. За разлика от това, защитата, предизвикана при мишки от див тип, когато лечението с Eritoran започне на 2-ия ден след отсъствие на инфекция при Cd14 -/- мишки, което показва, че защитният ефект на Eritoran в този модел на грипна инфекция зависи от CD14 (Фиг. 5а).
Едно от възможните обяснения за зависимостта CD14 на медиираната от Ериторан защита е, че ангажираността от Ериторан на MD2 и антагонизмът на TLR4 зависи от CD14. За да тестваме тази възможност, тествахме инвитро способността на Eritoran да свързва CD14 и MD2 чрез измерване на инхибиране от Eritoran на LBP-зависим трансфер на тритиран липоолигозахарид ([3 H] LOS; LPS на Neisseria) към CD14 (Фиг. 5b, вляво), както и прехвърлянето на [3 H] LOS от CD14 към MD2 (Фиг. 5b, вдясно). Тъй като инхибиторният ефект на Eritoran върху трансфера на [3 H] LOS към MD2 е 100 пъти по-мощен, когато са налице LBP и разтворим CD14, това показва, че взаимодействието на Eritoran с MD2 възниква най-ефективно след LBP-зависимото взаимодействие на Eritoran с CD14.
Въпреки че MD1, хомолог на MD2, който също свързва липид A 21, беше разглеждан като алтернативна цел за Eritoran, тази възможност беше отхвърлена, тъй като MD1 не успя да замени MD2, за да даде възможност за TLR4 сигнализиране (допълнителна фигура 5).
Диацилираните липиди могат да действат като TLR2 агонисти. Следователно, ако окислените гостоприемни фосфолипиди (например OxPAPC) имат роля в TLR4-зависимия грип, възможно е тези диацилирани липиди също да могат да ангажират TLR2-съдържащи рецепторни комплекси и че индуцираната от грип смъртност може също да зависи от TLR2. въпреки това, Tlr2 -/- мишки показаха подобна чувствителност към PR8 инфекция като мишки от див тип (Фиг. 5а), аргументирайки се срещу важна роля за TLR2 в индуцираната от грип смъртност. Забележително е обаче, че защитата, предизвикана от лечение с Eritoran, започваща на 2-ия ден след отсъствието на инфекция през Tlr2 -/- мишки, предполагащи нова роля за TLR2 в ериторанското действие.
Ако индуцираното от PR8 остро нараняване на белите дробове и смъртността, които наблюдаваме, се дължат основно на индуцираните от грип окислени фосфолипиди на гостоприемника, както беше предложено по-рано 1, тези съединения трябва да показват преференциално активиране на TLR4 (спрямо TLR2) и да бъдат инхибирани от Eritoran. Търговски получен OxPAPC сравнително активиран Il6 генна експресия в див тип и Tlr2 -/- перитонеални макрофаги, но е инхибирано с ∼ 84% през Tlr4 -/- макрофаги в сравнение с дивия тип отговор. Клетъчното активиране от OxPAPC също е значително инхибирано от Eritoran, включително ниското ниво на TLR4-независимо производство на Il6 иРНК, наблюдавана в Tlr4 -/- макрофаги (допълнителна фигура 6). Това показва, че отговорът на OxPAPC е предимно зависим от TLR4 и чувствителен към Eritoran.
За да се оцени ефектът на Eritoran върху производството на окислени фосфолипиди по време на инфекция, се използва матрична подпомогната лазерна десорбционна йонизационно-образна масова спектрометрия (MALDI-IMS) за идентифициране на промени в липидния състав на белите дробове на мишки след инфекция с PR8, със или без лечение с Eritoran . Предвидени продукти на окисляване (съотношение маса към заряд (м/z) 650, 830) от 1-палмитоил-2-арахидонаил-sn-глицеро-3-фосфохолин (PAPC) или други полиненаситени фосфатидилхолини, както е описано по-горе 1, са открити в по-голямо количество при PR8-заразени срещу заразени или заразени с фалшиви и лекувани с ериторан бели дробове (допълнителна фигура 7). Тези резултати бяха потвърдени чрез електроспрей йонизация-масспектрометрия (данните не са показани). Заедно тези резултати показват, че оксидираните фосфатидилхолини присъстват в инфектирани с грип бели дробове и показват, че лечението с Eritoran намалява относителното изобилие на тези характерни йони. По този начин лечението с мишки, заразени с грип, с Eritoran не само блокира цитокиновата буря, изострена от ендогенните TLR4 агонисти, индуцирани от грип, но също така инхибира производството и натрупването на някои окислени фосфолипиди в заразените бели дробове, включително OxPAPC и вероятно други.
Обобщение на методите
In vivo измервания
Мишки и памучни плъхове са заразени i.n. както е посочено с грипния вирус, последвано от прилагане на контрола или Eritoran i.v. Преживяемост, клиничен резултат, загуба на тегло, експресия на цитокинен ген, вирусни титри, изобилие на OxPAPC и нива на ALT/AST.
Измервания на клетъчна култура
Първичните миши култури от макрофаги са третирани с TLR агонисти или OxPAPC със или без Eritoran, и Il6 тРНК е измерена чрез qRT – PCR.
Биохимични измервания
Способността на Eritoran да инхибира свързването на LPS с CD14 или прехвърлянето на LPS от CD14 към MD2 е извършена, както е съобщено 22,23 .
- Защо Natures Sunshine Health Supplements, Nature s Sunshine Products, NSP, Nutrition Supplement
- Новите хуманитарни усилия за борба с широко разпространената туберкулозна инфекция
- Работете с отслабването на природата
- Ксилитол; Отслабването се връща към природата
- Резултатът от работата на животинския полет от птици и от човешката сила