Ричард Дж. Ламонт
1 Катедра по орална имунология и инфекциозни болести, Стоматологично училище, Университет в Луисвил, Луисвил, KY, САЩ.
Хюн Ку
2 Катедра по ортодонтия и отдели по детска стоматология и здраве на устната кухина, Penn Dental Medicine, University of Pennsylvania, Philadelphia, PA, USA.
Джордж Хаджишенгалис
3 Катедра по микробиология, Дентална медицина в Пен, Университет на Пенсилвания, Филаделфия, Пенсилвания, САЩ.
R.J.L., H.K. и Г.Х. проучи данните за статията, допринесе значително за обсъждането на съдържанието, написа статията и прегледа и редактира ръкописа преди изпращане.
Резюме
Динамичният и полимикробен орален микробиом е директен предшественик на заболявания като зъбен кариес и пародонтит, две от най-разпространените микробно разстройства в световен мащаб. Различните микросреди в устните бариери приютяват уникални микробни общности, които се регулират чрез сложни системи за сигнализация и от фактори на гостоприемника и околната среда. Колективната функция на микробните общности е основен двигател на хомеостазата или дисбиозата и в крайна сметка здравето или болестта. Въпреки различните етиологии, периодонтитът и кариесът се задвижват от верига за пренасочване между микробиотата и гостоприемните фактори (съответно възпаление и хранителни захари), която благоприятства появата и персистирането на дисбиозата. В този преглед ние обсъждаме съвременните знания и нововъзникващите механизми, управляващи оралната полимикробна синергия и дисбиоза, които едновременно подобриха нашето разбиране за патогенните механизми и подпомогнаха дизайна на иновативни терапевтични подходи за орални заболявания.
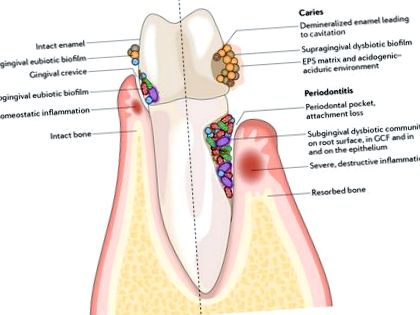
Различни микроорганизми обитават устната кухина 1,2 и в много случаи са уникални за тази ниша, тъй като са разработили изключителна специфичност за орална колонизация 3. В устната кухина има различни микросреди, като твърдите повърхности на зъбите, които не се отделят, и епителните повърхности на лигавиците (ФИГ. 1). Тези повърхности са изложени на течна фаза на слюнка или, ако е субгингивална, на венечно-кревикуларна течност (GCF). Микробните съобщества, които растат по тези повърхности, също са различни и всеки един сайт съдържа
50 вида - подмножество от
Микробна колонизация се случва на всички налични повърхности и микроорганизмите също могат да проникнат в епителните тъкани и клетки. Микробиотата се сглобява в биофилмови общности на абиотичните и биотичните повърхности. В здравето (вляво) еубиотичните биофилми поддържат хомеостатичен баланс с гостоприемника. При заболяване (вдясно) възникват кариес и пародонтит, когато биофилмите стават дисбиотични, което води до повишени нива и продължителност на предизвикателство с ниско pH и съответно индуциране на деструктивни възпалителни реакции. EPS, извънклетъчно полимерно вещество; GCF, венечна кревикуларна течност.
Клетка 1 | Модели на индуциран от микробиота пародонтит
Устната микробиота и болести
Няколко процеса са в основата на прехода на микробна общност в състояние на дисбиоза. Промените в имунната компетентност на приемника или диетата могат да повлияят на състава на общността и метатранскрипционния пейзаж, с увеличаване на производството на фактори на вирулентност. С развитието на общността микробният метаболизъм и страничните продукти от имунния отговор на гостоприемника могат да причинят промени в местната среда, които улесняват израстването или прекомерното представяне на микроорганизми, свързани с дисбиотично състояние. Следователно микробиотата, свързана със здравословно състояние, се счита за по-обща, докато свързаната със заболяването микробиота се влияе от „специализираните“ микроорганизми, които притежават метаболитни функции и повишен потенциал за вирулентност, които до голяма степен липсват в здравето13. След като една общност е преминала в дисбиотично състояние, структурната стабилност на функционално специализирани компоненти 6,14,15 ще позволи състоянието да продължи за продължителен период от време, а оралните заболявания като пародонтит и зъбен кариес (ФИГ. 1) са често хронично и бавно прогресиращо (въпреки че острата поява и на двете заболявания може да бъде предизвикана при определени условия, застрашаващи гостоприемника).
Наддесневи общности и зъбен кариес.
Субгингивални общности и пародонтоза.
Устната микробиота при рак и други системни заболявания.
Все повече доказателства подкрепят връзката между оралния микробиом и оралния рак, като орално плоскоклетъчен карцином. Механистично разбиране за такава асоциация може да възникне от способността на много орални микроорганизми да променят възпалителната микросреда и да пречат на сигналните пътища на гостоприемника, които контролират клетъчната жизнеспособност, пролиферация и диференциация 33–38. Забележително е, че влиянието на оралния микробиом може да се разшири отвъд устната кухина и системни състояния като коронарна артериална болест, преждевременно раждане на новородени с ниско тегло и ревматоиден артрит са свързани с оралния микробиом 39–41. В случай на ревматоиден артрит, ензимът пептидиларгинин деиминаза PPAD - произведен уникално от P. gingivalis - може да цитрулинира протеини гостоприемници, които след това могат да индуцират производството на автоантитела 42 .
Полимикробна синергия
Домакинска диета и биофилми при зъбен кариес
Полимикробни взаимодействия и ацидогенеза.
Ролята на извънклетъчния матрикс.
Като цяло зъбният кариес може да бъде концептуално дефиниран като патологичен процес, зависим от диетата на гостоприемника, който разчита не само на екологичните промени и полимикробната ацидогенеза, но и на извънклетъчната среда на биофилма, в която организмите взаимодействат и се натрупват киселини. Тази променяща се гледна точка на екологичния поток и съгласуваните полимикробни синергии в структурирана и защитена среда, заедно със слюнчените и поведенчески фактори, има пряко значение за развитието на нови и по-ефективни антибиотични терапевтични средства.
Възпаление и дисбиоза при пародонтоза
Колонизацията от ключови патогени (например Porphyromonas gingivalis), подпомогната от спомагателни патогени (например Streptococcus gordonii), води до нарушена вродена защита на гостоприемника и насърчаване на възпалението (например, чрез подкопаване на кръстосани препратки на подобен на Toll рецептор (TLR) в неутрофили и други миелоидни клетки) 60,102,117,119. Тези промени допринасят за появата на дисбиоза (количествени и композиционни промени в пародонталната микробиота). Възпалението влошава дисбиозата чрез увеличаване на потока от гингивално-кревикуларна течност (GCF), която в резултат на възпалително разрушаване на тъканите носи разграден колаген и съдържащи хем съединения в гингивалната цепнатина, където се развиват дисбиотични съобщества. Тези молекули селективно се използват от протеолитични и асахаролитични бактерии с капацитет за придобиване на желязо. За разлика от тях, свързаните със здравето (еубиотични) видове не могат да се възползват от новите условия на околната среда и са надминати. Този дисбаланс води до дисбиоза, която допълнително изостря възпалението, което завършва с пародонтит при податливи индивиди. Способността на възпалението и дисбиозата да се подсилват положително взаимно в самоподдържащ се цикъл на предаване може да допринесе за хронифицирането на пародонтоза.
Дали дисбиозата е причина или следствие от възпалително заболяване е предмет на дебат 114,115. При пародонтоза изглежда има взаимна причинно-следствена връзка между дисбиозата и възпалението. Тъй като възпалението подхранва селективния растеж на дисбиотичните общности и дисбиозата изостря възпалението 28,105–108,111,113, вероятно е нито разрушителното възпаление, нито дисбиозата да се развият напълно без взаимодействия между тези два процеса. В заключение, възпалението действа като реципрочен екологичен двигател на дисбиозата и това взаимодействие между възпаление и дисбиоза изглежда генерира самоподдържаща се верига за пренасочване, която задвижва пародонтита (ФИГ. 4).
Подриване на отговора на хоста
Отделяне на бактерицидната активност от възпалението.
Решаващото значение на възпалението за развитието на дисбиоза създава биологична загадка - дисбиотичните общности се нуждаят от възпаление, за да придобият хранителни вещества, но също така трябва да регулират имунния отговор на гостоприемника за тяхната защита. Въпреки че имуносупресията е често срещана микробна стратегия за избягване 116, тази тактика не би била жизнеспособна опция за възпалителни бактерии, тъй като би създала невъзпалителна среда, която гладува бактериите от основни хранителни вещества. Бактериите, свързани с пародонтоза, разрешиха този парадокс, като манипулираха отговора на гостоприемника по начин, който отделя възпалението от бактерицидната активност, както е илюстрирано от действието на основния патоген P. gingivalis 115. В този контекст, P. gingivalis може да бъде от полза за цялата микробна общност, като нарушава бактерицидната активност на вродените левкоцити, като същевременно насърчава техните възпалителни реакции 60,102,117–120 (ФИГ. 4). Значението на тази ключова функция е демонстрирано при мишки, при които това двойно подривно действие нарушава хомеостазата гостоприемник-микроорганизъм и допринася за появата на дисбиотична микробиота и развитието на пародонтит 102,117 .
Манипулация на комплемента, Toll-подобна рецепторна сигнализация и цитокини.
Оралните патобионти като Fusobacterium nukleatum се разпознават от Toll-подобни рецептори (TLR) на епителните клетъчни повърхности, което води до активиране на провъзпалителни сигнални пътища. Основният патоген Porphyromonas gingivalis може да манипулира тези пътища и да причини целенасочено и точно намаляване на производството на специфични хемокини. Инактивирането на STAT1 от P gingivalis води до намалена експресия на CXCL10, която се контролира от IRF1 транскрипционния фактор 124. Вътреклетъчно P. gingivalis секретира SerB, серин фосфатаза, която специфично дефосфорилира сериновия остатък 536 на p65 NF-κB субединицата, като по този начин инхибира образуването и ядрената транслокация на хомодимери NF-κB-p65. Транскрипцията на IL8 гена е намалена и IL-8 неутрофилният градиент е нарушен 125. Тези парализа на хемокиновата парализа ще бъдат локализирани в тъканите, съседни на или съдържащи P. gingivalis, и при животински модели заместват ефектите от патобионтите в общността 163. Непрекъснатото повторно калибриране на сигналните пътища на гостоприемни клетки също ограничава временната степен на явлението, което може да допринесе за цикличния характер на разрушаването на пародонталната тъкан. Адаптиран с разрешение от REF 10, Cell Press.
P. gingivalis като активист на общността.
Нови подходи за профилактика и лечение
Устните биофилми съдържат сложни полимикробни общности, включващи междувидови взаимодействия с гостоприемника, диетата и имунитета, които контролират дисбиозата и обясняват нозосимбиозността. Липсата на една очевидна цел за терапевтична интервенция и потенциалът за трансфер на гени за устойчивост на антибиотици и физическа защита, предоставени от EPS, усложняват възможностите за лечение и конвенционалното антимикробно елиминиране се оказва трудно. Наличието на течна фаза, която може да инактивира биоактивни молекули, и трудността за достъп до различни орални места, където се появява болестта, в комбинация с лошо задържане на локално доставени агенти, създават допълнителни предизвикателства. Тези уникални условия са препятствия, но също така и възможности за разработване на иновативни лекарства и ефективни терапии, които биха могли да насочат тези сложни биологични признаци и защитени устни ниши.
Появиха се нови нанотехнологии за доставка на лекарства, които могат да проникнат по-ефективно в биофилмите и да ускорят освобождаването на лекарството в отговор на киселинното рН, което би могло да повиши ефикасността на настоящите и бъдещите химични условия, насочени към кариогенните биофилми 129, 137–140. Друг подход използва рН-зависими каталитични наночастици, които генерират свободни радикали от водороден прекис само при киселинни стойности на рН и едновременно разграждат матрицата на биофилма и убиват вградени бактерии с висока ефективност при кариогенни условия. Локалното приложение на каталитични наночастици с ниски концентрации на водороден прекис предотвратява появата на тежък кариес (включително върху интерпроксимални и сулкални повърхности) без цитотоксични ефекти in vivo 137. По този начин стимулите или задействаните от околната среда технологии могат да повишат селективността на активирането или доставянето на лекарството в биофилмите, насочвайки матрицата и вградените бактерии, за да унищожат патологичните ниши с точност и ефикасност, без да засягат околните тъкани гостоприемници и коменсалната микробиота.
Бъдещото развитие трябва да се съсредоточи върху постигането на максимална in vivo ефикасност и насочване към специфичност с минимална токсичност и дългосрочни терапевтични ефекти (в сравнение с настоящото лечение). Те, в комбинация с клинични изпитвания за безопасност и ефикасност, достъпно производство и разработване на практически формулировки, ще определят дали някоя от настоящите предклинични стратегии може да се използва за лечение на човешки пародонтит и кариес.
Заключения и перспективи
Както при зъбния кариес, така и при пародонтита, нозосимбиозността на полимикробните общности, участващи в заболяването, се регулира до голяма степен от фактори гостоприемници, предимно от диетични захари и възпаление. При пародонтоза възпалението и дисбиозата се развиват взаимно по взаимно подсилен начин и тяхното взаимодействие се развива, за да се превърне в двигател на пародонтоза при чувствителни индивиди (ФИГ. 4). При кариес взаимодействията между диета и микробиота помагат да се събере устойчив биофилм, свързан със зъбите, който осигурява защита на пребиваващите микроорганизми. Биофилмът също е мястото, където полимикробната ацидогенеза създава киселинна среда, която нарушава хомеостазата на емайловата тъкан, благоприятствайки деминерализацията, която води до появата и прогресията на кариеса (влошена от слюнчена дисфункция, неадекватна експозиция на флуорид и лоша хигиена на устната кухина).
Полимикробните общности при кариес и пародонтит показват сложна структурна и функционална интеграция, която придава квазиорганизмен статус на тези образувания. Тази взаимозависимост между съставните членове на оралните полимикробни общности подкрепя „хипотезата на черната кралица“ 147, според която функциите, които са енергийно скъпи, могат да бъдат отхвърлени като необходими от организмите „измамници“, при условие че не са изцяло загубени от общността (че е, те се задържат от подгрупа от членове на общността („помощници“), които са в полза на общността). Тази хипотеза предлага теоретична рамка за появата на ключови или специализирани патогени, които допринасят за незаменима публична услуга на микробната общност (например формиране на матрица или подриване на имунитета на гостоприемника). Докато при класическите инфекциозни заболявания откритите патогени използват стратегии за преодоляване на резистентността към колонизация като предпоставка за причиняване на болести, ключовите или специализирани патогени експлоатират присъщите метаболитни и/или колонизационни свойства на техните съседни съседни (допълнителни патогени) или помагат да се създаде селективна среда, в която те увеличават тяхната вирулентност и нозосимбиотичност на общността.
Напредъкът в технологиите omics и подобреното подготвяне на база данни и биоинформатиката подобриха идентифицирането на активни микробни социални мрежи и техните продукти (гени, протеини и метаболити) 37,152. За да се премине отвъд корелациите и да се започне да се разглежда причинно-следствената връзка, е необходимо допълнително усъвършенстване на тези технологии. Интегрирането на данните от omics, съчетано с фенотипно-патогенна асоциация на микроорганизмите, заедно с допълващи се in vivo полимикробни модели 153, може да бъде мощна стратегия за идентифициране на допълнителни свързани с болестта микроорганизми, техните свойства на вирулентност и синергични взаимодействия, които модулират компонентите на микробиотата и имунитета на гостоприемника в представената тук концептуална рамка. На свой ред може да се разкрие по-пълен набор от терапевтични цели, предоставящи по-добри възможности за разработване на високо прецизни и ефикасни терапевтични подходи.
Благодарности
Терминологичен речник
Бележки под линия
Авторите не декларират конкуриращи се интереси.
Springer Nature остава неутрален по отношение на юрисдикционните претенции в публикувани карти и институционални принадлежности.
Nature Reviews Microbiology благодари на G. Belibasakis, B. Keijser и други анонимни рецензенти за техния принос към партньорската проверка на тази работа.
- Ежедневни формули за жени през устата, странични ефекти, взаимодействия, снимки, предупреждения; Дозиране - WebMD
- Витамин А до Я през устата, странични ефекти, взаимодействия, снимки, предупреждения; Дозиране - WebMD
- YAZ (28) Устна употреба, странични ефекти, взаимодействия, снимки, предупреждения; Дозиране - WebMD
- Терапевтични витаминиМинерали Орално приложение, странични ефекти, взаимодействия, снимки, предупреждения; Дозиране -
- Съдържанието на флуор в храни и напитки от пренебрежимо и оптимално флуорирани общности