Дария Л. Иванова
1 Молекулярна биология, Университет на Уайоминг, Ларами, Вашингтон, САЩ
Стивън Л. Дентън
1 Молекулярна биология, Университет на Уайоминг, Ларами, Вашингтон, САЩ
Кевин Д. Фетел
1 Молекулярна биология, Университет на Уайоминг, Ларами, Вашингтон, САЩ
Кери С. Сонджерот
2 Ветеринарни науки, Университет на Уайоминг, Ларами, Вашингтон, САЩ
Хуан Муньос Гутиерес
3 Микробиология, имунология и патология, Колеж по ветеринарна медицина и биомедицински науки, Държавен университет в Колорадо, Форт Колинс, Колорадо, САЩ
Берит Бангура
2 Ветеринарни науки, Университет на Уайоминг, Ларами, Вашингтон, САЩ
Илдико Р. Дунай
4 Институт по възпаление и невродегенерация, Университет Ото-фон-Герике Магдебург, Магдебург, Германия
Джейсън П. Гигли
1 Молекулярна биология, Университет на Уайоминг, Ларами, Вашингтон, САЩ
Резюме
Въведение
Apicomplexa са голямо семейство от протозойни паразити, които са задължителни вътреклетъчни паразити на топлокръвни животни. Почти всички от тях се считат за големи заплахи за здравето на хората и добитъка по целия свят. Те включват, но не се ограничават до Toxoplasma gondii (T. gondii), Plasmodium spp., Cryptosporidium spp., Eimeria spp. И Babesia spp. Други наистина съществуват, но този преглед ще се фокусира върху родовете, изброени по-горе. Обикновено те могат да бъдат разделени на патогени, пренасяни от вектора или предавани през устата. Апикомплексаните имат намалени размери на генома в сравнение с по-високите еукариоти, но те кодират няколко различни типа ефекторни протеини, които им позволяват да развият много сложна връзка със своите гостоприемници и да допринесат за вирулентността. Апикомплексантите, пренасяни от векторите, включват пренасяните от комари Plasmodium spp. и носената от кърлеж Babesia spp. Устно инфекциозните апикомплексани включват T. gondii, Cryptosporidium spp. и Eimeria spp. Plasmodium spp. заразява
200 милиона души и убива около 400 000 годишно (1). Babesia spp. е нововъзникваща паразитна инфекция на хора (2, 3). Toxoplasma gondii заразява
30% от хората по света и е третата водеща причина за хранителни заболявания в САЩ (4). Има средно 750 000 нови случая на Cryptosporidium spp. годишно само в САЩ и паразитът се разпространява по целия свят (5). Eimeria spp. инфекциите могат да бъдат опустошителни за фермите за пилета и говеждо месо, но изглежда не е заразно за хората (6). Много от тези протозойни паразити могат да бъдат проблематични за хора с нарушена имунна система, особено тези с ХИВ/СПИН. Освен това при имунокомпетентни индивиди по-голямата част от тези инфекции могат да причинят значителна тъканна заболеваемост и патология, водещи до дългосрочно увреждане на гостоприемника. В случай на инфекция с T. gondii има все повече доказателства, че персистиращата инфекция може да допринесе за психиатрични разстройства и невродегенеративни разстройства (7). По този начин постигането на по-добро разбиране на имунните фактори, участващи в контрола на тези патогени, както и факторите, които допринасят за имунопатологията, е важно за намаляване на отрицателните здравни резултати, причинени от тези често срещани инфекции.
Имунният контрол на апикомплексаните до голяма степен зависи от индуцирането на адаптивния имунитет чрез Т-хелпер тип 1 (Th1) отговор и производството на IFNγ (8). В допълнение към Th1 отговора се индуцира и производството на IL-17 и свързаното с него възпаление (9-12). В много случаи този Th17 отговор изглежда допринася за имунната патология, свързана с тези инфекции. За да се развие или Th1 или Th17 отговор, вродените имунни клетки трябва да бъдат задействани, за да произведат цитокините, важни за насочване на това кои видове Т-помощни отговори се развиват. В сравнение с вирусни инфекции, където се знае много за вродения имунен клетъчен състав и как тези клетки функционират в защита и имунопатология, по-малко е известно в контекста на апикомплексната инфекция. Съществуват активни области на изследване за разширяване на тези знания при протозойни инфекции, включително разбиране за това как вродените имунни отговори допринасят за контрола, причиняват патология и влияят върху развитието на адаптивни реакции. Въпреки това все още съществува голяма разлика в знанията в разбирането на всички вродени популации от имунни клетки, които се набират и активират по време на протозойни инфекции, и каква роля имат всяка от тях в защитата, причинявайки патология и/или регулирайки адаптивните имунни отговори.
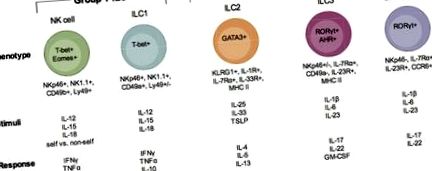
Описание на подмножества ILC. Има три групи ILC, ILC от група 1, ILC от група 2 и ILC от група 3. Във всяка от тези групи са посочени подмножества от клетки (група 1: NK клетки и ILC1; група 2: ILC2; група 3 ILC3 и LTi-подобна ILC3). Всяка ILC е илюстрирана с транскрипционните фактори, важни за тяхното развитие и функция, техния повърхностен фенотип, стимулите, за които е известно, че ги активират и имунните фактори, произведени при тяхното активиране и реагиране на инфекция.
Група 1 ILC
Група 2 ILC
Група 3 ILC
ILC пластичност
Границата между подтиповете на ILC стана по-дефинирана, но както беше отбелязано по-горе, ILC са силно пластични и могат да се преобразуват един в друг в зависимост от средата, която изпитват (23). Например при определени възпалителни състояния ILC2 и ILC3 могат да експресират T-bet и да произвеждат Th1 цитокини (27, 29, 33). Когато условията позволяват, тези новосъздадени ILC1 могат да се преобразуват обратно в ILC2 и ILC3. Тази клетъчна пластичност вероятно е от съществено значение за генерирането на оптимални реакции срещу патогени и поддържане на целостта на тъканите. Поради тази нова оценка на разнообразието на ILC, как различните популации на ILC участват в имунитета срещу апикомплексна инфекция, не е добре дефинирано. След това ще обсъдим това, което в момента е известно за ILC по време на тези паразитни инфекции и ще подчертаем ситуации, при които могат да участват различни ILC. Също така ще обсъдим как различни ILC могат да бъдат замесени в адаптивния имунитет към тези патогени.
ILC и Toxoplasma gondii
Малък брой проучвания са изследвали дали паразитна инфекция на NK клетки влияе върху тяхното поведение (47–49). NK клетките могат да бъдат паразитирани, но това се случва при много ниска честота in vitro и in vivo. Тези заразени NK клетки показват фенотип на хипермотилитет и дефектна функция. Скорошно проучване показва, че заразените NK клетки не допринасят за разпространението на паразити в мишката (47). По този начин как пряката паразитна инфекция на NK клетки влияе върху протичането на заболяването не е известно и трябва да бъде допълнително проучено.
Все още има много отворени въпроси относно ролите на различни популации на ILC и инфекция с T. gondii. Важността на всеки ILC подтип не е разгледана изцяло и има въпроси относно NK клетките, които ще трябва да бъдат преразгледани поради увеличаването на знанията за различните подгрупи ILC в контекста на инфекцията. Много проучвания, изследващи ILC по време на инфекция с T. gondii, са фокусирани върху острия стадий на инфекцията. Тяхното значение в дългосрочния контрол на паразита все още не е ясно, особено при хронична инфекция с T. gondii и ЦНС, което е настоящият фокус на нашата лаборатория.
ILC и плазмодий
При мишки далачните, чернодробните и периферните NK (NK1.1 +) клетки предпазват от ранните стадии на маларийна инфекция, като произвеждат IFNγ и TNFα (59–62). След третиране с анти-ASGM1 и изчерпване на NK клетки се наблюдава намаляване на продукцията на IFNγ и увеличаване на паразитемията при мишки (59, 60). При хората се смята, че NK клетките са едни от първите клетки, произвеждащи IFNγ по време на инфекция (1, 58). Човешки NK клетки (CD56 +) произвеждат IFNy и TNFα след инфекция с Plasmodium falciparum (63–65). Човешки NK клетки (могат да произведат IFNγ след стимулация с инфектирани с плазмодий еритроцити in vitro (66). В допълнение към производството на IFNγ, се смята, че NK клетките в периферната кръв са стимулирани да бъдат цитотоксични в отговор на паразитна инфекция (67, 68). клетките освобождават цитотоксични молекули, когато се култивират със заразени хепатоцити и еритроцити in vitro. Наблюдавано е, че NK клетките взаимодействат директно със заразените еритроцити, образувайки конюгати (66, 69, 70). Доказано е, че човешките NK клетки убиват заразените еритроцити (71). NK-специфичната цитотоксичност е важна за контролирането на паразита in vivo все още е неясна и все още трябва да бъде официално тествана при миши модели на инфекция или при хора.
Друг отворен въпрос, който не е изследван в Plasmodium spp. инфекцията е дали и как ILC популациите могат да регулират адаптивните имунни отговори. ILC могат както положително, така и отрицателно да регулират адаптивния имунитет. NK клетъчният IFNγ може да помогне на първичните Т-клетъчни отговори по време на Plasmodium spp. инфекция (72). По време на инфекция с T. gondii, NK клетките и/или друга ILC продуцират IL-10 (55, 56). Тази NK-клетка IL-10 може да регулира отрицателно адаптивния имунен отговор срещу паразита, който може да предотврати имунопатологията. Неотдавнашно проучване сега демонстрира, че лечението на мишки с IL-15 комплекс (IL-15C) стимулира NK клетките да произвеждат IL-10 по време на инфекция с плазмодий berghei ANKA (93). Тази NK клетка IL-10 беше необходима за защита срещу CM. Дали NK клетка или друга ILC IL-10 продукция в отговор на Plasmodium spp. инфекцията оказва влияние върху развитието на адаптивния имунитет към Plasmodium spp. инфекцията ще бъде важно за по-нататъшно изследване.
ILC и Cryptosporidium
ILC и Eimeria
ILC и Babesia
Дали други ILC реагират и играят роля в Babesia spp. инфекция не е известна. Въпреки това, поради локализацията на тази инфекция (кръв и далак), други ILC може да са по-малко важни за тази инфекция. Интересното е, че Babesia spp. изглежда, че индуцира предимно Th1 отговор, тъй като нивата на IL-17 и IL-22 не се променят значително в миши модел на инфекция (2). Ще бъде необходимо по-задълбочено изследване на подгрупите ILC, за да се оцени напълно ролята на тези клетки в имунитета срещу Babesia spp. инфекция. Това включва проучвания, изследващи как ILC може да повлияе положително и отрицателно на адаптивните имунни отговори.
Заключения на ILCS и Apicomplexa и бъдещи указания
Принос на автора
JG замисля рецензията. JG, DI, SD и KF написаха рецензията. JG, DI, SD, KF, KS, JM, BB и ID помогнаха за редактирането на отзива.
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
Бележки под линия
Финансиране. Тази работа е подкрепена от безвъзмездни средства от Американската асоциация по сърдечни заболявания (AHA 17GRNT33700199) и NIH Wyoming INBRE DRPP P20 GM103432, присъдени на JG и NIH Wyoming INBRE аспирант GA, присъден на DI. Този проект се подпомага отчасти с безвъзмездна помощ от Националния институт по общи медицински науки (2P20GM103432) от Националните здравни институти. Съдържанието е отговорност единствено на авторите и не представлява непременно официалните възгледи на Националните здравни институти.
- Идентифициране на 130 kDa клетъчна повърхност LDL-свързващ протеин от гладкомускулни клетки като частичен
- ХИВ инфекция Признаци, симптоми и усложнения
- Анкилостоми и инфекции с анкилостома, симптоми, лечение, профилактика
- Нарушен естествен имунитет, зависим от мастоцитите при комплементарни мишки с дефицит на С3
- Кератиново комплексно лечение от Coppola N95 KN95 маска за коронавирус, респиратор за защита от вируси