Въведение
Нашите физиологични процеси и нашето поведение обикновено са организирани в цикъл от около 24 часа. Циркадните ритми се срещат в почти всички организми и вероятно дават еволюционно предимство. Например, хората са физиологично подготвени за активност и поглъщане на храна през светлата част на деня и за гладуване и възстановяване по време на тъмнина.
Циркадните ритми са ендогенни, персистиращи при липса на промени в околната среда или поведение през деня и нощта. Силата на циркадната ритмичност е илюстрирана най-добре, когато поведението ни се случва в „грешното“ време според вътрешния ни телесен часовник. Например, хората с реактивни изоставания се хранят и се опитват да спят в необичайни циркадни фази и това често причинява гадене и умора. Нощните работници могат да имат почти непрекъснати симптоми на забавяне, което може да доведе до безсъние, сърдечно-съдови заболявания, хипертония, затлъстяване и диабет. 1-3 Следователно представлява интерес скорошно проучване на Solt et al. 4, включващи синтетични съединения, които променят циркадните ритми. (Свързано проучване от Cho et al., 5 е публикувано едновременно.)
При бозайниците съществува централен циркаден пейсмейкър в супрахиазматичното ядро на хипоталамуса, който организира множеството циркадни ритми във физиологични процеси и поведения. Този централен пейсмейкър се инициира и поддържа в невроните на супрахиазматичното ядро от молекулен часовник, който включва последователност от събития, образуващи транскрипция-транслация на обратна връзка (верига, в която транслацията на протеин инхибира, чрез непреки или преки пътища, транскрипция на гена, кодиращ този протеин). Тази последователност от събития продължава приблизително 24 часа, като включва осцилации в експресията на ключови протеини като CLOCK, BMAL1, PER, CRY и NPAS2. Два ядрени рецептора, наречени REV-ERB-α и REV-ERB-β, помагат за регулиране на трептенията на BMAL1 и CLOCK и по този начин модулират циркадната ритмичност. Периферните клетки и тъкани притежават един и същ молекулен часовник, а периферните циркадни ритми обикновено се синхронизират с централния пейсмейкър чрез непреки невронни, хуморални и температурни влияния. Начинът, по който тази синхронизация се случва в тялото, не е добре разбран.
Часовникът с супрахиазматично ядро обикновено се приспособява към сезонните промени в продължителността на деня. Тази настройка се причинява от ефектите на синхронизиращите стимули (наречени цайтгебер) като светлината. Въпреки това, фазата на централния пейсмейкър в супрахиазматичното ядро може да отнеме много дни, за да се адаптира, когато тези цайтгебри се появят извън синхронизацията, например след бързите промени в графика светлина-тъмнина, които се случват при пътуване с джет през часовите зони и нощната работа. В допълнение, вътрешната дисинхрония може да възникне между циркадната фаза на супрахиазматичното ядро и фазата на периферните органи поради разликите в това колко бързо централните и периферните тъканни часовници се нулират след поведенческа или цайтгеберна смяна.
Метърът на метаболизма
Начинът, по който тези сложни промени в молекулярния часовник ще се превърнат в променено поведение или функция, е донякъде непредсказуем. Авторите отбелязват, че ефектите на SR9009 и SR9011 върху локомоторната активност и молекулярно-часовата функция в хипоталамуса са силно отслабени, когато мишките се поддържат в нормален график светлина-тъмнина, констатация, която предполага, че входящата светлина или отрича или взаимодейства с тях лекарствени ефекти.
Solt et al. след това прилага агонистите на мишки с нормално тегло в продължение на 7 до 10 дни, което води до загуба на тегло (извън тази, наблюдавана при контролни инжекции), дължаща се най-вече на загуба на мастна маса. Тази загуба на тегло вероятно е причинена от повишена основна консумация на кислород; мишките не показват нито увеличение на активността (което намалява с 15%), нито намаляване на приема на храна (което се увеличава с 10% през нощта).
След това, Solt et al. анализира експресията на молекулярни часовници и метаболитни гени поотделно в мускулите, черния дроб и бялата мастна тъкан след единични инжекции на синтетични REV-ERB-α и REV-ERB-β агонисти. Те наблюдават различия в ефекта на тези агонисти върху молекулните часовници на супрахиазматичното ядро и на периферията, констатация, която предполага вътрешна дисинхрония. Те наблюдават намалени нива на експресия на липогенни гени в черния дроб и повишени нива на ензими, отговорни за окисляването на глюкозата и мастните киселини и транспорта на мастни киселини в мускулната тъкан. В бялата мастна тъкан експресията на гени, участващи в съхранението на липиди, е сравнително слаба. Тези резултати са в съответствие с потискане на липогенезата и на синтеза на холестерол и жлъчни киселини в черния дроб, повишено окисление на липидите и глюкозата в скелетните мускули и намален синтез и съхранение на триглицериди в бяла мастна тъкан.
Фигура 1. 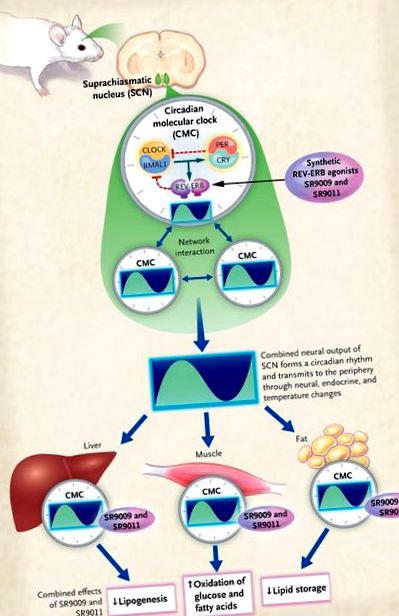
Централният циркаден пейсмейкър съществува в супрахиазматичното ядро (SCN) на хипоталамуса. Циркадният молекулярен часовник (CMC) съществува във всички клетки в тялото и се състои от положителен крайник (управляван от хетеродимера CLOCK – BMAL1) и отрицателен крайник (управляван от хетеродимера PER – CRY). Той се модулира от ядрения рецептор REV-ERB. Клетките в SCN образуват мрежа от взаимодействия, в резултат на което се променя активността на йонните канали и в крайна сметка невронният изход с циркаден ритъм. След това този циркаден нервен изход действа директно или индиректно (например чрез посреднически ендокринни сигнали), за да синхронизира дейността на периферните органи. Периферните клетки обаче съдържат и CMC. Solt et al. 4 наскоро установи, че синтетичните REV-ERB агонисти (SR9009 и SR9011) могат да повлияят на функцията на часовника в SCN и периферните сайтове и могат да причинят загуба на тегло при затлъстели мишки.
Въз основа на тези впечатляващи констатации, авторите предоставят съпротива: инжектирането на агонистите в затлъстели мишки за период от 12 дни води до намаляване на теглото (60% над наблюдаваното при контролни инжекции), загуба на мастна маса и подобрено общ метаболитен профил, включително по-ниски плазмени нива на триглицериди, общ холестерол, нестерифицирани мастни киселини, глюкоза и инсулин (Фигура 1). (Наблюдава се и 80% намаление на лептина, вероятно поради загубата на мастна маса.) Изследователите освен това отбелязват, че инжектирането на синтетични REV-ERB агонисти намалява триглицеридите и общия холестерол дори при слаби мишки.
Време е за повече работа
- Изследването свързва телесния часовник със затлъстяването и диабета
- Отрицателното изображение на тялото увеличава риска от затлъстяване при тийнейджърите
- Референтен състав на тялото и антропометрия Международен вестник за затлъстяването
- Отрицателно изображение на тялото, свързано със затлъстяването сред подрастващите - Терапевтичен блог
- Оптимални фармакологични стратегии за лечение при затлъстяване и диабет тип 2
