Резюме
Острата болест присадка срещу гостоприемник (GVHD) е най-важният фактор за ранна смъртност, свързана с трансплантацията (TRM), а също и силен предиктор за хронична GVHD след алогенна трансплантация на стволови клетки (SCT). 1 Профилактичната имуносупресия с циклоспорин А (CsA), метотрексат (MTX) и преднизолон не винаги адекватно предотвратява тежка остра GVHD. 2,3,4 Прогнозата за пациенти с остър GVHD, рефрактерен към високи дози преднизолон, е лоша и няма установена терапия за рефрактерни на GVHD стероиди. 5
Базиликсимаб е химерно моноклонално антитяло, което се свързва с висок афинитет към алфа-веригата на интерлевкин-2 рецептора (IL-2-Rα) и предотвратява образуването на IL-2 свързващо място. 6 Хетеротримеризацията и участието на IL-2-R α-веригата в IL-2-R комплекса придава свойства на свързване с висок афинитет на IL-2 с последващо бързо клоново разширяване на активирани Т-лимфоцити. 7,8 Специфичното инхибиране на активирането на Т-клетки от антитела на α-веригата на IL-2-R може да прекъсне каскадата на взаимно клетъчно активиране, пролиферация и освобождаване на цитокини в хода на GVHD, което води до възпаление и разрушаване на тъканите. 9
Базиликсимаб е оценен и доказано ефективен във фаза III проучвания за профилактика на остро отхвърляне след бъбречна трансплантация. Честотата на имунните отговори на базиликсимаб е била много ниска в тези проучвания. 10,11
Оценихме безопасността и ефикасността на базиликсимаб при терапия на стероидно-рефрактерни GVHD след алогенен SCT.
Пациенти и методи
След несвързан SCT, пациентите са получавали G-CSF за по-бързо възстановяване на хемопоезата в доза 5 μg/kg/ден от 5-ия ден, докато гранулоцитите са над 1,0 × 10 9/l за 2 дни.
Острите и хронични GVHD са класифицирани според Glucksberg 12 и Shulman. 13 Клиничното класифициране на GVHD преди базиликсимаб и оценка на отговора след това се извършва ежедневно сутрин преди даване на имуносупресивни лекарства от двама опитни хематолози. При подозрение за остър GVHD се извършва кожна биопсия. В случаите на подозрение за GVHD на червата и черния дроб, неубедителна биопсия на кожата или без участие на кожата, е извършена биопсия на червата или трансгугулна чернодробна биопсия.
Пациентите са имали право на терапия с базиликсимаб, ако са имали остра GVHD степен II до IV, резистентна на стероидна терапия от 2 mg преднизолон/kg/ден или повече в продължение на поне 3 дни. Базиликсимаб 20 mg се прилага интравенозно в продължение на 20 минути на 1 или 2 последователни дни и се повтаря седмично след това.
Подобрението на GVHD се определя като пълен отговор (CR), ако пациентите нямат клинични или биохимични признаци на GVHD във всички участващи органи, т.е. няма обрив, нормален билирубин и диария. Частичният отговор (PR) се дефинира като подобрение с един клас поне като цяло и без признаци на влошаване на който и да е от участващите органи. 14 Ако GVHD се повтори след първоначален отговор на базиликсимаб, тези пациенти се считат за неуспешни в лечението. Пациентите също са проследени за по-късното развитие на хронична GVHD.
Резултати
Острата GVHD стана очевидна при медиана от 25 дни (8–68 дни) след алогенна SCT. Участващите сайтове бяха кожа (н = 5), кожа и черва (н = 8), кожа и черен дроб (н = 1), червата и черния дроб (н = 2) и кожата, червата и черния дроб (н = 1). Кожни биопсии са извършени при 14/15 пациенти с обриви, чернодробни биопсии при двама от четирима пациенти с повишен билирубин и чревни биопсии при седем от 11 пациенти с диария. Всички биопсии потвърдиха клиничната диагноза на GvHD. Като цяло, 16/17 пациенти са били биопсирани и са имали хистологично потвърждение на GVHD; не са извършвани биопсии при 1/17 пациенти за потвърждаване на клиничната диагноза (Таблица 2).
Четиринадесет от 17 пациенти са имали GVHD степен III или IV, а трима от 17 пациенти са имали GVHD степен II. Диагнозата на острата GVHD е последвана от започване на терапия със стероиди същия ден. Двама от 17 пациенти са получавали 2 mg/kg преднизолон i.v. и 15/17 бяха получили 0,5–1,0 g метилпреднизолон i.v./day. GVHD не е реагирал на стероидна терапия при нито един от пациентите. Времето между началото на терапията със стероиди и първата инфузия на базиликсимаб е средно 7 дни (диапазон 3 до 25 дни). Всички пациенти, които са получавали преднизолон по-малко от 5 дни преди базиликсимаб, са имали прогресивна GVHD, докато са били само на стероиди (пациенти 2, 3, 4, 5, 13, вж. Таблица 3). Петима от 17 пациенти са имали участие само на кожата, но при двама от пет GVHD засяга цялата телесна повърхност и болката е непоносима (степен III). Трима от петима са имали обща степен II, но GvHD на кожата е прогресирал, докато пациентите са получавали стероидна терапия.
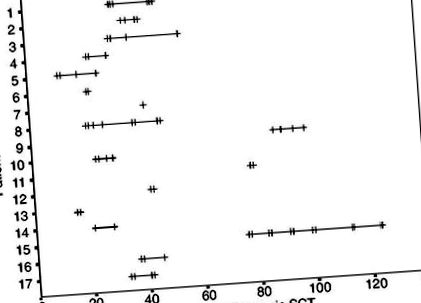
Общо 66 инфузии на базиликсимаб са дадени на 17 пациенти, с медиана от четири (диапазон 1–12) на пациент (Фигура 1).
Времеви точки на инфузии на базиликсимаб при 17 пациенти след алогенна SCT. Всяка вертикална линия означава ден от една инфузия на базиликсимаб след алогенна SCT.
При средно проследяване от 123 дни след първата доза базиликсимаб (15 до 502 дни), първоначално подобрение на GVHD се наблюдава при 15/17 пациенти. Три от тях рецидивираха и станаха рефрактерни за по-нататъшна терапия. Следователно 5/17 пациенти (29%) са класифицирани като неотговарящи (Таблица 3).
Дванадесет от 17 пациенти (71%) са имали значителен отговор на острата GVHD към базиликсимаб. Латентността между първата инфузия на базиликсимаб и очевидния отговор на GVHD от един клас най-общо беше кратка, при медиана от 2 дни (1 до 8 дни), обикновено след една до три дози (Таблица 3, Фигура 2).
Остра стомашно-чревна GVHD преди и след базиликсимаб. Отговор на чревната GVHD, обозначен с броя на дефекациите на ден на терапия с Predni = преднизолон; CsA = циклоспорин А; MP = метилпреднизолон и базилимаб при пациент 11 с остър GVHD степен III.
CR на остър GVHD се наблюдава при 9/17 пациенти (53%). Трима от 17 пациенти (18%) са имали PR.
Хронична GVHD се развива при осем от 13 оценими пациенти (62%) и само двама от осем пациенти са постигнали CR на GVHD след базиликсимаб.
И петте пациенти, които не са развили хронична GVHD, са имали CR на остър GvHD след базиликсимаб (Таблица 3).
Разтварянето на хематопоезата беше както се очакваше при всички пациенти; гранулоцити> 0,5/nl бяха достигнати след 15 дни (диапазон 10–19 дни) и тромбоцити> 20/nl след 17 дни (диапазон 11–26 дни).
Не са наблюдавани бактериални или гъбични инфекции след базиликсимаб. Петима от 17 пациенти са развили CMV-реактивация, един с CMV-пневмония. Двама пациенти развиват херпес лабиалис и херпес зостер, съответно.
При средно проследяване от 157 дни след алогенна SCT (диапазон от 31 до 513 дни), девет от 17 пациенти (53%) са живи в пълна ремисия на основното си заболяване. Осем пациенти са починали. Един от осем пациенти е починал от синдром на системния възпалителен отговор 102 дни след базиликсимаб; този пациент все още е получавал CsA и ниски дози преднизолон и не е имал признаци на GVHD по време на смъртта. Три от осем пациенти са починали от рецидив на основното си заболяване 31 до 157 дни след SCT; и трите са били трансплантирани с напреднала болест. Четири от осем пациенти са се поддали на неконтролирана GVHD 65 до 157 дни след SCT. Осем от 12 пациенти, отговорили на базиликсимаб, са живи, в сравнение с един от петима с рефрактерна GVHD (Таблица 3).
Дискусия
Преднизолон е лечение на избор при остра GVHD. 15 Въпреки това, лечението на остра GVHD със стероиди и други агенти има ограничена ефикасност и само 44% от пациентите реагират на първоначалната терапия. При тези, които се провалят на първично лечение, не съществува стандартна терапия и TRM е висока, подчертавайки необходимостта от по-ефективни средства. 5
Доколкото ни е известно, това е първият доклад за безопасността и ефикасността на базиликсимаб след алогенна SCT. Съобщени са само предварителни данни за 12 пациенти с остра GVHD; 83% са отговорили на базиликсимаб, а 25% са постигнали CR. 16.
Оптималната схема на дозиране на базиликсимаб не е известна и употребата му при бъбречна трансплантация следва клинични критерии. 20 mg са инжектирани в деня на бъбречната трансплантация и на ден 4. Разделянето е предназначено да избегне ненужната употреба на базиликсимаб в случаи на загуба на присадка или тежка инфекция рано след трансплантацията. 10,11
Поради стероидно-рефрактерния характер на острата GVHD, решихме да дадем 20 mg базиликсимаб на 2 последователни дни. 40 mg базиликсимаб са способни да насищат CD25-положителни лимфоцити за 26 ± 8 дни. 19 При тези пациенти, които не достигат CR на остър GVHD в рамките на 1 седмица, терапията с базиликсимаб се повтаря поради полуживота на антителата от 6–7 дни. 19.
Анализът на ефикасността на базиликсимаб се затруднява от малкия брой пациенти и от факта, че е установена комбинирана имуносупресия при всички пациенти преди базиликсимаб. Интервалът между началото на терапията с преднизон и базиликсимаб е кратък при някои от пациентите, но решихме да влеем базиликсимаб поради прогресия на GVHD. Въпреки това, терапевтичният ефект на базиликсимаб е много вероятен поради бързото и трайно подобрение на острата GVHD при 71% и пълното разрешаване на GVHD при 53% от пациентите след базиликсимаб, които не са отговорили на високи дози преднизолон. Участието на органи не предсказва отговор на GVHD към базиликсимаб, но броят на пациентите е твърде малък, за да се направят допълнителни заключения.
Хуманизирано IL-2-R α антитяло е изследвано от други. Общите отговори на острата GVHD се наблюдават съответно при 40%, 51% и 66%, а пълни отговори се наблюдават съответно при 20%, 37% и 8%. 14,20,21 За разлика от нашите собствени наблюдения, едно от тези проучвания съобщава за повишен процент на инфекциозни усложнения. 21 Досега не са провеждани сравнителни проучвания между базиликсимаб и хуманизирания антагонист на IL-2-R.
В сравнение с терапията с ATG при стероидно-резистентни GVHD, 22 странични ефекти на базиликсимаб са редки.
CsA, който инхибира транскрипцията на IL-2 чрез инхибиране на калциневрин, 23 и базиликсимаб, и двете възпрепятстват активирането на Т-клетките чрез различни механизми и следователно могат да имат адитивен ефект върху инхибирането на активирането на Т-клетките. Клиничните данни след бъбречна трансплантация показват излишък на отхвърляне на присадката при пациенти, лекувани с базиликсимаб, когато CsA липсва. Затова решихме да използваме базиликсимаб при резистентни към стероиди GVHD, само когато CsA е част от имуносупресивния режим.
В заключение, тази първа серия от пациенти показва, че базиликсимаб може безопасно да се дава на пациенти със стероидно-рефрактерни остри GVHD. Значителна част от нашите пациенти са отговорили на базиликсимаб, въпреки че базиликсимаб засяга само един път на активиране на имунната система. Предполагаме, че базиликсимаб трябва да се започне рано при тежка стероидно-рефрактерна остра GVHD, за да бъде от клинична полза. Контролът на острата GVHD също изглежда намалява честотата на хроничната GVHD при тези пациенти. С оглед на малкото съобщени пациенти, нашите данни изискват допълнително изследване на базиликсимаб при по-голям брой пациенти, за да се определи неговата позиция при лечението на стероидно-рефрактерни остри GVHD след алогенна SCT.
Препратки
Съливан КМ. Болест на присадка срещу гостоприемник. В: Thomas ED, Blume KG, Forman SJ (eds) Трансплантация на хематопоетични клетки, 2-ро издание Blackwell Science: Malden, MA 1999 515 536
Chao NJ, Schmidt GM, Niland JC и др. Циклоспорин, метотрексат и преднизон в сравнение с циклоспорин и преднизон за профилактика на остро заболяване присадка срещу гостоприемник New Engl J Med 1993 г. 329: 1225 1230
Ringden O. Намалени усложнения, свързани с трансплантацията и подобрена преживяемост без левкемия при възрастни, получаващи метотрексат, комбиниран с циклоспорин, в сравнение с който и да е от агентите за профилактика на заболяването присадка срещу гостоприемник Консултативен комитет на Международния регистър за трансплантация на костен мозък Трансплантация Proc 1993 г. 25: 1241 1242
Schwinghammer TL, Bloom EJ, Rosenfeld CS и др. Високи дози циклоспорин и кортикостероиди за профилактика на остра и хронична болест присадка срещу гостоприемник Трансплантация на костен мозък 1995 г. 16.: 147 154
Мартин PJ, Schoch G, Fisher L и др. Ретроспективен анализ на терапията за остра присадка срещу гостоприемник: първоначално лечение Кръв 1990 г. 76: 1464 1472
Леонард WJ, Depper JM, Uchiyama T и др. Моноклонално антитяло, което изглежда разпознава рецептора за човешки Т-клетъчен растежен фактор; частична характеристика на рецептора Природата 1982 г. 300: 267 269
Ringheim GE, Freimark BD, Robb RJ. Количествена характеристика на присъщия свързващ лиганд афинитет на бета веригата на интерлевкин 2 рецептора и неговата модулация от алфа веригата и втори модулиращ афинитета елемент Лимфокин цитокин Res 1991 г. 10: 219 224
Robb RJ, Greene WC, Rusk CM. Клетъчни рецептори с нисък и висок афинитет към интерлевкин 2. Последици за нивото на Tac антиген J Exp Med 1984 г. 160: 1126 1146
Ферара JL. Патогенеза на остро заболяване присадка срещу гостоприемник: цитокини и клетъчни ефектори J Hematother стволови клетки Res 2000 г. 9: 299 306
Nashan B, Moore R, Amlot P и др. Рандомизирано проучване на базиликсимаб срещу плацебо за контрол на острото клетъчно отхвърляне при реципиенти на бъбречен алографт. Международна изследователска група CHIB 201 Лансет 1997 г. 350: 1193 1198
Kahan BD, Rajagopalan PR, зала M. Намаляване на появата на остро клетъчно отхвърляне сред получатели на бъбречен алотрансплантат, лекувани с базиликсимаб, химерно анти-интерлевкин-2-рецепторно моноклонално антитяло. Група за изследване на бъбреците с базиликсимаб в САЩ Трансплантация 1999 г. 67: 276 284
Glucksberg H, Storb R, Fefer A и др. Клинични прояви на заболяване присадка срещу гостоприемник при хора, получаващи мозък от HLA-съвпадащи донори на братя и сестри Трансплантация 1974 г. 18.: 295 304
Шулман Х.М., Съливан К.М., Вайден PL и др. Хроничен синдром на присадка срещу гостоприемник при човек: клиникопатологично проучване на 20 дългосрочни пациенти в Сиатъл Am J Med 1980 г. 69: 204 217
Przepiorka D, Kernan NA, Ippoliti C и др. Daclizumab, хуманизирано антитяло срещу алфа-верига срещу интерлевкин-2 рецептор, за лечение на остро заболяване присадка срещу гостоприемник Кръв 2000 г. 95: 83 89
Ruutu T, Niederwieser D, Gratwohl A, Apperley JF. Изследване на профилактиката и лечението на остър GVHD в Европа: доклад на Европейската група за кръв и костен мозък, трансплантация (EBMT). Работна група по хронична левкемия на EBMT Трансплантация на костен мозък 1997 г. 19.: 759 764
Pasquini R, Moreira VA, Medeiros de CR и др. Базиликсимаб - селективен антагонист на интерлевкин-2 рецептора - като терапия за рефрактерна остра болест присадка срещу гостоприемник след трансплантация на костен мозък Кръв 2000 г. 96: 177a (Abstra. 762)
Ringden O, Labopin M, Gluckman E и др. Ефектът присадка срещу левкемия при реципиенти на алогенна трансплантация на костен мозък с остра левкемия се поддържа, използвайки циклоспорин А в комбинация с метотрексат като профилактика. Работна група по остра левкемия на Европейската група за трансплантация на кръв и мозък Трансплантация на костен мозък 1996 г. 18.: 921 929
Zaia JA. Цитомегаловирусни инфекции. В: Thomas ED, Blume KG, Forman SJ (eds) Трансплантация на хематопоетични клетки, 2-ро издание Blackwell Science: Malden, MA 1999 560 583
Коварик J, Wolf P, Cisterne JM и др. Разположение на базиликсимаб, моноклонално антитяло с рецептор на интерлевкин-2, при получатели на несъответстващи трупни бъбречни алографти Трансплантация 1997 г. 64: 1701 1705
Anasetti C, Hansen JA, Waldmann TA и др. Лечение на остро заболяване присадка срещу гостоприемник с хуманизиран анти-Tac: антитяло, което се свързва с рецептора на интерлевкин-2 Кръв 1994 г. 84: 1320 1327
Willenbacher W, Basara N, Blau IW и др. Лечение на стероидна рефрактерна остра и хронична болест присадка срещу гостоприемник с даклизумаб Br J Хематол 2001 г. 112: 820 823
Khoury H, Kashyap A, Adkins DR и др. Лечение на стероид-резистентна остра присадка срещу приемник с анти-тимоцитен глобулин Трансплантация на костен мозък 2001 г. 27: 1059 1064
Liu J, Farmer JD, Lane WS и др. Калциневринът е често срещана цел на комплекси циклофилин-циклоспорин А и FKBP-FK506 Клетка 1991 г. 66: 807 815
Информация за автора
Принадлежности
Отделение по хематология и онкология, Катедра по вътрешни болести, Университетска болница Charité, Campus Virchow-Klinikum, Университет Хумболт, Берлин, Германия
G Massenkeil, S Rackwitz, I Genvresse, O Rosen, B Dörken & R Arnold
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Лечение на остър и хроничен синузит NYC Mount Sinai - Ню Йорк
- Лечение на остра лимфобластна левкемия UCSF здраве
- Остър холецистит - Симптоми, диагностика и лечение BMJ Best Practice US
- Остър панкреатит по време на бременност Парадигма на лечението, базирана на нашия болничен опит Juneja SK,
- Ефективно лечение на орална млечница; Диетата на кандида