Сейджи Шиота
1 Катедра по екологична и превантивна медицина, Медицински факултет на университета Оита, град Юфу, Оита, Япония
Йошио Ямаока
1 Катедра по екологична и превантивна медицина, Медицински факултет на университета Оита, град Юфу, Оита, Япония
2 Катедра по медицина - гастроентерология, Медицински колеж Baylor & Медицински център по въпросите на ветераните на Майкъл Ийст Дебаки, бул. Holcombe 2002, Хюстън, Тексас 77030, САЩ
Резюме
Инфекцията с хеликобактер пилори е основна причина за рак на стомаха. Въпреки че идентифицирането на заразени с H. pylori субекти е първият подход за очертаване на високорисковата популация за рак на стомаха, наличието на антитела на H. pylori не е достатъчно за скрининг на рак на стомаха. Сред заразените с H. pylori субекти само малка част от заразените индивиди развиват рак на стомаха. Серологичните маркери на инфекцията с H. pylori могат да служат като потенциални предиктори за развитието на рак на стомаха. Съобщава се, че серумните или пикочните антитела на H. pylori, антителата, свързани с цитотоксин, ген А, пепсиногенът и микроРНК са свързани с предракови лезии или рак на стомаха. В този преглед обобщихме полезностите и ограниченията на всяка стратегия.
Ракът на стомаха е петата по честота рак и третата водеща причина за смъртност, свързана с рака в света (това е достъпно и в Международната агенция за изследване на рака; GLOBOCAN2012 [1]). Инфекцията с хеликобактер пилори е основната причина за хроничен гастрит, пептична язва и рак на стомаха [2]. Въпреки че приблизително половината от населението на света е заразено с тази бактерия, само малка част от заразените индивиди развиват рак на стомаха [3]. Една от възможните причини за различните резултати от инфекцията с H. pylori е свързана с разликите във вирулентността на щамовете на H. pylori в допълнение към факторите гостоприемник, околната среда и диетата. Идентифицирането на рискови маркери за класифициране на пациенти, заразени с H. pylori, във високо и нискорискови групи е изключително желателно за персонализирана превенция. По-специално, серологичните маркери на инфекция с H. pylori могат да служат като потенциални предиктори за развитието на рак на стомаха. В този преглед се фокусирахме върху серологичните и пикочните биомаркери на инфекция с H. pylori.
Анти-Н. pylori антитяло
В райони с ниско разпространение на инфекция с H. pylori, скринингът за заразени с H. pylori лица може да бъде достатъчен, за да стесни високорисковата популация за рак на стомаха. Въпреки това, в райони с преобладаване на инфекция с H. pylori, особено в страните от Източна Азия, само малка част от заразените с H. pylori лица развиват тежки гастродуоденални заболявания, включително рак на стомаха; следователно, наличието на антитела на H. pylori не е достатъчно за идентифициране на високорисковата популация за рак на стомаха. Необходими са допълнителни скринингови инструменти за идентифициране на високорисковата популация за рак на стомаха.
Проведено е мащабно кохортно проучване за изследване на връзката между титрите на антителата на H. pylori и рака на стомаха в Япония, при което честотата на рак на стомаха е висока (29,9 случая/100 000 годишно) [1,11]. Общо 36 745 субекта бяха включени в Проспективното проучване, базирано на Японския здравен център, и проследявани в продължение на 15 години. Сред серопозитивните субекти на H. pylori без атрофия на лигавицата, субектите с високи титри на антителата на H. pylori са били с най-висок риск от рак на стомаха. Въпреки това, сред серопозитивните субекти с атрофия на лигавицата, дефинирана на базата на нивата на пепсиноген (PG), тези с ниски титри на антитела срещу H. pylori са имали най-висок риск от рак на стомаха. Следователно, пациентите с ниски титри на антитела срещу H. pylori в допълнение към лигавичната атрофия се считат за изключително високорискова популация за рак на стомаха.
Антитела, свързани с цитотоксин на ген А
Най-добре проученият фактор на вирулентност на H. pylori е протеинът, свързан с цитотоксин ген A (CagA) [19]. Няколко доклада показват, че CagA-позитивните щамове са свързани значително с тежки клинични резултати, особено в западните страни [20–23]. Huang et al. изследва връзката между серопозитивността на CagA и рака на стомаха чрез извършване на мета-анализ [24]. Те откриха, че серумните CagA антитела са значително свързани с рак на стомаха, когато включват проучвания както от западни, така и от азиатски страни. В източноазиатските страни почти всички щамове на H. pylori притежават cagA и произвеждат CagA протеин; следователно е трудно да се илюстрира значението на CagA за рак на стомаха. Например, предишният ни доклад разкри, че 96,3% от японските щамове са cagA-положителни, независимо от клиничните резултати [25]. Подобни резултати са намерени в различни региони в Япония [26–28] и други страни от Източна Азия [29,30]. Субектите, заразени с CagA-позитивен H. pylori, не винаги произвеждат серумни CagA антитела, дори в източноазиатските страни. Нашето предишно проучване показа, че серумни CagA антитела са открити при 75,0% от японските пациенти [31]. Това предполага, че серумните CagA антитела вместо наличието на cagA могат да представляват подходящ биомаркер.
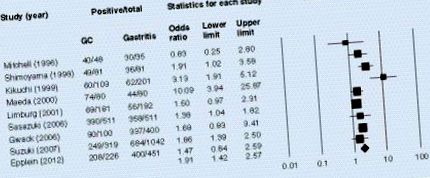
Наличието на антитела, свързани с гена А, свързани със серумен цитотоксин, е значително свързано с рак на стомаха в модел на случаен ефект при мета-анализ.
В предишното ни проучване изследвахме връзката между серумните титри на CagA антитела и хистологичните резултати в Япония [31]. Интересното е, че серумните титри на CagA антитела са в значителна корелация с възпаление на стомашната лигавица в корпуса. Това предполага, че както наличието на антитела, така и титрите на антителата са биомаркери за очертаване на високорисковата популация. Междувременно Suzuki et al. изследва риска от рак на стомаха според титрите на CagA антитела в Япония [36]. Те включват 299 пациенти с некардиен рак на стомаха и 1048 съвпадащи контроли. Сред H. pylori-серопозитивните субекти, тези с ниски титри на CagA антитела са имали по-голям риск за бъдещ некардиен рак на стомаха, отколкото тези със серумен CagA негативизъм или високи титри на CagA антитела. Тези данни предполагат, че в допълнение към серопозитивността трябва да се обърне внимание на титъра на антителата.
Наскоро Pan et al. изследва връзката между серопозитивността за CagA, VacA, GroEL, уреазна субединица A (UreA), γ-глутамил транспептидаза (gGT) и HcpC и развитието на стомашни лезии през периода на проследяване при пациенти с риск от предракови стомашни лезии при изходно ниво [47]. Наличието на антитела за всеки специфичен антиген беше изследвано чрез използване на системата за тест recomLine H. pylori, която е линеен имунен анализ. Серопревъзходствата на CagA, VacA, GroEL, UreA, HcpC и gGT са съответно 83,9, 38,9, 66,1, 17,8, 59,7 и 43,3%. Серопозитивността за CagA е независим предиктор за напреднали стомашни лезии. В допълнение, те установиха, че серопозитивността за CagA и GroEL са независими предиктори за прогресията на стомашните лезии в последващо проучване. Тези констатации могат да бъдат полезни за стратифициране на популацията, заразена с H. pylori, на популации с висок и нисък риск от рак на стомаха.
PG & ABC класификация
Рискът от рак на стомаха може да се класифицира по наличието на инфекция с H. pylori и състоянието на атрофия на стомашната лигавица [50]. По-специално, комбинацията от серология на H. pylori, нива на PG I и съотношение PG I/II може да се използва за скрининг на рак на стомаха, посочен като ABC метод в Япония [12,51]. При метода ABC субектите могат да бъдат класифицирани в четири групи въз основа на наличието на инфекция с H. pylori и PG, както следва: Група A (H. pylori отрицателна и PG отрицателна), Група B (H. pylori положителна и PG отрицателна ), Група С (H. pylori положителна и PG положителна) и Група D (H. pylori отрицателна и PG положителна) [12]. Група D обикновено се счита за група с най-висок риск за развитие на рак на стомаха, последвана от групи C, B и A [12].
Преди това разгледахме състоянието на класификацията ABC в Бутан, където честотата на рак на стомаха е висока [52]. Пропорциите на пациентите в групи В (53,8%) и С (17,3%) са по-високи при субекти от Бутан от тези, получени в Япония, където стойностите са съответно 16,3 и 9,3% [12]. Дори при по-младите субекти, делът на субектите от група С е приблизително 20% в Бутан, което е по-високо от това в Япония (≤5%) [53]. Това предполага, че високата честота на тежка стомашна атрофия в Бутан може да е допринесла за високата честота на рак на стомаха в Бутан.
Yanaoka et al. използва PG за изследване на превантивния ефект на ерадикационната терапия на H. pylori върху развитието на рак на стомаха в надлъжно кохортно проучване [54]. Общо 473 ликвидирани пациенти с H. pylori и 3656 лица с персистираща инфекция са били проследявани в продължение на приблизително 10 години. Субектите бяха разделени на три групи според наличието на хроничен атрофичен гастрит на базата на PG. В PG-отрицателната група с лек хроничен атрофичен гастрит честотата на рак на стомаха е била значително по-ниска в групата с ликвидирана H. pylori, отколкото в групата с нерадикирана. Напротив, не е открита разлика в честотата на рак на стомаха при PG-положителната група между ликвидираните H. pylori и нерадикираните пациенти. Това предполага, че ерадикационната терапия на H. pylori може да намали честотата на рак на стомаха при лица без тежък хроничен атрофичен гастрит. Това откритие също подкрепя, че PG може да бъде на разположение за идентифициране на субекти с висок риск от развитие на рак на стомаха.
Най-добрата гранична стойност на PG обаче може да варира в зависимост от фона на пациента [55]. В действителност индийските субекти показват по-ниски нива на PG от популациите от Китай и Малайзия, дори след корекция за пола и процента на инфекция с H. pylori [56]. Следователно, серумните нива на PG не могат да се използват за скрининг на рак на стомаха при индийското население [57]. Нивата на PG I и PG II могат да бъдат повлияни от други фактори, като възраст, пол, височина, телесно тегло, телесна повърхност, навици на тютюнопушене и пиене [48]. В китайската популация граничните стойности на PG I и съотношението PG I/II за откриване на атрофичен гастрит са съответно 82,3 ng/ml и 6,05, съответно [58]. Правилните гранични стойности на PG трябва да се определят във всяка популация [51,55].
Други фактори, свързани с рак на стомаха
Неинвазивни биомаркери трябва да се използват дори след ерадикационна терапия с H. pylori. Shiotani et al. изследва серумни нива на miRNA при пациенти с неотдавнашна история на ендоскопска резекция за ранен рак на стомаха и контролни субекти (H. pylori-позитивна стомашна язва или атрофичен гастрит) преди и след ерадикационна терапия на H. pylori в Япония [62]. Те откриха, че нивата на miR-106b и let-7 са значително по-високи при пациенти с рак на стомаха, отколкото при контролни субекти, независимо от историята на терапията за ерадикация. Обратно, нивата на miR-21 са по-високи при пациенти с рак на стомаха, отколкото при контролните субекти само след ерадикационна терапия. Тези открития предполагат, че нивата на miRNA могат да се променят след терапията за ерадикация на H. pylori. Освен това трябва да имаме предвид възможността най-подходящите биомаркери за откриване на индивиди с висок риск от рак на стомаха да се различават в зависимост от популациите.
Гликомиката може също да представлява чувствителен диагностичен инструмент за рак на стомаха. Ozcan et al. изследва нативни гликани чрез MS в серумите на пациенти с рак на стомаха и неатрофичен гастрит в Мексико [63]. В резултат на това 19 гликани са свързани с рак на стомаха. По-специално, нивата на три групи, включително гликани с висок манозен тип, гликани с 1 антена от сложен тип и бигалактозилирани биантанарни гликани, са по-ниски при пациенти с рак на стомаха, отколкото при тези с неатрофичен гастрит, докато нивата на негагалактозилирани двустранни гликани са по-високи при пациенти с рак на стомаха. Тези гликани може да са подходящи за откриване на рак на стомаха в ранен стадий.
Еднонуклеотидни полиморфизми, свързани с инфекция с H. pylori
Дори при наличие на високи нива на експозиция, приблизително 5–10% от населението никога не е заразено с H. pylori. Интересното е, че идентифицирането на генетични локуси, свързани със серологичния статус на H. pylori, е извършено в проучване за асоцииране в целия геном в Германия [64]. Общо 10 938 субекти бяха включени от две независими популационни кохорти. Серопозитивният процент е 56,3%. Локусът на Toll-подобен рецептор (TLR) на 4p14 и FCGR2A, кодиращ локуса на Fcγ рецептор 2a на 1q23.3, са свързани със серопозитивността на H. pylori. Всъщност високите фекални титри на H. pylori на антигена са свързани с високи нива на експресия на TLR1, което предполага, че TLR1 може да бъде причинително свързан с чувствителността на H. pylori. Тези открития могат да допринесат за скрининга на високорискови популации за инфекция с H. pylori.
Как можем да идентифицираме високорисковата популация за рак на стомаха?
Заключение
Инфекцията с хеликобактер пилори е основен рисков фактор за рак на стомаха. Следователно е важно да се идентифицират H. pylori-позитивните субекти като скринингова стратегия. Въпреки това, сред заразените с H. pylori субекти, само малка част от заразените индивиди развиват рак на стомаха. Комбинацията от серумни антитела срещу H. pylori и нива на PG може да бъде полезна за откриване на високорисковата популация за рак на стомаха сред инфектирани с H. pylori пациенти. В допълнение, други антитела срещу протеина на H. pylori могат да бъдат по-полезни за очертаване на високорисковата популация. Последните проучвания разкриха значителни разлики в серумните/плазмените нива на miRNAs между пациенти с рак на стомаха и контролни субекти. Обобщихме предимствата и недостатъците на тези тестове в таблица 1. Необходими са допълнителни проспективни кохортни проучвания, за да се изясни значението на тези тестове. Трябва обаче да помним, че неинвазивните биомаркери могат да се променят в зависимост от целевите популации и тестовите комплекти. В допълнение, проучвания с положителни резултати по отношение на биомаркерите могат да бъдат публикувани лесно в сравнение с тези с отрицателни резултати, особено ретроспективни проучвания (пристрастия на публикацията) [67]. Стандартизираните протоколи могат да подобрят надеждността на изследванията.
маса 1
Биомаркери за инфекция с Helicobacter pylori и гастродуоденални заболявания.
| Серумно антитяло срещу Helicobacter pylori | Лесен за използване за епидемиологични изследвания |
Бъдеща перспектива
Въпреки че ерадикационната терапия на H. pylori може да намали честотата на рак на стомаха, тя не може напълно да предотврати развитието на рак на стомаха, особено при пациенти с предракови лезии. По принцип се счита, че всички заразени с H. pylori индивиди имат висок риск от рак на стомаха. Всъщност японската здравноосигурителна система одобри терапия за ликвидиране на H. pylori за всички субекти с хроничен гастрит, свързан с H. pylori през 2013 г. Следователно е важно да се идентифицира високорисковата популация сред пациентите след терапия за ликвидиране на H. pylori. Неинвазивни тестове могат да се използват за много популации поради тяхното по-голямо удобство и лекота на използване. Оптималната гранична стойност на тестовия комплект трябва да се определя поотделно за всяка популация и държава. В допълнение, използването на местни щамове на H. pylori може да подобри точността на местните специфични тестови комплекти. Последните проучвания показват, че няколко miRNAs могат да бъдат биомаркери за рак на стомаха. Трябва обаче да разгледаме възможността за объркващи ефекти или взаимодействия за изясняване на независимите рискови фактори. Освен това са необходими проспективни проучвания, за да се изясни значението на miRNAs при откриване на ранен рак на стомаха.
Резюме
Серумно антитяло срещу Helicobacter pylori
Разпространението на антителата срещу Helicobacter pylori е значително по-високо при пациенти с рак на стомаха, отколкото при контролни субекти.
Пациенти с ниски титри на антитела срещу H. pylori и атрофия на лигавицата съставляват изключително високорискова популация за рак на стомаха.
Важно е титрите на антителата на H. pylori да варират значително в зависимост от използвания тест комплект. Поради това е за предпочитане да се разработи вътрешен ELISA комплект чрез използване на местни щамове на H. pylori.
Уринарни антитела срещу H. pylori
За откриване на инфекция с H. pylori са използвани два уринарни теста, метод на ензимен имуноанализ и имунохроматографски метод.
Точността на комплектите за изследване на урина може също да варира в зависимост от групата пациенти и страната. Ето защо е по-добре да се разработят тестови комплекти, като се използват местни щамове като източник на антиген, за да се получат най-добри резултати от теста.
CagA антитяло
Субектите, заразени с cagA-позитивен H. pylori, не винаги произвеждат серумни CagA антитела, дори в източноазиатските страни.
Серопозитивността на CagA е свързана значително с рак на стомаха, дори в страните от Източна Азия, при метаанализ.
Титрите на серумни CagA антитела могат да се различават в зависимост от използвания ELISA комплект.
PG & ABC класификация
Серумната PG е идентифицирана като маркер за състоянието на стомашната лигавица, включително атрофия и възпаление.
Комбинацията от серология на H. pylori и измервания на серумните нива на PG I и съотношението PG I/II може да се приложи за скрининг на рак на стомаха.
Други биомаркери
МиРНК на серум/плазма или гликани могат да служат като нови неинвазивни биомаркери за откриване на рак на стомаха при инфектирани с H. pylori пациенти.
Благодарности
Този доклад се основава на работа, подкрепена отчасти от безвъзмездни средства от NIH (DK62813; Y Yamaoka), Безвъзмездни средства за научни изследвания от Министерството на образованието, културата, спорта, науката и технологиите (MEXT) на Япония (22390085, 22659087, 24406015 и 24659200; Y Yamaoka; 23790798; S Shiota), стратегическа програма за млади изследователи отвъдморски посещения за ускоряване на мозъчната циркулация за Японско общество за насърчаване на науката (JSPS), стратегическите фондове за насърчаване на науката и технологиите от Японската наука и технологична агенция (JST).
Бележки под линия
Разкриване на финансови и конкурентни интереси
Авторите нямат други свързани или финансови ангажименти с която и да е организация или субект с финансов интерес или финансов конфликт с предмета или материалите, обсъдени в ръкописа, с изключение на тези, разкрити.
При изготвянето на този ръкопис не е използвана помощ при писането.
Препратки
Хартиите със специална бележка са подчертани като: • представляващи интерес;
- Бактериална вагиноза като смесена инфекция - полимикробни заболявания - NCBI рафт
- Амебиаза (инфекция с Entamoeba histolytica) Определение, симптоми, лечение
- Прогонване на инфекция на синусите Мизерия Andrew Weil, M
- 4 години хроничен гастрит - Търсене на помощ - Хеликобактер форуми
- Анемия при котки с хемотропна микоплазмена инфекция Ретроспективна оценка на 23 случая (1996–2005)