Лиис Сабле
1 Катедра по неврология и неврохирургия, Университет в Тарту, Тарту, Естония
2 Катедра по неврология, клинична неврофизиология, Университет Упсала, Упсала, Швеция
Танел Пунга
3 Катедра по медицинска биохимия и микробиология, Университет Упсала, Упсала, Швеция
Анна Ростед Пунга
2 Катедра по неврология, клинична неврофизиология, Университет Упсала, Упсала, Швеция
Резюме
Въведение
Миастения гравис (MG) е хронично автоимунно невромускулно разстройство с разпространение приблизително 40-180 на милион (1, 2). Антителата в MG са насочени срещу антигени на нервно-мускулната връзка; при по-голямата част от пациентите, към никотиновия ацетилхолинов рецептор (AChR) в ~ 85% и към мускулно специфичната тирозин киназа (MuSK) при ~ 7% от пациентите. Съвсем наскоро откритите цели за антитела включват протеин 4, свързан с липопротеинови рецептори с ниска плътност (Lrp4) (3, 4) в ~ 18% от AChR/MuSK антитела-серонегативни пациенти (5) и агрин предимно при пациенти с MuSK, AChR, или Lrp4 антитела (6, 7). Пациентите с MG страдат от променлива умора и слабост на скелетните мускули. Етиологията на заболяването е неизвестна, въпреки че се смята, че тимусът играе централна роля в болестния процес, тъй като е от съществено значение за диференциацията на Т-клетките и установяването на централна толерантност (8, 9). Валидните диагностични мерки за MG включват анализ на антитела, електрофизиологични мерки за нарушено нервно-мускулно предаване и обективна клинична оценка на умората на скелетната мускулатура, като количествен резултат на MG (QMG) или MG композитен (MGC) резултат.
Според Администрацията по храните и лекарствата (FDA) и Работната група по биомаркери на Националния институт по здравеопазване (NIH) биомаркерът се определя като лесно измерим индикатор за нормален или ненормален физиологичен процес или отговор на интервенция (14). В идеалния случай валиден биомаркер в MG трябва лесно да диференцира пациентите с MG от здрави индивиди и също така да може да диференцира MG подгрупи, включително EOMG срещу LOMG, AChR + срещу MuSK + MG, асоцииран с тимома MG, както и OMG срещу GMG.
Вътреклетъчни Micrornas
Извънклетъчни циркулиращи MiRNAs
Характеристики на циркулиращите miRNAs
В допълнение към тяхното вътреклетъчно натрупване, зрелите miRNAs се откриват и извън клетките, в извънклетъчното пространство. Тези miRNAs, така наречените циркулиращи miRNAs, могат да бъдат намерени в човешките телесни течности, включително кръвна плазма и серум, урина, слюнка, сперма, сълзи, кърма, околоплодна течност, цереброспинална течност и перитонеални и плеврални течности (27–31) . Съставът и концентрацията на циркулиращите miRNAs варират в различните телесни течности, като някои специфични miRNA видове доминират в специфични биофлуиди (32).
Циркулиращите miRNAs като потенциални биомаркери
Извънклетъчни циркулиращи MiRNAs като потенциални биомаркери в MG подгрупи
Ацетилхолинов рецептор Антитяло-серопозитивно MG с ранно начало
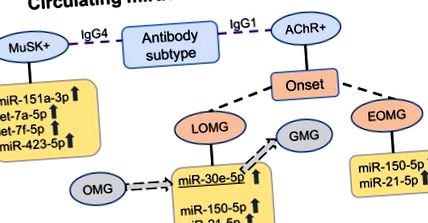
Урегулирани циркулиращи miRNAs в серума на пациенти с миастения гравис (MG) според подтип на антитела. При пациенти със серопозитивни антитела срещу ацетилхолинови рецептори (AChR +) с ранно начало MG (EOMG), имуно-miRs miR-150-5p и miR-21-5p са повишени; при пациенти с MG (LOMG) с късно начало, miR-30e-5p е допълнително повишен. miR-30e-5p също е потенциален предиктор за прогресия от очен към генерализиран MG. При мускулно специфични тирозин киназни антитела-серопозитивни (MuSK +) пациенти с MG с IgG4 антитела, друг надрегулиран циркулиращ miRNA профил, miR-151a-3p, let-7a-5p, let-7f-5p и miR-423-5p, е намерен. OMG очен MG, GMG генерализиран MG, IgG1 имуноглобулин G подклас 1, IgG4 имуноглобулин G подклас 4.
Гореспоменатите циркулиращи miRNAs не са единствените съобщени промени в биофлуидите на пациенти с AChR + MG. Друго профилиране на циркулиращи miRNAs в различни AChR + MG пациентски серуми (EOMG, LOMG и TAMG) серуми разкри, че поне седем miRNAs са били понижени (miR-15b, miR-122, miR-140-3p, miR-185, miR-192, miR-20b и miR-885-5p) в сравнение със здрави контроли (54). Независимо от това, не са открити разлики в този профил на miRNAs между лекувани и нелекувани пациенти с MG (54).
Късно начало MG
Очен MG
Мускулно специфични тирозин киназни антитела-серопозитивни MG
MuSK + MG се счита за по-хомогенен подтип на заболяването, който се различава от AChR + MG по патогенеза, клинична картина, неврофизиологични прояви и отговор на лечение (65). Следователно не е изненадващо, че MuSK + MG и AChR + MG са свързани с различни циркулиращи miRNA профили. Повишените miRNAs в серуми от пациенти с MuSK + MG вместо това включват miR-151a-3p, let-7a-5p, let-7f-5p и miR-423-5p (66; Фигура 1). Натрупването на гореспоменатите miR-150-5p или miR-21-5p, които са нерегулирани в различни подтипове AChR + MG, не се различава между пациентите с MuSK + MG и здравите контроли.
Тъй като по-голямата част от кръвните проби се съхраняват като серум, повечето проучвания анализират циркулиращите miRNAs в серума. Серумът и плазмата съдържат miRNAs; обаче техните концентрации не могат автоматично да се приемат за взаимозаменяеми (67). Наскоро профилът на miRNA беше анализиран и в плазмата на пациенти с MuSK + MG (68). От 179 различни miRNAs, само две са били ясно различни при пациенти с MuSK + MG; miR-210-3p и miR-324-3p бяха понижени в MuSK + MG плазма в сравнение със здрави контроли (68). Нито една от тези miRNAs не е била докладвана по-рано за регулиране при имунни заболявания; обаче, miR-210-3p е установено, че не е регулиран при няколко ракови заболявания (69), а miR-324-3p е споменат като потенциален биомаркер при диагностицирането на остеопороза (70).
Връзка между повишени циркулиращи miRNAs в MG и патофизиология на заболяванията
Както miR-150-5p, така и miR-21-5p са така наречените имуно-miRs и се считат за важни регулатори на Т-клетките (71). В AChR + EOMG ефекторният орган е тимусът, който често се характеризира с хиперплазия, както и извънматочни зародишни центрове, състоящи се от инфилтриращи В клетки (9, 72). miR-150 регулира пролиферацията, апоптозата и диференциацията на естествените убийци (NK), Т и В клетките (71, 73, 74) и е маркер за активиране на лимфоцитите (75). Освен че са повишени в серума на пациентите с EOMG, по-високи нива на miR-150 се откриват и при други автоимунни състояния, включително множествена склероза (MS) (76), HIV-1 инфекция (77) и някои видове рак (78).
Неотдавнашно проучване показа, че експресията на miR-150 е много по-висока в тимуса на пациенти с AChR + EOMG в сравнение със здравите контроли, по-специално в мантийната зона на зародишните центрове, съдържащи В клетки, макар и да не е пряко свързана със степента на хиперплазия на тимуса (79) . В мононуклеарните клетки на периферната кръв (PBMCs), miR-150 също беше понижен в CD4 + Т клетките на пациентите с EOMG в сравнение със здравите контроли. Резултатите от това проучване показват, че повишените серумни нива на miR-150-5p, които също са били открити в това проучване, са резултат от освободеното miR-150 от активирани периферни CD4 + Т клетки (79). Освен това, miR-150 лечението на PBMC засяга основния протоонкоген MYB и по този начин miR-150 може да играе роля в EOMG както на тимусното ниво, така и в периферията, като модулира експресията на целевите гени и оцеляването на периферните клетки (79 ). Една от хипотезите е, че miR-150 може да се регулира чрез освобождаването му в извънклетъчното пространство (80). Подобно на наблюденията в MG, други проучвания показват намален miR-150-5p в PBMC от пациенти със синдром на Sjogren, докато нивата все още са повишени в серума и слюнчените жлези (81, 82), по аналогия с miR-150-5p в PBMCs спрямо тимуса при MG.
Друг имуно-miR, miR-21-5p се експресира при по-високи нива в регулаторните Т клетки (Tregs) (71) и е свързан с други автоимунни заболявания като системен лупус еритематозус (SLE) и ревматоиден артрит (24, 83). Подобно на miR-150, miR-21 също играе важна роля за Т-клетките (84, 85), с по-високи нива на miR-21, изразени в Tregs.
Третата miRNA в AChR + MG, miR-30e-5p, беше донякъде противоречиво понижена в EOMG (48) и надрегулирана в LOMG (56). miR-30e-5p също е свързан със SLE (86). Интригуващо е, че протеин 6, свързан с липопротеинови рецептори с ниска плътност (LRP6), един от критичните ко-рецептори за Wnts (семейство гени, кодиращи секреторни гликопротеини), е пряка цел на miR-30e (87) и по този начин има потенциална роля на miR-30e в регулирането на мускулната хомеостаза.
Членовете на семейството let-7 miRNA са широко проучени поради широката им функционална роля в различни клетъчни процеси, включително развитие на невроните и ембриогенеза (88, 89). Подобно на пациентите с MuSK + MG, натрупването на циркулиращ серумен let-7a се наблюдава при пациенти с вторично прогресираща МС (76). Интригуващо, let-7 miRNAs стимулират Toll-подобен рецептор 7 (TLR7) и по този начин активират Т клетки (90). В допълнение, ангажирането на TLR7 в CD4 + Т клетки предизвиква неповлияване на Т клетки (91). Интересното е, че поне две от идентифицираните miRNAs, let-7a-5p и let-7f-5p, също се регулират в PBMCs, изолирани от пациенти с TAMG (92), докато let-7f-5p вместо това се регулира надолу в тимуса на AChR + EOMG пациенти (93).
Към момента липсват проучвания за циркулиращи miRNAs в Lrp4 и агрин антитяло-серопозитивни MG. В тези MG подтипове антителата като такива са предложени като биомаркери за заболяване (94). Освен това, като се има предвид важната роля на сигнализирането на agrin/Lrp4/MuSK за поддържането на нервно-мускулната връзка, е необходимо по-задълбочено разбиране на тези серологични подтипове (94).
Вътреклетъчни MiRNAs в MG
Първото проучване, което анализира miRNAs в тимусните клетки, изследва TAMG и установява, че miR-125a-5p, който има важна роля в рака и имунните процеси, е значително регулиран (92). При пациенти с EOMG при жени, анализът на експресията на miRNA на тимуса разкрива, че най-регулираните miRNAs са miR-20b-3p, miR-892-3p и miR-7-5p (93). Най-регулираните miRNAs бяха miR-486-5p и miR-125-5p, докато miR-7-5p беше по-ниско регулиран в тимусите на пациенти с MG, които имаха тимусна хиперплазия с висока степен. В проучването MGTX (50) тимусите от нетимоматозни пациенти с MG са използвани за анализ на експресия на miRNA и mRNA (102). При сравняване на положителни проби от зародишен център (GC) с GC-отрицателни, 38 miRNAs, участващи в имунния отговор, показват разлики в експресията (102). Регулаторът на сигнализирането на G-протеин 13 (RGS13) се експресира в GC В клетки и тимусните епителни клетки. Следователно, прогнозираните регулатори на RGS13, miR-139-5p и miR-452-5p, бяха допълнително анализирани и установено, че са регулирани надолу (102).
Заключителни бележки
Принос на автора
Всички автори допринесоха за изготвянето и преразглеждането на ръкописа и прочетоха и одобриха изпратената версия.
Конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
Благодарности
Благодарни сме на д-р Лора О’Конър за корекцията и на всички наши международни сътрудници, по-специално д-р. Le Panse и Berrih-Aknin, д-р Камински и изследователската група MGTX, д-р Evoli, д-р. Мадисън и Уонг. Също така бихме искали да благодарим на всички пациенти, които са допринесли със своите кръвни проби за анализ на miRNA.
Финансиране. Изследването е подкрепено от Шведския изследователски съвет (грант № 2016-02184 за AP и TP, грант № 2014-02048 и 2014-07603 за AP) и Фондация за медицински изследвания Göran Gustafsson (за AP).
- Хранително отравяне при деца 6 съвета за предотвратяване на хранително отравяне Мичиганска медицина
- Хранително отравяне Vibrio Vulnificus Мичиган Медицина
- Оценка на кефира като потенциален пробиотик върху ефективността на растежа, серумната биохимия и имунната система
- ОЦЕНКА НА ПОТЕНЦИАЛНИТЕ ПОЛЗИ ОТ КРАСТВАЦИТЕ ЗА ПОДОБРЕНО ЗДРАВЕ И ГРИЖА ЗА КОЖАТА • JARLIFE
- Запек, възраст 12 години и по-стари CS Mott Детска болница Мичиган Медицина