Катедра по медицина, Медицински колеж „Алберт Айнщайн“, Бронкс, Ню Йорк
Адрес за заявки за повторно отпечатване и друга кореспонденция: М. Кашер-Мерон, здравни услуги на Клалит, област Шарон Шомрон, ул. Ха-Мелаха 39, Нетания, Израел (имейл: [имейл защитен]).
Катедра по фармакология, Медицински колеж Алберт Айнщайн, Бронкс, Ню Йорк
Катедра по фармакология, Медицински колеж Алберт Айнщайн, Бронкс, Ню Йорк
Катедра по медицина, Медицински колеж „Алберт Айнщайн“, Бронкс, Ню Йорк
Катедра по фармакология, Медицински колеж Алберт Айнщайн, Бронкс, Ню Йорк
Резюме
Както е определено от Световната федерация по затлъстяването (5), затлъстяването е хронично рецидивиращо медицинско състояние. Рандомизираните контролни проучвания за намеса в начина на живот за отслабване съобщават, че 50–80% от загубата на тегло се възстановява при дългосрочно проследяване, като по-голямата част от теглото се възстановява през първите 2 години след интервенционната програма и постига плато в рамките на 4 до 6 години (8, 21а). Съобщава се за успешна дългосрочна загуба на тегло при пациенти, придържащи се към нискокалоричен прием и интензивна физическа активност (16). Следователно се предполага, че слаб субект с предишна памет за затлъстяване (OM) не е метаболитно идентичен на слаб връстник с слаба памет (LM), който никога не е бил със затлъстяване.
Мащабът и разпространението на възвръщаемостта на теглото, наблюдавани както при хора, така и при модели на гризачи, посочват наличието на ефективни физиологични механизми, противопоставящи се на промените в телесната маса. Проучванията при хора и гризачи предполагат поглед върху тези механизми, показващи дългосрочно намаляване на енергийните разходи (ЕЕ), което надвишава прогнозираните промени в чистата телесна маса, мастната маса и възрастта (10, 14, 20, 21). Промените в използването на гориво от периферните тъкани и адипоцитната хиперплазия благоприятстват разширяването на мастната тъкан и увеличаването на теглото (14, 23). Тези мощни механизми, които често се наричат „механизми за задаване на теглото“, изглежда се нулират по време на затлъстяването. При загуба на тегло те активират хипотетичен цикъл на компенсаторен отговор, който включва сигнални молекули от периферията до централната нервна система, отразяващи енергийната наличност и резерви и активиране на невронни мрежи, които модулират апетита, психомоторната активност и метаболитната ефективност, за да се противопоставят на промените в телесната маса.
Патофизиологичните механизми, които са в основата на ОМ и процеса на възстановяване на теглото, не са добре разбрани. По-рано беше показано, че затлъстяването е свързано с липолитичен дефект и устойчивост на катехоламини, описани при хора и мишки при различни модели на затлъстяване (4, 13, 19, 24, 30). Този липолитичен дефект в мастната тъкан може потенциално да ограничи способността за отслабване и да насърчи по-нататъшното възстановяване на теглото. В това проучване ние предположихме, че липолитичният дефект, индуциран от диета, индуцирано затлъстяване (DIO), продължава след загуба на тегло и насърчава възстановяването на теглото. Възползвахме се от животински модел на DIO. DIO мишките бяха подложени на ограничаване на калориите и след това отново подложени на диета с високо съдържание на мазнини (HFD), за да дисектират автономната роля на мастната тъкан за насърчаване на възстановяването на теглото при слаби мишки с ОМ.
Животински модел.
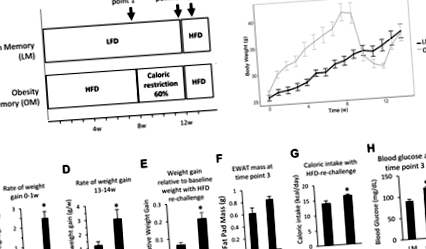
Мъжки мишки от див тип C57BL6/J са били хранени с комерсиална чау до 8-седмична възраст, след това са били поставяни на 60% HFD (D12492, Research Diets, Brunswick, NJ) или 10% диета за контрол на мазнините (D12450J, Research Diets, Brunswick NJ). Храната и водата бяха разрешени ad libitum за 8 седмици. След това мишките, които преди това са били хранени с HFD, се поставят на диета за ограничаване на калориите в продължение на 4 седмици, както е описано по-долу. След това групи от мишки бяха поставени върху HFD ad libitum. Животните бяха настанени на групи от 3-4. Клетките се поддържат при постоянна стайна температура (23 ° C) и 12-часов цикъл светлина-тъмнина (светлина в 7 AM). Всички мишки се претеглят седмично. Мазнините и слабата телесна маса се измерват с помощта на количествена магнитна резонансна система на цялото тяло в посочените моменти от време (Фиг. 1A). Мишките бяха евтаназирани и епидидималната мастна тъкан беше събрана в посочените часови точки (Фиг. 1A). Протоколът беше одобрен от Институционалния комитет за грижи и употреба на животните и всички животни бяха поддържани в съответствие с насоките в Ръководството за грижа и употреба на лабораторни животни.
Калорично ограничение.
Мишките, които са били назначени за ограничаване на калориите, са били хранени с 60% от калорийния прием, записан за мишки от контролната група, които са били хранени с ниско съдържание на мазнини по желание. За да се измери калоричният прием в контролната група, количеството храна се отстранява от бункера на клетката и разливът (пелетите на дъното на клетката) се претегля ежедневно в продължение на 3 последователни дни. Храна беше поставена
1 час преди началото на тъмната фаза на 12-часов цикъл светлина-тъмнина. Хранителното поведение на мишките се наблюдава ежедневно, когато им се дава разпределение на храната. В бункера имаше достатъчно място за всички мишки, за да имат едновременен достъп до храна и нямаше доказателства, че мишките пречат на хранителното поведение на другите.
Глюкоза на гладно.
Мишките бяха на гладно в продължение на 14 часа. Взети са кръвни проби от върха на опашката, докато животното е било будно и невъздържано, и веднага са изследвани с помощта на глюкометър Freestyle Optium.
Тест за липолиза за освобождаване на свободни мастни киселини ex vivo в бяла мастна тъкан.
Животните бяха евтаназирани след гладуване през нощта в продължение на 14–16 часа. Перигонадната мастна тъкан е събрана и нарязана на парчета от 15–30 mg. Мастната тъкан беше предварително инкубирана в продължение на 1 час с модифицирана среда на Eagle’s Dulbecco с ниско ниво на глюкоза (Thermo Fischer Scientific) плюс 1% говежди албумин, без мастни киселини (Sigma), като неестерифицирана свободна мастна киселина (NEFA) (25). След това мастната тъкан се третира с норепинефрин (329-56-6, Sigma) при посочените концентрации за 1 h. Средата беше аспирирана и замразена при -80 ° C за по-нататъшен анализ. Концентрацията на NEFA в средата беше анализирана с помощта на комплект за диагностика Wako [HR Series NEFA-HR (2), Fujifilm Wako Diagnostics, Mountain View, CA] и нормализирана до експлантационна маса на мастната тъкан.
Непряка калориметрия.
Количествена верижна реакция на полимераза в реално време.
Клетъчната тотална РНК се екстрахира от цяла мастна тъкан с помощта на QIAzol Lysis Reagent и RNeasy Mini Kit (74104, Qiagen) и се подлага на DNase смилане по време на пречистването на РНК (79254, Qiagen). СДНК от първа верига е синтезирана с помощта на SuperScript VILO cDNA Synthesis Kit (11754050, Invitrogen). Нива на генна експресия на Adrb1, Adrb2, Adrb3, Adra2a, Il1b, il6, il10, ccl2, ccl5, emr1, и arg-1 бяха определени с помощта на сонди TaqMan (Mm00431701_s1, Mm02524224_s1, Mm02601819_g1, Mm00845383_s1, Mm00434228_m1, Mm00446190_m1, Mm01288386_m1, Mm00441242_m1, M1, M1, M1 Стойностите се отчитат съгласно метода на стандартната крива, като се използва RPL30 като референтен ген.
Western blot анализ.
Анализ на данни и статистика.
Данните са представени като средна стойност ± SE. Статистическите сравнения на калориметричните данни бяха изчислени с помощта на двупосочен ANOVA, последван от честно значимия тест за разлика на Tukey за множество двойни сравнения между средните стойности. Сравненията между две групи бяха изчислени с помощта на двустранен студент т тест. P стойности
Фиг. 2.Данни за непряка калориметрия. Разходът на енергия (EE) и съотношението на дихателния обмен (RER) спрямо времето и таблица, показваща средните стойности в стабилно състояние по време на гладуване, хранене и над 24 часа при времева точка 1 (н = 3-4) (A-° С); времева точка 2 (н = 3-4) (д-F); и времева точка 3 (н = 3–4) (G-Аз), както е дефинирано в текста и фиг. 1A, са показани. Проучванията бяха проведени в продължение на 3 последователни дни. Мишките имаха достъп до храна през нощта. Разликите в средните EE и RER по време на стабилно състояние на гладно и хранене бяха оценени чрез двупосочна ANOVA с post hoc корекция на Tukey за множество сравнения. Данните за EE и RER са представени като средни стойности ± SE; н = брой мишки. LM, постна памет; ОМ, памет за затлъстяване.
Фиг. 3.Функционална липолиза на мастната тъкан ex vivo. Епидидимална бяла мастна тъкан се събира след бърза нощ. Експлантите на мастната тъкан се инкубират с посочената концентрация на норепинефрин (NE). Концентрациите на нестерифицирани свободни мастни киселини (NEFA) бяха измерени в средата след 1 h инкубация и стандартизирани според масата на тъканната проба. Липолитичният отговор беше изследван при времева точка 1 (н = 4) (A), времева точка 2 (н = 3) (Б.), и времева точка 3 (° С) след като на мишките беше предложена диета с високо съдържание на мазнини ad libitum за 5 дни (н = 8–9). Точките за данни представляват средно за всяка група мишки спрямо измерването на изходното ниво в контролната група, чиста памет (LM). Въз основа на тези точки от данни е монтиран линеен модел на реакция на дозата. Разликата между измерванията на NEFA при всяка NE доза беше анализирана с помощта на Student’s т-тест. Данните са представени като средни стойности ± SE; н = брой мишки. *P стойност
Фиг. 4.Индуцирано от катехоламин хормонално-чувствителна липаза (HSL) фосфорилиране. Епидидимална бяла мастна тъкан е събрана от мишки с чиста памет (LM) или памет с наднормено тегло (OM), след като са били преосмислени с диета с високо съдържание на мазнини в продължение на 5 дни, времева точка 3. A: Western blot анализ на фосфорилиране на HSL върху специфични серинови остатъци в експланти на епидидимална мастна тъкан след 15 минути инкубация с или без норепинефрин (NE) 0,5 uM (н = 3). Б.: денситометрично количествено определяне на посочените протеини и фосфо-протеин. Данни, изразени като средна стойност ± SE; н = брой мишки. *P стойност
След това оценихме дали липолитичният дефект в епидидималната мастна тъкан на мишки с ОМ може да бъде свързан с повишено възпаление. За тази цел анализирахме генната експресия на възпалителни цитокини в епидидималната мастна тъкан. В времева точка 1, мишки след 8 седмици HFD показват умерено повишаване на експресията на нивата на няколко възпалителни гена в сравнение с контролните мишки. Налице е увеличение на генната експресия на Ccl2, с очевидно увеличение в Ил-1б, Tnf, и Emr1 които не достигат статистическа значимост (Фиг. 5A). В времева точка 2, след 4 седмици калорично ограничение и загуба на излишното си тегло, OM мишките са имали по-ниско ниво Ccl2, Арг, и Emr1 генна експресия в мастната тъкан в сравнение с контролните мишки LM, с очевидно намаляване на Икке, IL1b, и IL10; това обаче не достига статистическа значимост (Фиг. 5Б.). При повторно излагане на HFD, мишки с предходен ОМ показаха по-силен рецидив на модела на експресия на възпалителния ген рано в рамките на 5 дни след повторното предизвикване на HFD, с повишени нива на Ccl2, Икке, Il10, Tnf, и Emr1, в сравнение с контролните мишки, на които за първи път се предлага HFD (Фиг. 5° С).
Фиг. 5.Възпалителна генна експресия в епидидимална мастна тъкан. Полимеразна верижна реакция в реално време за възпалителни гени, изразени в епидидимална бяла мастна тъкан. Измерванията се изразяват спрямо контролната група. A: мишките са хранени или с диета с ниско съдържание на мазнини (LFD), или с диета с високо съдържание на мазнини (HFD) в продължение на 8 седмици (н = 3-4). Б.: мишките бяха хранени с HFD за 8 седмици и след това бяха подложени на 60% ограничаване на калориите с LFD за още 4 седмици, за да се постигне постно телесно тегло. Контролната група получи LFD ad libitum за 12 седмици (н = 2). ° С: на мишки със или без памет за затлъстяване (OM) се предлага HFD ad libitum за 5 дни (н = 3-4). Независим студент т-беше проведен тест за сравняване на средствата за всяка специфична генна експресия. Данните са представени като средни стойности ± SE; н = брой мишки. *P стойност
За да преценим дали свързаният с ОМ липолитичен дефект е свързан с променена експресия на адренергични рецептори в адипоцитите, проверихме нивата на генна експресия на Adrb1, Adrb2, Adra2a, и Adrb3 в мастната тъкан. Мишки след 8 седмици HFD, при времева точка 1, имал
50% намаляване на нивата на експресия на ген на адренергичен рецептор в сравнение с контролната група (Фиг. 6A). В времева точка 2, след 4 седмици калорично ограничение, мишките с ОМ са имали драстично увеличение на нивата на иРНК на адренергичния рецептор, с четири до петкратно увеличение на Adrb1 и Adrb3 генна експресия в сравнение с контролната група (Фиг. 6Б.). При повторно излагане на HFD, мишки с предходен ОМ показват по-голямо намаляване на експресията на адренергични рецепторни гени в сравнение с контролните мишки, на които за първи път се предлага HFD. Интересно, Adrb3 беше генът, най-засегнат от повторното предизвикателство на HFD, с
75% намаление на неговата експресия в сравнение с контролната група (Фиг. 6° С). Експресия на термогенни гени при времеви точки 1–3 е анализиран, без ясен модел (данните не са показани).
Фиг. 6.Експресия на ген на адренергичен рецептор в епидидимална мастна тъкан. Полимеразна верижна реакция в реално време. Измерванията се изразяват спрямо контролната група. A: мишките са хранени или с диета с ниско съдържание на мазнини (LFD), или с диета с високо съдържание на мазнини (HFD) в продължение на 8 седмици (н = 3-4). Б.: мишките бяха хранени с HFD за 8 седмици и след това бяха подложени на 60% ограничаване на калориите с LFD за още 4 седмици, за да се постигне постно телесно тегло. Контролната група получи LFD ad libitum за 12 седмици (н = 2). ° С: на мишки със или без памет за затлъстяване (OM) се предлага HFD ad libitum за 5 дни (н = 3-4). Независим студент т-беше проведен тест за сравняване на средствата за всяка специфична генна експресия. Данните са представени като средни стойности ± SE; н = брой мишки. *P стойност
В обобщение, данните, представени в това проучване, предлагат нова представа за механизмите на възстановяване на теглото след отслабване и предизвикателството за поддържане на загуба на тегло. Той посочва ендогенен дефект на липолиза в бялата мастна тъкан с ОМ, с повишена резистентност към катехоламин и проинфламаторна генна експресия рано при повторно захранване с HFD. Бялата мастна тъкан на слаби мишки с ОМ показва повишена сенсибилизация към HFD, което може да играе роля в бързото възстановяване на теглото, наблюдавано след загуба на тегло.
Тази работа е финансирана от Националните здравни институти за безвъзмездна помощ DK-033823 и DK-020541 (на J. E. Pessin).
Не се декларират конфликти на интереси, финансови или други, от авторите.
- JCI - Отслабването и липолизата насърчават динамичен имунен отговор в мишката мастна тъкан
- Типът мускулни влакна се свързва със затлъстяването и загубата на тегло
- Индуцирано от лекарства наддаване на тегло и дислипидемия при пациенти с шизофрения Американски вестник на
- Опитах да пия кубчета Oxo, за да отслабна Диетични добавки Великобритания Здравословно хранене за продажба - ARK JOURNAL
- Lipo Lab Инжекция за отслабване Ppc разтвор Корея липолиза - Китай Lipolab фосфатидилхолин