Деван Джаганат
1 Медицински факултет на Дейвид Гефен в Калифорнийския университет, Лос Анджелис
3 Изследователско звено за туберкулоза (TBRU), Университет Case Western Reserve, Кливланд, Охайо
Езекиел Мупере
2 Университет Макерере, Кампала, Уганда
3 Изследователско звено за туберкулоза (TBRU), Университет Case Western Reserve, Кливланд, Охайо
Резюме
Въпреки тежестта както на недохранването, така и на туберкулозата при децата по света, има малко проучвания относно механизмите, които стоят в основата на тази връзка. От наличните изследвания става ясно, че недохранването е предиктор за туберкулозна болест и е свързано с по-лоши резултати. Това се подкрепя от няколко редови доказателства, включително ролята на генотипите на рецепторите за витамин D, ефектите на недохранване върху имунното развитие, респираторни инфекции сред недохранени деца и ограничена работа, специално по отношение на детската туберкулоза и недохранването. Хранителните добавки все още не предполагат значителни ползи за хода на туберкулозата при деца. Съществува критична необходимост от изследване на детската туберкулоза, по-специално как хранителният статус влияе върху риска и прогресията на туберкулозата и дали хранителните добавки подобряват клиничните резултати или предотвратяват заболяването.
Туберкулозата остава важен източник на заболеваемост и смъртност сред децата в условия с ограничени ресурси. От 9 милиона нови туберкулозни инфекции всяка година 11% са при деца [1]. Недохранването също е широко разпространено при деца, живеещи в ендемични страни на туберкулозата и допринася за 2,2 милиона смъртни случая при деца под 5-годишна възраст в световен мащаб [2]. Бедността, пренаселеността, несигурността на храните и вирусът на човешкия имунен дефицит (ХИВ) допълнително поставят началото както за недохранване, така и за лош контрол на инфекциите.
МЕТОДИ
Препратките бяха идентифицирани чрез търсения в PubMed, Cochrane, Web of Knowledge и Google Scholar. Критерии за включване бяха статии на английски език, свързани с рискови фактори, етиология и управление на туберкулозата във връзка с хранителния статус. Търсенията в PubMed включват термините „туберкулоза“, „недохранване [MeSH]“, „хранителен статус [MeSH]“, „инфекция“, „белодробна инфекция“, „инфекции на дихателните пътища [MeSH],„ мляко, човек/имунология “. и „микроелементи“. Търсенията бяха завършени с и без ограничения „Всички бебета: раждане – 23 месеца, всички деца: 0–18 години.“ Базата данни на Cochrane беше търсена с термините „недохранване“ и „туберкулоза“. Условията за търсене в мрежата от знания включват „недохранване“ и „туберкулоза“ и бяха ограничени до педиатрията. И накрая, търсенията в Google Scholar включват „деца с недохранване от туберкулоза“, „туберкулоза с дефицит на микроелементи“, „деца с недохранване при респираторни инфекции“ и „микроелементи от туберкулоза.“ Статии, свързани с темата, бяха прегледани и включени в нашата дискусия, както и значителни статии, цитирани от тези документи.
Генетика на недохранването и туберкулозата
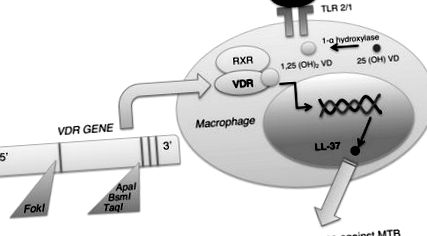
Роля на генетиката в чувствителността към туберкулоза. Витамин D рецепторът (VDR) има неразделна роля в имунния отговор на туберкулозата чрез свързването му с витамин D, за да индуцира антимикробна функция чрез LL-37. Няколко полиморфизми в гена VDR също са замесени в чувствителността към туберкулоза. Съкращения: MTB, Mycobacterium tuberculosis; RXR, ретиноиден X рецептор; TLR, Toll-подобен рецептор; VD, витамин D.
Самият витамин D също е от съществено значение за генетичната експресия надолу по веригата, важна за имунния отговор срещу Mycobacterium tuberculosis. Във вродената имунна система активирането на Toll-подобен рецептор (TLR) 2/1 от презентация на M. tuberculosis antigen води до експресията на VDR и 1-α витамин D хидроксилаза [4]. Хидроксилазата превръща 25 (OH) витамин D в активната му форма 1,25 (OH) 2 витамин D, който се свързва с VDR. След това те образуват хетеродимер с ретиноиден X рецептор (RXR), създавайки комплекс, който се премества в ядрото, за да регулира генната транскрипция (Фигура 1). Основен образуван протеин е LL-37, член на семейството на кателицидините, за който е известно, че има антимикробни ефекти срещу Mycobacterium tuberculosis, докато привлича други имунни клетки до мястото на инфекцията [4]. Други функции за витамин D и VDR са да регулират представянето и обработката на антигена, фагоцитозата и производството на интерлевкин (IL) -1 β и фактор на туморна некроза α (TNF-α), от съществено значение за имунния отговор [3].
Проучванията върху генетиката на витамин D и VDR илюстрират нов модел генна среда, който може да помогне за стратифициране на риска от туберкулоза. Трябва да се отбележи обаче, че всички тези проучвания са проведени при възрастни туберкулозни популации. Необходими са допълнителни изследвания, за да се изследва как тези полиморфизми влияят върху риска от туберкулоза при деца.
Имунно развитие и недохранване
Защитата срещу M. tuberculosis изисква сложен имунен отговор, който включва както вродения, така и адаптивния имунитет [6]. При новородените обаче е важно да се разбере, че медиираният от клетките имунитет е непълен и те зависят най-вече от вродения имунитет и майчините антитела [7]. И все пак дори вроденият имунитет е нарушен; доказателствата сочат, че новородените имат намалена функция в антиген-представящите клетки (APC), неутрофили и TLR, и понижени нива на комплемента в кръвта [7]. Освен това се смята, че адаптивният имунитет е изкривен към помощния отговор на Т-клетка 2, потенциално като начин за намаляване на възпалителната реакция, намаляване на алоимунния отговор срещу майката и насърчаване на толерантността към безвредни нови антигени като чревна флора и храна [7]. Това обаче също ги излага на значителен риск срещу вътреклетъчни организми, включително туберкулоза, които зависят от Th1 отговор [6, 7]. Храненето играе съществена роля за развитието на подходящи вродени и Th1 имунни отговори срещу туберкулоза [8].
Въпреки че нашето разбиране за имунното развитие расте, все още остават няколко въпроса относно неговата роля в защитата срещу туберкулоза. Например, въпреки незрелия имунитет, защо виждаме силна реакция от типа Th1 на ваксината BCG? Това предполага, че децата са в състояние да преодолеят тази поляризация към Th2 отговорите чрез неизвестен механизъм [7]. Независимо от нашите ограничения обаче, ние сме в състояние да отбележим, че кърмата, протеините и микроелементите имат значителна роля в развитието на вроден и медииран от клетките имунитет и че тези фактори са критични за отговора на туберкулозата. Въпреки че не са провеждани проучвания, за да се определи как дисфункцията в имунното развитие влияе върху риска от детска туберкулоза, тези доказателства подкрепят, че без подходящо ранно хранене, подходящото имунно развитие е силно нарушено и излага детето на значителен риск.
Хранене и детето с респираторни инфекции
Респираторните инфекции са сред най-големите фактори, допринасящи за заболеваемостта и смъртността при децата. Поради високата честота, тя дава възможност да се проучи как недохранването влияе върху резултатите и риска от заболявания, разпространявани от дихателни капчици, като туберкулоза.
Недохранването е свързано с повишен риск от респираторни инфекции. Проспективно проучване при деца в Бангладеш установи, че поднорменото тегло увеличава риска от инфекция на горните дихателни пътища с 13%, а губенето - с 20% [19]. Освен това, проспективно 10-месечно проучване при номадски кенийски деца установи, че пропиляването предсказва риска от остри респираторни инфекции през влажния сезон [20]. Недохранването също е важен предиктор за смъртността при деца с пневмония, като причинява 52,3% от смъртните случаи, свързани с пневмония [21].
Няколко механизма могат да стоят в основата на повишения риск и тежестта на респираторните инфекции при недохранени деца. Проспективно проучване върху новородени от Холандия установи, че нивата на витамин D в кръвта от пъпна връв прогнозират риск от RSV бронхиолит през първата година от живота [22]. Установено е също, че нивата на цинк са значително по-ниски при деца в Бангладеш с инфекция на долните дихателни пътища и PEM [23]. Освен това липсата на лептин е замесена; той е структурно подобен на цитокини като IL-6 и IL-11, а дългата изоформа на лептиновия рецептор OB-Rb е подобна на семейството цитокинови рецептори gp130 [24]. Лептинът води до секрецията на няколко цитокини, а животински модели показват, че повишеният лептин по време на глад предотвратява атрофия на лимфоидната тъкан. Изследване ex vivo на Т-лимфоцити от недохранени деца в Мексико установи, че инкубацията с лептин води до намаляване на производството на IL-4 и IL-10 и увеличаване на IL-2 и интерферон γ (IFN-γ), което предполага преминаване към Th1 отговор [24]. По този начин, недохранените деца с респираторни инфекции могат да имат дефицит в клетъчно-медиирания имунитет и отговора от типа Th1, и двата критични за имунитета срещу туберкулоза.
Тъй като респираторните инфекции са преобладаващи при децата, се появиха множество доказателства за рискови фактори за инфекция и лоши резултати, включително хранителен статус. Въпреки че има ограничения при превеждането на риска от един патоген към друг, беше забелязано, че неправилното хранене е свързано с тежки дефицити в имунитета, както вродени, така и медиирани от клетките. По този начин, докато не се проведат допълнителни изследвания върху детската туберкулоза, можем да се поучим от минали проучвания при деца, които предполагат, че недохранването значително влошава риска и тежестта на респираторните заболявания.
Хранене и детето с туберкулозна болест
Th-1 имунитетът срещу туберкулоза е нарушен от недохранване
Недохранване и BCG ваксинация
Проучванията показват, че децата, които са били ваксинирани с BCG, са имали значително по-нисък туберкулинов кожен отговор, ако са имали тежък протеинов дефицит [17, 35, 36]. Въпреки че по-леките форми на недохранване може да нямат дефицит в туберкулиновия отговор [37], проспективно проучване сред кърмачета, ваксинирани при раждане с BCG, показва, че леко или средно недохранените деца все още имат намаление на свързаните с туберкулоза клетъчно-медиирани имунни отговори [38]. Това се подкрепя в проучвания върху животни, при които животните с дефицит на протеин имат значително нарушена защита от BCG след излагане на туберкулоза, както се наблюдава при по-голямо бактериално натоварване в белите дробове в сравнение с хранени ваксинирани животни [39]. Изглежда, че този дефицит е свързан с медииран от клетките имунитет, тъй като е свързан с намалена туберкулинова реактивност на кожата и нарушено освобождаване на IL-2, TNF-α и IFN-γ от ваксинирани с BCG животни с дефицит на протеин [28]. Подхранването на животните връща защита, подобна на контрола, което предполага, че дефицитът на протеин служи да повлияе на функцията, но не и на придобиването на адаптивния имунен отговор срещу туберкулоза след BCG ваксинация [29].
От проучвания in vivo на деца и животни, изложени на микобактерии чрез инокулация или ваксинация, виждаме, че редица макро- и микроелементи имат пряко въздействие върху правилното функциониране на имунните клетки, което ще позволи на детето или да изчисти инфекцията, или да я вкара в латентно състояние. Следователно това излага децата на риск от прогресиране до активно заболяване и допълнително влошаване на недохранването им.
Хранителните добавки като адювантна терапия при туберкулоза
В крайна сметка искаме да знаем дали хранителните добавки могат да подобрят имунната функция и клиничните резултати при туберкулоза. Ранните екологични проучвания установяват, че по време на ограничаване на храните, като например война, заболеваемостта от туберкулоза нараства значително, а след това рязко намалява след връщането на хранителните запаси [17]. Клиничните изпитвания обаче са изправени пред големи предизвикателства, тъй като терапията с туберкулоза ще доведе до бърз спад в бациларното натоварване и ще подобри хранителния статус. Следователно, това може да засенчи всяка скромна промяна след добавянето [40]. Едно обещаващо рандомизирано проучване сред възрастни с туберкулоза в Индонезия установи, че добавянето на цинк и витамин А води до по-бързо време за преобразуване на храчките и разрешаване на белодробните лезии при рентгенография на гръдния кош [41]. Напоследък обаче същата група не успя да повтори резултатите при по-недохранена популация с комбинирано или индивидуално добавяне на витамин А и цинк [42].
маса 1.
Обобщение на микроелементите, важни за имунитета срещу туберкулоза
| Витамин D | Функция на макрофагите, правилна фагоцитоза, лизозомно сливане | Рентгенологично подобрение, но без разлика в серумните нива или промяна на теглото [47] |
| Витамин А | Регулира вродения имунитет, Т и В лимфоцитната функция и поддържа лигавичния епител | Няма подобрение в теглото или дихателните симптоми [46] |
| Витамин Е | Антиоксидантни свойства, които могат да намалят оксидативния стрес върху Т лимфоцитите | Когато е включен в мултивитамин за деца, не подобрява наддаването на тегло [48] |
| Цинк | Широко разпространен ефект върху имунитета и дефицитът може да доведе до лимфопения, лошо функциониране на лимфоцитите, атрофия на тимуса, нарушен клетъчно-медииран имунитет и преминаване към Th2 отговор. Също така от съществено значение за образуването на метало-ензим и създаването на свободни радикали | Подобрява туберкулиновия отговор, въпреки че няма проучвания за резултатите от лечението [44] |
| Селен | Клетъчен и хуморален имунитет, използван за създаването на метало-ензими | Няма известни проучвания при деца |
| Желязо | Вроденият имунитет като неутрофилна и естествена убийствена функция, узряване на Т-клетките и дефицит може да доведе до преминаване към Th2 отговор | Няма известни проучвания при деца |
ЗАКЛЮЧЕНИЕ
Изследванията на ролята на храненето върху детската туберкулоза са значително ограничени. И все пак продължаваме да класифицираме недохранените деца като висок риск от туберкулоза и подкрепяме цялостната хранителна добавка за деца с туберкулоза. Механизмите, които стоят в основата на връзката между недохранването и детската туберкулоза, остават неясни. Използвайки наличните доказателства, ние предлагаме модел, детайлизиращ известната информация между хранителния статус, имунната функция и риска от туберкулозно заболяване. Въпреки това е също толкова важно да разпознаем сериозните пропуски в нашите знания (Таблица 2). Изискваме по-големи проспективни проучвания, които оценяват как хранителният статус влияе върху риска от туберкулоза, като същевременно провеждаме допълнителни рандомизирани контролирани проучвания за използването на добавки в терапията с туберкулоза. В условия с ограничени ресурси туберкулозата при деца е основна причина за заболеваемост и смъртност и голям резервоар за продължаване на предаването на инфекцията. С нарастването на нашето основно разбиране за взаимодействието между туберкулоза и недохранване е важно да се стремим да приложим тези постижения за благосъстоянието на това уязвимо население.
Таблица 2.
Изследователски приоритети в детската туберкулоза и недохранване
- Коморбидна болка и детско затлъстяване
- Сложността около детското затлъстяване - ScienceDaily
- Реклами за храни и напитки по време на спортни предавания, свързани с детското затлъстяване
- Последици от дефицит и излишък от поглъщане на енергия - детство
- Въглехидратен метаболизъм - Резюме - Метаболитен синдром и затлъстяване в детска и юношеска възраст -