Резюме
Връзката между млечната и мастната тъкан се разширява, в различен контекст, до лактация, тъй като триглицеридите на мастната тъкан се мобилизират, за да осигурят мастни киселини за синтез на липиди на млякото (11). Въпреки това, прекомерното използване на дълговерижни мастни киселини от мастна тъкан при затлъстели плъхове води до увеличаване на общото и наситено съдържание на мастни киселини в млякото (29) и повишено отлагане на мазнини в потомството, консумиращо млякото. Въпреки че подобни проучвания са изследвали подробно метаболитните последици от затлъстяването по време на лактация, те не са изследвали развитието на млечните жлези.
Животни.
Женски мишки (OF1, безпородни швейцарски мишки от река Чарлз) на възраст 4 месеца бяха настанени в среда 12: 12 часа светло-тъмно при температура на околната среда 22 ° C. Те са били хранени или със стандартна лабораторна диета (UAR, Epinay-sur-Orge, Франция), или с комбинация от ad libitum достъп до стандартната диета и, в допълнение, ad libitum достъп до диета с високо съдържание на мазнини. Стандартната диета, AO3, е предназначена за разплод на животни и нейният състав е показан в таблица 1.
маса 1. Състав на диетите
Контролните животни получавали стандартната диета. Животните, хранени с високомаслена диета, получават стандартната диета плюс сместа с високо съдържание на мазнини.
Млечната тъкан се претегля и съхранява при -80 ° C. Малки проби от мляко бяха получени чрез ексудация на тъканта и анализирани за съдържание на протеини и мазнини. Съдържанието на мазнини се определя чрез екстракция на пробата два пъти с 4 об. Хлороформ, който след това се изпарява до сухо в претеглен флакон. Цялото монтиране на четвъртата дясна коремна млечна жлеза беше приготвено, както е описано по-горе, с изключение на това, че жлезите са леко притиснати между две микроскопски плъзгачи поради дебелината на жлезите при затлъстели животни (37). Изцяло монтирани изображения от животни, убити на ден 14 на бременността са анализирани с помощта на Leica QWin версия 2.6. Монохромните изображения бяха подложени на праг, така че белите нива> 156 (представляващи мастна тъкан) бяха избрани. Площта, заета от мастна тъкан, се изважда от общата площ на изображението, за да се осигури делът на паренхимната тъкан. Петата лява жлеза беше замръзнала при съединение с оптимална температура на рязане. Теглото на мастната тъкан от параметриалното място (основното място при възрастни женски мишки) също е записано.
Съдържанието на ДНК в млечната жлеза се определя по метода на Labarca и Paigen (18) със специфични методи за млечната жлеза, както е описано по-рано (2).
Общата активност на АСС и съотношението в активното състояние се определят, както е описано по-горе.
статистически анализи.
Сравненията бяха направени или с помощта на несдвоени на Student т-тест или, когато са направени множество сравнения, от ANOVA, последвани от post hoc тестове, включващи корекцията на Bonferroni. Смъртността и зачеването са сравнени с помощта на точния тест на Fischer.
Телесно тегло и консумация на храна.
Храненето на мишки с високо съдържание на мазнини доведе до увеличаване на телесното тегло (P 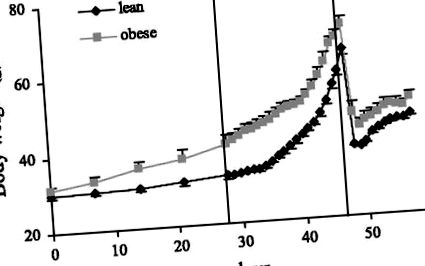
Фиг. 1.Промените в телесното тегло по време на репродуктивния цикъл при мишки, хранени с диета с високо съдържание на мазнини.
Фиг. 2.Прием на енергия по време на репродуктивния цикъл при мишки, хранени с диета с високо съдържание на мазнини.
Общото телесно тегло се е увеличило от 33 ± 1 на 64 ± 5 g в контролите и от 42 ± 2 на 71 ± 2 g в групата с високо съдържание на мазнини по време на бременност. Между ден 18 на бременността и ден 2 от лактацията, контролите са приемали храна от 118 ± 9 (P18), 83 ± 7 (раждане, L1) и 96 ± 13 kJ/ден (L2), докато групата с високо съдържание на мазнини е имала много по-голям спад в храната прием, с прием съответно от 154 ± 14, 104 ± 20 и 73 ± 11 kJ/ден. След първоначалното голямо намаляване на телесното тегло след раждането на малките, намаляването на приема на храна е придружено от допълнително намаляване на телесното тегло през първия ден след раждането с 3,7 ± 1,2 g (средно ± SE) при животни с високо съдържание на мазнини, което е значително по-голямо от това на контролите (0,2 ± 0,6 g, P
Фиг. 3.Промени в параметричното тегло на мастната тъкан по време на бременност (P14) и лактация (L1, L10) при мишки, хранени с диета с високо съдържание на мазнини. Стойностите са средни стойности ± SE. *P
Въпреки това количеството на мастната тъкан остава значително по-високо в групата с високо съдържание на мазнини [1,12 ± 0,48 (SE) g] в сравнение с контролите (0,10 ± 0,01 g), P
Фиг. 4.Тегло на млечната жлеза (A) и съдържание на ДНК (Б.) по време на бременност и кърмене при мишки, хранени с диета с високо съдържание на мазнини. Стойностите са средни стойности ± SE. **P
Функция на млечната жлеза.
Животните с високо съдържание на мазнини са показали нарушена лактогенеза, както е показано от лошия начален темп на растеж на малките от 0,5 ± 0,3 (SE) g/ден в сравнение с 2,1 ± 0,3 g/ден в контролите (P
Фиг. 5.Натрупването на тегло отпадъци веднага след раждането при мишки, хранени с диета с високо съдържание на мазнини. Стойностите са средни стойности ± SE. *P
Забавянето в лактогенезата е придружено от редица промени в експресията на иРНК, които са в съответствие с намаляване на синтеза на мляко. Експресията на α-лакталбумин, β-казеин и WAP бяха намалени ден 1 на лактацията, независимо дали се изразява на единица ДНК или на жлеза, въпреки че β-казеинът и WAP са нормализирани от ден 10 на лактацията, докато експресията на α-лакталбумин остава значително потисната (фиг. 6). Тези промени в експресията на иРНК на основните млечни протеини бяха придружени от значително намаляване на общото съдържание на протеин в млякото на затлъстели животни (5,0 ± 0,4) в сравнение с постно животно [6,7 ± 0,6 (SE), P
Фиг. 6.α-лакталбумин (A), β-казеин (Б.) и протеин от суроватъчна киселина (WAP, ° С) експресия по време на бременност и кърмене. Стойностите са средни стойности ± SE. *P
Експресията на ACC-α mRNA се задвижва от два промотора (PIA, основно се счита, че се използва в черния дроб и мастната тъкан, и PII, който е по-широко разпространен и се счита за основен промотор в млечната жлеза). Въпреки че PII беше основният препис в нашите проучвания, имаше петкратно увеличение на експресията както на PIA (преанотирана от PI, за да се съобрази с човешката анотация; вж. Реф. 38), така и PII преписи между ден 14 на бременността и ден 10 на лактацията (Таблица 1). На ден 1 на лактацията, стационарните нива на иРНК на ACC транскриптите от PII промотора са по-ниски при затлъстели животни, въпреки че са нормализирани от ден 10 на лактацията.
Хибридизацията на cRNA, съответстваща на нуклеотидната последователност, обхващаща областта на ACC-α mRNA, кодираща мотива за фосфорилиране Ser-1200 (1, 3) до РНК на лактираща млечна жлеза, създава защитени фрагменти от 438 и 382 нуклеотида (резултатите не са показани). Те съответстват на ACC-α иРНК, съдържащи (438 nt вида, дълъг транскрипт) или липсващи (382 nt, кратък транскрипт) 24-nt екзонична последователност. Превключването в съотношенията на иРНК с къса/дълга форма е характерно за началото на лактогенезата (3). Съотношението на къса към дълга форма на ACC-α иРНК се увеличава от 2,4 ± 0,8 (средно ± SE) нататък ден 1 на лактация до 8,0 ± 0,1 на ден 10 на лактацията при слаби мишки. Той също се е увеличил при затлъстели животни, въпреки че съотношенията са по-малки (съответно 1,5 ± 0,4 и 5,0 ± 0,9). В резултат на това експресията на основния кратък препис (ACC-α) е значително намалена при затлъстели животни (52 ± 16 единици) в сравнение с контролите (98 ± 18) на ден 10 на кърмене (P
Таблица 2. Експресия на иРНК в стационарно състояние за ацетил-коА карбоксилаза в тъканите на млечната жлеза по време на бременност и кърмене при слаби и затлъстели мишки
Стойностите са средни стойности ± SE.
* P 30 пъти между бременността ден 14 и ден 10 на лактацията при контролни мишки. Активността на АСС е намалена при затлъстели животни в сравнение с контролите и при двете дни 1 и 10 на лактацията, въпреки че разликата е била само статистически значима на ден 10 на лактацията (фиг. 7).
Фиг. 7.Обща активност на ацетил-КоА карбоксилаза (ACC) (A) и дела на ACC в активно състояние (Б.) по време на бременност и кърмене. Стойностите са средни стойности ± SE. *P
Намалението на общия ACC беше компенсирано на ден 1 на лактация, но не ден 10, чрез увеличаване на процента на ензима в активното място [34 ± 9 срещу 71 ± 7% (средно ± SE, P
Фиг. 8.Цялостен анализ на млечните жлези ден 14 на бременност в постно (A) и затлъстяване (Б.) мишки. Скалата представлява 1 мм.
Дори най-тежко затлъстелите животни, които демонстрират най-необичайния фенотип (силно намалена честота на разклоняване), показват дуктални структури, които нахлуват в цялата мастна подложка. По този начин изглежда, че основният морфологичен дефект е намалена честота на разклоняване и нарушено алвеоларно развитие, а не дефект на растеж/пролиферация. Въпреки че хистологичните анализи показват намаляване на дела на дукталния епител и увеличен размер на адипоцитите при затлъстели животни, на ден 14 на бременността, от ден 10 на лактацията секреторните алвеоларни структури изглеждат нормални, въпреки че джобовете с увеличени адипоцити остават при затлъстели животни (фиг. 9). В допълнение, при раждането, където наблюдавахме намалена млечна секреция, алвеоларните структури на затлъстелите животни показаха драматично натрупване на липиди в епителните клетки (фиг. 10). Натрупването на липиди в алвеоларните клетки напомня по-скоро на късна бременност, където липидният синтез предхожда обилния синтез на лактоза, който е отговорен за осмотичното шофиране на водата в млякото.
Фиг. 9.Хистологични разрези на млечните жлези от бременността ден 14 постно (A) и затлъстяване (Б.) мишки и от лактация ден 10 постно (° С) и затлъстяване (д) мишки. А, адипоцит; D, канал; Е, епител; L, лумен, съдържащ мляко. Скалите представляват 0,5 мм. (Обърнете внимание, че увеличението в ° С и д е два пъти повече от A и Б..)
Фиг. 10.Следродилно натрупване на триглицериди в алвеоларен епител на контролна мишка ден 18 на бременността (A) и затлъстела мишка ден 1 на кърмене (° С), показващи единични липидни капчици (стрелка) в множество клетки на алвеолите. За разлика от това, в контролната мишка на ден 1 на кърмене (Б.), е настъпила липидна секреция, както се вижда от големия брой липидни капчици, присъстващи в алвеоларния лумен (стрелка). Скалата представлява 0,1 мм.
Част от проблема, свързан с инициирането на млечна секреция, може да е бил свързан с апетита, тъй като диетите с високо съдържание на мазнини са загубили значително количество тегло и са изяли значително по-малко калории през първия ден на лактацията, по времето, когато са били не могат да поддържат наддаване на тегло при своите малки в същата степен, както при слаби животни. Този феномен на намален прием на храна и по-голяма загуба на тегло е очевиден и при плъхове със затлъстяване (31). Направени са противоречиви наблюдения относно възможността за подобряване на производството на мляко чрез преминаване към диета с ниско съдържание на мазнини по време на кърмене, като проучванията показват или по-нататъшен спад в производството на мляко (29, 30), или подобрение (28). При жени едно проучване показва, че загубата на ∼0,5–1 kg телесно тегло/седмица при затлъстели индивиди не е повлияла на растежа на техните деца (20–22). Причините за тези противоречиви резултати не са очевидни веднага, въпреки че може да са свързани с факта, че изискванията за лактация при жените са ∼25% от общите разходи, докато при гризачите това търсене може да надвишава 60%.
В заключение, това проучване предоставя модел на диета, индуцирано затлъстяване, което показва много от характеристиките на функцията на млечната жлеза при затлъстела жена, включително нарушена лактогенеза. Ние потвърдихме и разширихме проучвания при плъхове, като идентифицирахме нарушения в експресията на α-лакталбумин (лактоза), β-казеин, WAP (протеин) и ACC (липиден синтез). Също така за първи път показваме, че PIA промоторът за ACC-α се регулира по подобен начин на този на PII в млечната жлеза на лактиращи мишки и че ензимната активност, както обща, така и процентна в активното състояние, се влияе от затлъстяването състояние. И накрая, за първи път показваме, че затлъстяването води до ненормална морфология на млечната жлеза, която може да допринесе за ефектите от описаните метаболитни промени. Разбирането на механизмите, чрез които затлъстяването влияе върху развитието и функционирането на млечната жлеза, са очевидно важни бъдещи цели.
Д. Дж. Флинт получава писмо-портокал от Националния институт на Санта и Де Ла Речерче Медикале и част от тази работа е спонсорирана от Шотландския отдел за околна среда и селски въпроси.
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. Раздел 1734 единствено, за да посочи този факт.
Благодарим на М. Гарднър и С. Бумар за квалифицирана техническа помощ.
- Целастрол насърчава отслабването при индуцирано от диетата затлъстяване, като инхибира протеиновия тирозин
- Диетичните добавки с екстракт от Agaricus blazei murill предотвратяват затлъстяването, предизвикано от диета и
- Дебел въпреки тежката фермерска работа - проследяване на затлъстяването EurekAlert! Научни новини
- Дебелът не е проблемът - дебелото клеймо е - Scientific American Blog Network
- Могат ли кучетата да ядат риба; Американски киноложки клуб
