Резюме
1 Пролиферативна възпалителна атрофия: лезия, която свързва нараняването на епитела с рака на простатата
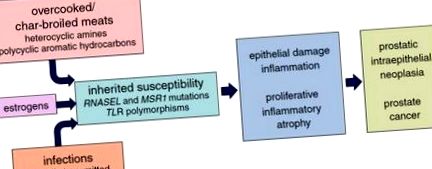
В регионите по света с висока честота на рак на простатата възпалението на простатата е по същество повсеместно [18]. Макар и предимно асимптоматичен, особено ако засяга периферната зона на простатата, където възникват ракови заболявания, отдавна е известно, че простатитът води до диагностициране на рак на простатата, независимо от склонността му да причинява заболяването, тъй като има тенденция да повишава нивата на серумния простатен специфичен антиген (PSA) . При възпалената простата увреждането на бариерната функция на простатния епител стереотипно причинява обратен поток от секрети на простатата, включително секретирани протеини като PSA, в паренхима на простатата и в крайна сметка в кръвния поток. Тъй като откриването на PSA в серума служи като основен спусък на простатната биопсия за откриване и диагностика на рак на простатата, възпалението на простатата е отговорно за значителна част от над 30 милиона PSA теста, което води до повече от милион биопсии на простатата, търсещи рак, изпълнява се в САЩ всяка година [36]. Независимо от това, повишенията на серумния PSA още на 40-годишна възраст са свързани с повишен риск от рак на простатата по-късно в живота [23, 24].
Етиологични фактори за рак на простатата. Карциногенезата на простатата следва увреждане на простатния епител, регенеративна пролиферация и хронично/рецидивиращо възпаление, което води до пролиферативни възпалителни атрофични лезии. Тези лезии покълват клетки с активиране на c-Myc, съкращаване на теломерите и инагенация на епигенетичния ген, които водят до простатна интраепителна неоплазия и рак на простатата, носещи целенасочени генни пренареждания, мутации и широко повреден епигеном
Увреждането на простатата, последвано от дезадаптивен вроден имунен отговор и отговор на увреждане на тъканите, може да бъде пътят, който свързва експозицията на околната среда, включително диетата, с развитието на рак на простатата. Разбира се, както в популационни проучвания, така и в анализи на молекулярна патология, връзката между възпаление на простатата, PIA и рак на простатата е ясна. И все пак, механизмите, чрез които хранителните навици или други експозиции водят до увреждане на простатата, не са напълно изяснени.
2 Диетата: Източник на канцерогени, които могат да увредят простатния епител и да причинят PIA
Епидемиологичните проучвания на рака на простатата са силно включили диетата като основен модулатор на риска от рак на простатата. Честотата и смъртността от рак на простатата варират в различните географски региони, с висок риск от рак на простатата в Съединените щати и в Европа и нисък риск от рак на простатата в Азия, но имигрантите от нискорискови до високорискови региони обикновено приемат по-високи рискове от рак на простатата, особено с културна асимилация [27, 73]. Това вероятно отразява хранителните разлики: или хранителните навици във високорисковите региони насърчават рака на простатата, хранителните навици в нискорисковите региони предотвратяват рака на простатата или и двете. Когато се изследват по-подробно, най-последователната диетична асоциация за рак на простатата изглежда е приемът на червени меса и/или животински мазнини [26, 43]. За червените меса готвенето при високи температури или печенето на въглища създава както хетероциклични ароматни амини, така и полициклични ароматни въглеводородни канцерогени [39, 44]. Тези практики на готвене също са свързани с повишен риск от рак на простатата и могат частично да обяснят повишена склонност към развитие на рак на простатата сред афроамериканските мъже спрямо кавказките мъже в Съединените щати [37, 82].
3 Недиетични експозиции, които причиняват увреждане на епитела на простатата, възпаление на простатата и PIA
Смята се, че половите стероидни хормони, инфекциите и наследството влияят върху развитието на рак на простатата. Андрогенните хормони, като тестостерон и дихидротестостерон, заедно с функциониращ андрогенен рецептор, са необходими за нормалния растеж и развитие на всички полови спомагателни жлези, включително простатата и семенните везикули, но има малко доказателства, че андрогените сами по себе си причиняват рак на простатата. Нивата на андроген непрекъснато намаляват през целия живот при възрастни мъже, достигайки връх около 21-годишна възраст и след това намалявайки, тъй като ракът на простатата започва да възниква [66, 68]. В Съединените щати афро-американските мъже страдат от повече рак на простатата, отколкото белите хора, въпреки сходните нива на андроген, коригирани по възраст [66]. Също така, при простатите на възрастни мъже, андрогенната сигнализация е необходима за терминална диференциация до фенотипа на секретарните епителни клетки на колоните, насърчавайки транскрипцията и транслацията на гени като PSA и TMPRSS2 и стимулирайки производството на секрети за еякулата. Действайки по този начин, андрогените са склонни да потискат пролиферацията на епителните клетки.
И накрая, част от наследствената податливост към развитие на рак на простатата може да се обясни с гени, кодиращи участниците, движещи активирането и интензивността на вродените възпалителни реакции. Два такива гена, RNASEL и MSR1, изглежда са отговорни за някои фамилни клъстери на рак на простатата [11, 90]. RNASEL кодира рибонуклеаза, която участва в интерферон-индуцируем път на разрушаване на РНК, активиран в отговор на вирусна инфекция или друг клетъчен увреждащ стрес; MSR1 кодира субединици на рецептор за отстраняване на макрофаги, който свързва бактериален липополизахарид и липотейхоева киселина. Намалената функция на двата протеина при мишки намалява способността за пълно изчистване на различни инфекции [80, 96]. В популационни проучвания са наблюдавани доста последователни асоциации между рак на простатата и полиморфни варианти на гени, кодиращи тол-подобни рецептори (TLR), като TLR4 и клъстера TLR1-TLR6-TLR10 [77, 95]. TLR могат да свързват широк спектър от патогени и/или увредени клетъчни компоненти, действайки чрез NF-κB сигнализиране за насърчаване на енергични вродени имунни отговори [12].
Въпреки че изглежда, че естрогените и инфекциите могат да причинят увреждане на епитела на простатата, което може да доведе до PIA и рак на простатата при липса на диетични влияния, всеки от тези процеси може да бъде повлиян от хранителните навици, често срещани във високорисковите региони на рака на простатата по света . Нивата на естроген са по-високи при мъжете с повишени мастни тъкани. Микробиомът, източник на инфекции или на колонизационна устойчивост към инфекции, варира значително в зависимост от диетичните практики. Като влияе върху склонността на естрогените и инфекциите да причиняват увреждане на простатата, диетата може индиректно да действа за насърчаване на рак на простатата. По същия начин, степента на диетично хетероциклично амин-медиирано увреждане на простатата вероятно е обект на същите генетични фактори на гостоприемника, които регулират интензивността на отговорите на гостоприемника към инфекции на простатата. RNASEL може да разгражда човешката РНК, както и вирусната РНК, което води до апоптоза [89]. MSR1 помага за изчистване на циркулиращите окислени серумни липопротеини с ниска плътност [41]. TLR се активират от повредени компоненти на човешките клетки [12]. По този начин диетата вероятно оказва пряко и косвено въздействие върху развитието на рак на простатата при човека.
4 Възпаление, PIA и молекулярната патогенеза на рака на простатата
Живозастрашаващите човешки ракови клетки на простатата съдържат 3 866 мутации (20 нетихи кодиращи мутации), 108 пренареждания, 5 408 области с ДНК хиперметилиране, съкратени теломерни последователности и активиран протеин c-Myc [7, 58, 92]. За отбелязване е, че соматичните мутации изглежда не са отделили някакъв често срещан „двигател“ на канцерогенезата на простатата, нито са намекнали за някакъв признак за промяна в основата, който да съответства на един вид канцероген спрямо друг. Вместо това мутациите изглежда се натрупват с течение на времето при отделни видове рак, повлияни от това дали са се появили аномалии за възстановяване на придобити несъответствия и/или дали са използвани промутагенни лечения. По-последователният соматичен генетичен дефект са транслокациите, описани по-горе, особено тези, включващи генни мишени на андрогенно сигнализиране, слети с ракови гени, като TMPRSS2-ERG, което може да се дължи на грешки при започване на транскрипция в отговор на андрогенно действие, водещо до TOP2B- асоциирани ДНК двуверижни скъсвания [28]. Този соматичен геномен дефект изглежда се появява при PIN лезии и вероятно е в основата на инвазивността, характерна за карцинома. От всички соматични промени в раковите клетки на простатата изглежда, че най-последователните и най-ранните включват епигенетично заглушаване на гена, съкращаване на теломери и индукция на c-Myc [58].
В допълнение към метилирането на ДНК, съкращаването на теломерите и свръхекспресията на протеин c-Myc последователно придружават човешката карциногенеза на простатата [33, 49]. Теломерите на хромозомите, специализирани структури, съдържащи
PIA лезиите, които се генерират в отговор на увреждане на клетките и тъканите, придружени от индуциран възпалителен отговор, свързват експозициите, като диетични канцерогени и естрогени, с рак на простатата. Най-ранните стереотипни молекулярни събития, епигенетично заглушаване на гена, съкращаване на теломерите и активиране на c-Myc възникват при PIA лезии. Точните механизми, чрез които се случват тези молекулярни инциденти, не са разработени. Всеки може да има своя произход или поне да бъде повлиян или от увреждащата експозиция, например хранителен канцероген, или от възпалителния отговор. По този начин карциногенезата на простатата може да наподобява развитие на рак, причинено от експозиция, в много органни места.
5 рационални интервенции за предотвратяване на рак на простатата
Ако епидемията от рак на простатата в развития свят може да се обясни с излагане на диетични канцерогени и/или естрогени, които водят до хронично възпаление на простатата, рационалните подходи за профилактика на рака на простатата трябва да включват: (1) избягване на експозициите, (2) затихване на увреждане на простатните клетки и тъкани, причинено от канцерогени, и/или (3) намаляване на интензивността или продължителността на възпалението в простатата. Не е изненадващо, че в подкрепа на всеки подход се появяват доказателства за епидемиологични и клинични изпитвания.
6 Резюме и заключения
- Какво да ядем за здравословна диета за рак на простатата Ежедневно здраве
- Влиянието на диетата и упражненията върху рака на простатата Сиатълски алианс за грижа за рака
- Лечението на рак с гроздова диета
- Гринч, СЗО, червено месо и рак Празнична поема - Диета за диагностика
- Диетата 5 2 помага да се победи ракът и болестта на Алцхаймер, установява проучване