Лабораторията Джаксън, Бар Харбър, Мейн; и
Департамент по науките за растенията и животни, Humboldt-Universität zu Berlin, Берлин, Германия
Департамент по науките за растенията и животните, Humboldt-Universität zu Berlin, Берлин, Германия
Лабораторията Джаксън, Бар Харбър, Мейн; и
Лабораторията Джаксън, Бар Харбър, Мейн; и
Департамент по науките за растенията и животните, Humboldt-Universität zu Berlin, Берлин, Германия
Адрес за заявки за повторно отпечатване и друга кореспонденция: G. A. Brockmann, Развъдна биология и молекулярна генетика, Отдел за култури и животни, Humboldt-Universität zu Berlin, Invalidenstraße 42, 10115 Берлин, Германия (имейл: [имейл защитен]).
Резюме
затлъстяването е добре признат рисков фактор за метаболитен синдром и заболяване, което често е придружено от нискостепенно хронично възпаление (20, 27). Пионерската работа на McGarry (36) поставя, че инсулиновата резистентност и хипергликемията могат да бъдат по-добре разбрани, ако се разглеждат в контекста на липидния метаболизъм. Промените в състава и разпределението на мазнините в различни тъкани могат да имат метаболитни последици в цялото тяло, които водят до болестни състояния. Липидите не са само молекули за съхранение на излишната енергия; те също са основни компоненти на клетъчните мембрани и действат като сигнални молекули, които регулират системните биологични процеси. Като такива те могат да променят локално транскрипцията или да действат като носители на информация, за да променят функцията в други клетки, тъкани или органи.
Бялата мастна тъкан (WAT) и кафявата мастна тъкан (BAT) играят допълнителни роли в енергийния баланс и контрола на телесното тегло. При повечето бозайници НДНТ е основният медиатор на адаптивната термогенеза и следователно играе критична роля в разхода на енергия. WAT служи като депо за съхранение на енергия и сигнализира информация на периферните органи и тъкани за енергийните резерви. По време на увеличаване на теглото депата за мазнини не се използват еднакво и те се различават по своята архитектура и функция (20, 34, 35). Става все по-очевидно, че регионът на натрупване на мазнини и наличието на специфични мастни киселини играят ключова роля в чувствителността към болести. Доказано е, че централното затлъстяване, характеризиращо се с високи нива на висцерални мазнини, корелира с диабет тип 2, дислипидемия и сърдечно-съдови заболявания (10, 55, 58). Алтернативно, периферното затлъстяване, увеличените количества подкожни мазнини могат да имат защитни ефекти, които подобряват чувствителността към инсулин и намаляват рисковите фактори за заболявания (44, 51). В допълнение, извънматочното съхранение на мазнини в черния дроб и мускулите е свързано с чернодробна стеатоза и инсулинова резистентност в мускулите (5, 23).
Хранителните геномни изследвания са анализирали отговорите на тъканите към различни диети и хранителни вещества (1, 14, 18). Резултатите обаче варират в зависимост от видовете и тъканите, както и експерименталните протоколи (48, 53). Степента и начинът, по който различните тъкани реагират на увеличеното съхранение на мазнини, не са добре разбрани. Следователно целта на това проучване е да свърже индуцирано от диетата отлагане на мазнини и профили на мастни киселини със специфични за тъканите функционални адаптации в отговор на съхранението на мазнини. Очаквахме, че разликите в тъканната маса и състава на мастните киселини ще доведат до диференциални промени в специфични транскрипти, участващи в пътища, които водят до затлъстяване и инсулинова резистентност.
DBA/2J мишките показаха най-голямо наддаване на тегло в отговор на диета с високо съдържание на мазнини (HFD) сред 43 инбредни щама (49). Следователно, ние изложихме младите DBA/2J мишки на 6 седмици HFD хранене [богато на наситени мастни киселини (SFA)] и изследвахме специфично за тъканите увеличение на масата, състава на мазнините и изобилието от транскрипти. Проучихме отговорите на НДНТ, WAT (гонадни, глутеални, мезентериални, ретроперитонеални, подкожни), черен дроб и мускули на възраст 12 седмици, когато мишките с HFD продължават да наддават и да имат обща забавена скорост на метаболизма.
Животни, диети и жилища.
Двадесет и четири мъжки мишки DBA/2J на възраст 5 седмици са получени от лабораторията Джаксън. Средното телесно тегло при раждане е 14,8 ± 1,5 g. Всички животни са били хранени със стандартна диета за разплод (SBD) до 6-седмична възраст. След това животните бяха разделени на две групи за хранене със същото средно телесно тегло на група. През следващите 6 седмици едната група е хранена с HFD, а другата е държана на SBD. Животните се хранят ad libitum и имат свободен достъп до вода. Мишките бяха настанени по двойки в специфична стая без патогени с 12: 12-часов цикъл светлина-тъмнина. Всички експериментални процедури са одобрени от Комитета за грижи и употреба на животните за експерименти в лабораторията Джаксън (номер на одобрение A3268-01) и от германските органи за защита на животните за експериментите в съоръжението за животни в университета Хумболт (одобрение № G0301/08).
HFD е пречистен TestDiet 58G8 с 45% енергия от мазнини, който се основава на TestDiet Basal Diet 5755 (Purina Mills, Richmond, IN). Диетата се състои от 21,9% протеини, 23,5% мазнини, 4,9% фибри и 42,7% въглехидрати, минерали и витамини (стойностите са в тегло/тегло). Енергийното съдържание е 4,70 kcal/g (19,68 kJ/g); мазнините допринасят 45%, протеините 18,6% и въглехидратите 36,4%. SBD беше стандартен плъх и мишка/Auto 4F за разплод LabDiet 5K54 (Purina Mills). Диетата се състои от 18% протеини, 4% мазнини и 5% фибри. Брутната енергия на SBD е 3,97 kcal/g (16,62 kJ/g); 22% от енергията се осигурява от протеини, 11% от мазнини и 67% от въглехидрати. Физиологичната стойност на горивото е 3,28 kcal/g (13,73 kJ/g), а метаболизираната енергия е 3,09 kcal/g (12,94 kJ/g). Мазнините в HFD са предимно свинска мас, с малко царевично масло, докато източникът на мазнини в SBD е соево масло. През целия експериментален период се хранеше с една производствена партида диети. Производителят предостави данните за състава на храната. Химичният анализ на диетите показа, че HFD и SBD съдържат съответно 21,8 и 4,6 g мазнини на 100 g диета. Диетите бяха стерилизирани преди употреба.
Фенотипиране на мишки и вземане на проби от тъкани.
Мишките се претеглят ежеседмично на възраст между 5 и 12 седмици. Приемът на храна се изчислява като разлика между предлаганото и остатъчното количество храна на 7-дневни интервали от седмица 8 нататък. Храната беше предоставена като пресовани гранули за ниско разтичане, а остатъчното разливане не беше разгледано тук. Енергийният прием, определен от енергийното съдържание във всяка диета и консумираната маса, се изчислява на база на ден. Ефективността на захранването се определя като съотношение на наддаването на телесно тегло в грамове към консумираната енергия в килоджаули. За сравнение между животните, енергийният прием, ефективността на фуража и седмичните измервания на приема на храна са осреднени за периода между 8 и 12 седмици.
Серумните липиди [общ холестерол, холестерол на липопротеини с висока плътност (HDL), триглицериди (TG), свободни (нестерифицирани) мастни киселини (NEFA)] и глюкоза са измерени в деня на дисекция с анализатор на химията Beckman Coulter Synchron CX5 Delta (Beckman) Coulter, Fullerton, CA) съгласно инструкциите на производителя (подробности на http://pga.jax.org/protocols). Общият холестерол и HDL холестеролът се измерват директно. Оценка на не-HDL холестерол, който в мишката се състои от липопротеин с ниска плътност (LDL) и липопротеин с много ниска плътност (VLDL), може да бъде получена чрез изваждане на HDL холестерола от общия холестерол. Серумният инсулин се определя в проби от 5 μl с търговския комплект свръхчувствителен ELISA на Insulin Mouse от DRG Instruments (Марбург, Германия). Както е описано по-горе, лептинът е определен с m/rLeptin ELISA комплект от Mediagnost (Reutlingen, Германия). За сравнение на фенотипните стойности между групите за хранене, Student's т-беше приложен тест за двустранни разпределения с еднакви дисперсии. Влиянието на диетата и тъканите върху дисперсията на модела на разпределение на мастните киселини беше анализирано със статистическия пакет SAS (SAS 1989).
За химичен анализ на профилите на мастните киселини, диетичните проби и различни тъкани от три мишки на диетична група се събират отделно в епруветки от 15 ml, които се пълнят с газ азот. Всички тъкани бяха претеглени, прехвърлени в епруветки и покрити отново с азотен газ, за да се предотврати окисляването на мастни киселини по време на съхранение при -18 ° C. За анализ в серума бяха събрани шест серума на група, за да се получи достатъчно материал за анализа. Определянето на профилите на мастните киселини включва количествено определяне на SFA C10: 0, C12: 0, C14: 0, C15: 0, C16: 0, C17: 0, C18: 0, C20: 0, C21: 0, C21: 0 и C24: 0, мононенаситените мастни киселини (MUFA) C14: 1, C15: 1, C16: 1, C17: 1, C18: 1, C18: 1, C20: 1, C22: 1 и C24: 1, и полиненаситените мастни киселини (PUFA) C18: 2 n – 6, C18: 3 n – 3, C18–4 n – 3, C20: 2, C20: 3 n – 6, C20: 4 n – 6, C20: 5 n – 3, C22: 2, C22–5 и C22–6 n – 3. Точността на измерванията на компонентите на мастните киселини на 100 g беше, както следва:> 5 g/100 g мазнини ± 10%, 1–5 g/100 g мазнини ± 10–15%, 0,5–1 g/100 g мазнини ± 20 % и Y i = μ + Диета + ε i
Статистическите тестове бяха извършени с модифициран F статистика, Fs, който включва оценки на свиване на дисперсионните компоненти (13). P стойностите са получени чрез пермутиране на остатъците от модела 1000 пъти (допълнителна фигура S1). 1 Изчисленията бяха извършени с пакета R/MAANOVA (56). Честотата на фалшивите открития (FDR) за статистически значими сонди е оценена с q стойности (46).
Корелационен анализ и анализ на основните компоненти.
Двойните корелации между вариационните компоненти на диференциално експресирани гени от модела ANOVA за взаимодействие между тъканите и диетите и компонентите на мастните киселини бяха изчислени като коефициент на корелация на Пиърсън.
Показано е, че анализът на основните компоненти (PCA), приложен към отделни компоненти на дисперсията в модел ANOVA, дава представа за ефекта от лечението върху данните за генната експресия (15). Приложихме PCA към компонентите на дисперсията от модела на взаимодействие ANOVA по тъкан по диета заедно с компонентите на мастните киселини C16: 0, C16: 1, C18: 0, C18: 1, C18: 2 n – 6 и C18: 3 n – 3 в различни тъкани и диетични условия. Дисперсионните компоненти от модела на взаимодействие тъкан по диета се комбинират със стандартизираните измервания на състава на мастните киселини за всяка тъкан и състояние на диетата за PCA анализа. Първите четири основни компонента обясниха 90% от вариацията. Биплот на първите четири основни компонента е показан на фиг. 4. Хотелинг т 2 статистика беше изчислена за всеки ген и компонент на мастна киселина като
Обогатяване на пътеката.
Консорциумът за генна онтология създаде контролиран речник, генна онтология (GO), за да опише взаимоотношенията между гените и генните продукти (26). Киото енциклопедия на гените и геномите (KEGG) са разработени, за да опишат връзките по метаболитни, сигнални и болестни пътища (28). Приложихме два вида анализи на пътеки, които имат за цел да уловят различни аспекти на обогатителния сигнал, за да открият свръхпредставени категории KEGG и GO.
Бяха проведени хипергеометрични тестове с пакета GOstats за откриване на обогатени биологични категории (19). Генната вселена (фон) беше дефинирана като 12 656 уникални идентификатора на ген Entrez, присъстващи в набора от данни. Геновите набори бяха тествани за значимост на праговото ниво P стойност X ¯ = 1 m ∑ g ∈ c s g
Физиологични промени поради хранене с високо съдържание на мазнини.
Таблица 1. Отлагане на мазнини в тъканите
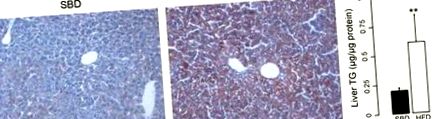
Фиг. 1.Маслено червено оцветяване, показващо стеатоза при мишки на диета с високо съдържание на мазнини (HFD). A: отлагане на мазнини в чернодробна тъкан на мишки при стандартна диета за разплод (SBD). Б.: високо отлагане на мазнини при мишки на HFD. ° С: съдържание на триглицериди (TG) в черния дроб на мишки, хранени със SBD и HFD. **P
Таблица 2. Сгънати промени на избрани гени, повлияни от диетата
Стойностите се променят пъти (HFD срещу SBD). В случаите, когато> 1 транскрипт представлява ген, промяната на гънките, съответстваща на най-значимата транскрипция (най-малката P стойност) е представена. Пълен списък на абсолютните нормализирани стойности на експресия на транскриптите на всички гени, диференцирано експресирани в поне 1 тъкан в отговор на диетата, е даден в допълнителна таблица S5. Данни за нормализирани изрази също са достъпни чрез базата данни на Gene Expression Omnibus (GEO) (номер за присъединяване 15822). Удебелен шрифт, значително регулиран; курсив, значително регулиран.
Таблица 3. Измервания на серума
Фиг. 2.A: глюкозен клирънс при мишки на SBD или HFD след интраперитонеално инжектиране на глюкоза след 9-часово гладуване. Б.: площ под кривата (AUC). *P
Фиг. 3.Процент на наситени мастни киселини (SFA), полиненаситени мазнини (PUFA) и мононенаситени мазнини (MUFA) в диетата, серума и тъканите на мишки, хранени със SBD (A) и HFD (Б.). НЕТ, кафява мастна тъкан; Glut, Gon, Mes, Ret, Sub, гонадни, глутеални, мезентериални, ретроперитонеални и подкожни бели мастни тъкани.
Таблица 4. Състав на мастните киселини в диетите, серума, мастните тъкани, черния дроб и мускулите
Измерванията на серума са получени от обединен серум от 6 животни. Съставите на мастните киселини в тъканите се основават на 3 отделни измервания от 3 отделни животни. Стойностите се изразяват като грам специфична мастна киселина на 100 g общо мастни киселини. Диетата оказва влияние върху дела на всички мастни киселини, с изключение на стеариновата киселина (C18: 0). Ефект върху тъканите е очевиден за всички мастни киселини. С16: 0, палмитинова киселина; С16: 1, палмитолеинова киселина; С18: 1, олеинова киселина; С18: 2 п-6, линолова киселина; С18: 3 п-3, а-линоленова киселина; SFA, наситени мастни киселини; MUFA, мононенаситени мастни киселини; PUFA, полиненаситени мастни киселини.
Таблица 5. Резултати за обогатяване за пътища на KEGG, свързани с диета с високо съдържание на мазнини
Праговете от +2 и -2 бяха използвани, за да се определи значително регулиране нагоре и надолу в пътя на Киото енциклопедия на гените и геномите (KEGG), съответно. The т статистиката е използвана като доказателство на ниво ген за изчисленията. Удебелен шрифт, значително регулиран; курсив, значително регулиран.
В съответствие с високата наличност на мастни киселини и прекомерното съхранение на мазнини, гените, които кодират ензими за биосинтез на мастни киселини (напр. Aacs, Acaca, Acacb, Acly) и удължаване на мастните киселини (Elovl6), бяха силно регулирани в тъканите и сред горните 10 най-силно регулирани нагоре/надолу гени (Таблица 2). При WAT, докато повечето метаболитни пътища бяха потиснати (Таблица 5), фасилитаторите на бета-окисление (Acadm, Acadl, Acsl1) бяха активирани в повечето WAT при условия на HFD (Таблица 2). По този начин относителното намаляване на SFA в сравнение с MUFA може да се дължи и на предпочитано окисление на SFA при мишки, хранени с HFD.
Профилите на мастните киселини се свързват с транскрипционни промени.
Осемсто шестдесет гена са значително корелирани (P стойност
Фиг. 4.Анализ на основните компоненти (PCA) за първите 4 основни компонента (PC) (PC1 срещу PC2, A; PC1 срещу PC3, Б.; PC1 срещу PC4, ° С), които представляват 90% от променливостта в PCA анализа на данните за състава на мастните киселини и компонентите на дисперсията от модела на взаимодействие ANOVA Y.i = μ + Диета + Тъкани + Диета: Тъкани + εi. Точките представляват резултатите за сондите (синьо), а за компонентите на мастните киселини (червено) PCA натоварванията са показани като черни линии. Списък на гени, които корелират със съдържанието на мастна тъкан на палмитинова (С16: 0), стеаринова (С18: 0), палмитолеинова (С16: 1) и олеинова (С18: 1) киселини е дадена в допълнителна таблица S6.
Ефектите на HFD върху гените и пътищата са тъканно специфични.
Използвани са ANOVA модели за определяне на разлики, дължащи се на HFD във всяка тъкан. Диференциалният израз се определя на праговото ниво P стойност 1 Онлайн версията на тази статия съдържа допълнителни материали.
ПРИЗНАВАНИЯ
Благодарим на Stephan Scherneck за определянето на чернодробните триглицериди.
- Намалява риска от сърдечно-съдови заболявания 🍹 Японската диета отслабва 13 дни 💊 - Кино на Източното крайбрежие
- Начин на живот и диетични фактори във връзка с риска от хронична миелоидна левкемия при диетата на NIH-AARP
- Средиземноморската диета с поведенческа подкрепа подобрява спазването на плана за хранене, рисковите фактори за CV
- Как диетата с високо съдържание на мазнини и загубата на естроген кара жените да съхраняват повече мазнини в корема, отколкото мъжете -
- Начин на живот и диетични фактори във връзка с риска от хронична миелоидна левкемия при диетата на NIH-AARP
- Подхранвайте здравословно готвене Видео Ванилова подправена елда каша с ягоди д
- Преминаване на вашето бебе към храна с пръсти - подхранвайте живота
- Сини устни Причини, снимки и лечения
- Палео за вегетарианци Палео скок
- Сена; Herb Encyclopedia Flora Health; НАС
- Знаменитости, които танцуваха тежестта на Dancing With the Stars
- Хөдөлмөрийн аюулгүй байдал, ерүүл ахуйн сарын аян Орхон аймаг - Ердэнэт хот
- Купете Brainstorm Nootropics - НЕ ИЗДАВАЙТЕ Picamilon - 90 Вегетариански капсули на адрес
- Анфиса Чехова губи фенове
- Сменящият играта сензор за кожата може да подобри живота на милион пациенти с хидроцефалия, подобни на Band-Aid
