Филипо Локри
1 Катедра по биология, Университет в Пиза, през San Zeno 31, 56127 Пиза, Италия; [email protected] (F.L.); [email protected] (MC); [email protected] (M.D.M.)
Маурицио Камалери
1 Катедра по биология, Университет в Пиза, през San Zeno 31, 56127 Пиза, Италия; [email protected] (F.L.); [email protected] (MC); [email protected] (M.D.M.)
2 Междуведомствен изследователски център Nutrafood ‘‘ Нутрицевтици и храна за здраве ’’, Университет в Пиза, via del Borghetto 80, 56124 Пиза, Италия
Алесандро Пини
3 Катедра по експериментална и клинична медицина, Университет във Флоренция, Viale Pieraccini 6, 50139 Firenze, Италия; [email protected]
Масимо Дал Монте
1 Катедра по биология, Университет в Пиза, през San Zeno 31, 56127 Пиза, Италия; [email protected] (F.L.); [email protected] (MC); [email protected] (M.D.M.)
2 Междуведомствен изследователски център Nutrafood ‘‘ Нутрицевтици и храна за здраве ’’, Университет в Пиза, via del Borghetto 80, 56124 Пиза, Италия
Дарио Русияно
4 Sooft Italia SpA, Contrada Molino 17, 63833 Montegiorgio (FM), Италия; [email protected]
Паола Баньоли
1 Катедра по биология, Университет в Пиза, през San Zeno 31, 56127 Пиза, Италия; [email protected] (F.L.); [email protected] (MC); [email protected] (M.D.M.)
Свързани данни
Резюме
1. Въведение
2. Материали и методи
2.1. Животни
2.2. Индукция на EAE
2.3. Хранителна добавка
В съответствие с предишно проучване [5], 9 третирани с MOG мишки и девет контроли, получени чрез орален сондаж (започвайки от деня на имунизацията до деня 16, когато животните са умъртвени) смес от наситени и ненаситени животински животни, включително 20% от наситени ФА, докато 17,5% от ненаситени ФА. От тази смес 3,75 mg, суспендирани в 200 μL 10% захароза във вода, се прилагат на животните. Съставът на сместа е описан по-рано [5].
2.4. Изолиране на обща РНК и протеини
Мишките бяха дълбоко обезболени и евтаназирани чрез дислокация на шийката на матката. Ретините се дисектират бързо и се съхраняват при -80 ° C до употреба. За всеки анализ бяха използвани девет независими проби, всяка съдържаща две ретини от две мишки за експериментално състояние. Общата РНК и протеини бяха извлечени с помощта на AllPrep РНК/протеинов комплект (Qiagen, Валенсия, Калифорния, САЩ) съгласно инструкциите на производителя.
2.5. Количествена PCR в реално време
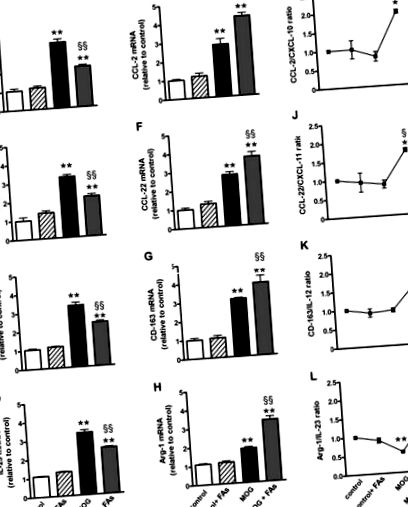
СДНК от първа верига се генерира от 1 μg обща РНК (QuantiTect Reverse Transcription Kit, Qiagen, Валенсия, Калифорния, САЩ). PCR амплификация в реално време беше извършена с SsoAdvanced Universal SYBR Green Supermix (Bio-Rad Laboratories, Hercules, CA, USA) на CFX Connect PCR система за откриване в реално време и софтуер CFX мениджър (Bio-Rad Laboratories, Hercules, CA, USA ). qPCR комплекти праймери за CXC мотив хемокин (CXCL) -10, CXCL-11, IL-12, IL-23, CC мотив хемокин (CCL) -2, CCL-22, клъстер на диференциация-163 (CD-163) и Arg-1 бяха избрани да хибридизират до уникални региони на подходящата генна последователност (виж Таблица S1 за пълен списък на анализирани гени и праймери). Ефективността на усилване беше близо 100% за всяка двойка праймери (софтуер Opticon Monitor 3, Bio-Rad Laboratories, Hercules, CA, USA). Целевите гени бяха анализирани едновременно с Rpl13a: ген, кодиращ рибозомния протеин L13A. Пробите се сравняват, като се използва относителният прагов цикъл (Ct метод). Увеличението или намаляването (промяна в пъти) се определя по отношение на контролните мишки след нормализиране до Rpl13a. Всички реакции се провеждат в три екземпляра.
2.6. Западно петно
Проби, съдържащи 30 μg протеини, се подлагат на SDS-PAGE и като контрол на натоварването се използва β-актин. Геловете се трансплантират върху PVDF мембрана и петната се блокират в 3% обезмаслено мляко за 1 h при стайна температура, последвано от инкубация през нощта при 4 ° С с антитела, изброени в таблица S2. Блотите бяха инкубирани за един час при стайна температура с конюгирани с HRP вторични антитела (1: 5000) и разработени с подсилен хемилуминесцентен субстрат Clarity Western (Bio-Rad Laboratories, Inc., Херкулес, Калифорния, САЩ), получени бяха изображения (ChemiDoc XRS +; Bio-Rad Laboratories, Inc., Hercules, CA, USA) и оптичната плътност (OD) на лентите беше оценена (Image Lab 3.0 софтуер; Bio-Rad Laboratories, Inc., Hercules, CA, USA). Данните бяха нормализирани към съответния OD на β-актин, преобразувателя на сигнала и активатора на транскрипция 3 (STAT3) или ядрения фактор каппа-усилвател на лека верига на активирани В клетки (NF-кВ), както е подходящо. Всички експерименти бяха проведени в два екземпляра.
2.7. Електронна микроскопия и количествен анализ
2.8. Електроретинография
ERG в пълно поле се записва с помощта на стимулатор на Ганцфелд (Biomedica Mangoni, Пиза, Италия). След тъмно адаптиране през нощта, мишките бяха подготвени за записване при слаба червена светлина и анестезирани чрез интраперитонеално инжектиране на Avertin. Зениците се разширяват с 0,5% атропин, роговицата се напоява периодично с физиологичен разтвор, за да се предотврати замъгляването на очната среда и се използва нагревателна подложка за поддържане на телесната температура на 37 ° C. ERG отговорите бяха записани чрез сребърни/сребърно-хлоридни роговични електроди и челен референтен електрод и върху опашката беше поставен заземен електрод. Фотопични, медиирани от конуса отговори бяха записани след 10-минутна адаптация на светлината при интензитет на фоновата светлина от 30 cd/m 2. Записите бяха получени при интензитет на светлината 3 cd-s/m 2. От всяко животно бяха записани 10 форми на вълната и стойностите бяха осреднени. Фотопичният отрицателен отговор (PhNR) беше идентифициран като първото отрицателно отклонение след b-вълната и неговата амплитуда беше изчислена спрямо изходната линия (0 μV). Стойностите на амплитудите на PhNR бяха сравнени между групите.
2.9. Статистически анализ
Схематична диаграма, изобразяваща ролята на FA в модела EAE. MOG предизвиква имунен отговор, водещ до инфилтрация на макрофаги. Инфилтриращите макрофаги могат да придобият различни фенотипове M1 или M2, от които M1 произвежда провъзпалителни цитокини и активира възпалителни процеси, докато M2 играе роля в блокадата на възпалението и насърчава възстановяването на тъканите. Индуцираното от FAs инхибиране на M1 фенотип (червени стрелки) и FAs-индуцираното активиране на M2 фенотип (зелени стрелки) се съчетават, за да предотвратят възпалителни процеси в ретината, като по този начин възпрепятстват увреждането на зрителния нерв и смъртта на ганглиозните клетки на ретината (RGC), събития, които участват за противодействие на дисфункцията на електроретинограмата (ERG).
- Обогатяване на диетата с мляко и млечни продукти с n-3 мастни киселини Преглед - ScienceDirect
- Диетичните омега-3 полиненаситени мастни киселини променят състава на мастната киселина на черния дроб и плазмата
- Диетичните полиненаситени мастни киселини увеличават оцеляването и намаляват бактериалното натоварване по време на септични
- Мастни киселини, триацилглицероли и стерини в масло от Neem (Azadirachta Indica A
- Мастноразтворими витамини в майчината диета, влияние на добавките от масло от черен дроб на треска и въздействие на