Резюме
Значението на BHMT реакцията към хомеостезиновата хомеостаза напоследък стана фокус на голям интерес. Това се подчертава в изследването на de Costa et al. (4), което показва значително увеличение на плазмения хомоцистеин при пациенти с дефицит на холин. При лица с дефицит на цистатионин β-синтаза (CBS) или метилентетрахидрофолат редуктаза (MTHFR) пероралното добавяне на бетаин води до значително намаляване на общия хомоцистеин (29, 35, 36, 45). Успехът на това лечение може да се отдаде на увеличения поток чрез BHMT. Съобщава се за значителна отрицателна корелация между плазмените концентрации на бетаин и хомоцистеин при хора със сърдечно-съдови заболявания (35).
Съществуват значителни доказателства, че метаболизмът на хомоцистеина може да се регулира от редица хормони. Хидрокортизонът повишава чернодробната BHMT активност, докато лечението с тироксин води до значително намаляване на тази ензимна активност (5). Ние (16, 26) по-рано показахме, че пътят на транссулфуриране се засилва в стрептозотоцин-индуцирания диабет плъх и в глюкокортикоид-стимулираните клетки на хепатоми на плъхове и се потиска чрез лечение с инсулин. Наскоро ние (46) установихме, че активността и експресията на BHMT са повишени при диабетните мастни плъхове на Zucker, отличен модел за диабет тип 2. Neiman и сътр. (24) наблюдават повишаване на BHMT активността в черния дроб на стрептозотоцин-диабетични плъхове, модел за диабет тип 1. Въпреки че диетичното регулиране на BHMT е добре документирано, основата за пряката връзка между хормоналните промени и регулацията на BHMT остава нерешена. Целта на настоящото проучване беше да се изследва ролята на инсулина и глюкокортикоидите в регулирането на активността на BHMT и генната експресия, използвайки модел 1 (индуциран от стрептозотоцин) диабетни плъхове и клетъчна линия на плъхове.
Материали.
Мъжки плъхове Sprague-Dawley са получени от звеното за грижа за животните на Memorial University of Newfoundland. Човешкият инсулин Novolin ultralente е от Eli Lilly (Indianapolis, IN). Маркиран с радио [метил- 14 С] бетаин и [метил- 14 C] холин хлорид са закупени от American Radiochemical (Сейнт Луис, Мисури). Йоннообменната смола Dowex 50W-X4 е от Bio-Rad (Херкулес, Калифорния). Клетки H4IIE (хепатом на плъх) са получени от American Type Culture Collection (Manassas, VA). Модифицираната среда на Dulbecco Eagle’s (DMEM), трипсин-EDTA, фетален говежди серум (FBS), пеницилин, стрептомицин и други материали за тъканна култура са закупени от Invitrogen Canada (Burlington, ON, Canada). Триамцинолонът и инсулинът са от Sigma Chemicals (Oakville, ON, Канада). RNAlater беше от Ambion (Austin, TX). Едноетапният RT-PCR комплект е от Qiagen (Mississauga, ON, Канада). Грундовете BHMT са изработени по поръчка на Invitrogen Canada. Комплекти за усилватели на β-актин от плъх са закупени от CloneTech (Palo Alto, CA). Комплектът за анализ на протеин за бицинхонинова киселина (BCA) е от Pierce Chemical (Rockford, IL). Всички други използвани реагенти са получени в търговската мрежа и са с най-висока налична чистота.
Животни и процедури in vivo.
Клетъчна култура.
H4IIE клетки се отглеждат в 75 cm 2 колби за култивиране в DMEM, съдържащи 10% vol/vol FBS, 100 U/ml пеницилин и 100 μg/ml стрептомицин. Те бяха култивирани под 5% CO2 във овлажнен инкубатор при 37 ° C, докато клетките се сляха на 70–75%. Средата беше сменена на DMEM, съдържаща 0.5% FBS и култивирана в продължение на една нощ. Клетките се инкубират в продължение на 1 час в прясна среда, съдържаща 0,5% FBS, след което средата се променя отново до среда, съдържаща 0,5% FBS и подходящи концентрации на хормони. След това плаките се инкубират със или без хормони при 37 ° С за различни периоди от 0 до 48 часа. В края на инкубацията среда се аспирира и клетките се измиват веднъж с ледено охладен с фосфат буфериран физиологичен разтвор. Клетъчната жизнеспособност се наблюдава чрез теста за изключване на трипан синьо и се установява, че е> 98%.
Аналитични процедури.
Концентрациите на хомоцистеин бяха определени с помощта на HPLC (42). Този метод измерва общия хомоцистеин (както свободни, така и свързани с протеини форми). Плазмената глюкоза се определя ензимно (1). Концентрацията на протеин в чернодробните проби се определя по метода на Biuret, като се използва говежди серумен албумин (BSA) като стандарт. Концентрациите на протеини в клетъчните екстракти на H4IIE бяха измерени чрез анализ на BCA протеин (39).
Ензимни анализи.
BHMT анализите в черния дроб се извършват, както е описано по-горе (8). H4IIE клетъчни екстракти бяха анализирани за BHMT по същество, както е описано (8), с изключение на това, че бяха използвани по-високи концентрации на бетаин (250 μM, 1 μCi) и инкубациите бяха проведени в продължение на 3 часа. Холин дехидрогеназата (CDH) се анализира в чернодробни хомогенати по същество, както е описано, с няколко модификации (10). Накратко бяха използвани 0,15 mg протеин за анализ и инкубациите бяха проведени в продължение на 7,5 минути в 3,5 mM Tris (pH 7,6), 350 μM EDTA, 700 μM β-меркаптоетанол, 350 μM CaCl2, 0,3% (тегл./Об.) Феназин метосулфат и 500 μM [метил- 14 C] холин (0,2 μCi) в общ обем 50 μl. След като реакцията беше спряна чрез прехвърляне на епруветките в ледена баня, бяха добавени 20 μl ледено студен NaOH и 15 μl 30% H2O2 и сместа беше оставена да престои 1 h при стайна температура. След добавянето на 415 μl ледено студена вода, цялата реакционна смес се зарежда в миниколони (0.9 × 2.0 cm), съдържащи 50W-X4 100-200 меша (H +) смола (предварително уравновесена с 1 M LiOH). Колоните се измиват шест пъти с 833 μl вода. Измиванията се обединяват, аликвотна част (2,5 ml) се добавя към 17 ml сцинтилационна течност Scintiverse (Fisher Scientific, Ottawa, ON, Канада) и радиоактивността се отчита в сцинтилационен брояч LKB Wallac 1214 RackBeta.
Определяне на S-аденозил-1-метионин и S-аденозил-1 -хомоцистеин.
Замразеният черен дроб се хомогенизира в ледено студена 8% трихлороцетна киселина. Хомогенатите се центрофугират при 13 000 ж за 5 минути при 4 ° С. Супернатантите се анализират чрез HPLC, като се използва колона Vydac C18 (модел 2187P54), която се уравновесява с 96% от буфер А (50 mM NaH2PO4, съдържащ 10 mM хептансулфонова киселина при рН 3.2) и 4% ацетонитрил. SAM и С-аденозил-1-хомоцистеин (SAH) се разделят чрез използване на градиент от 96–80% от буфер А и 4–20% ацетонитрил за 15 минути. Пиковете на SAM и SAH бяха открити при 258 nM и бяха изчислени с помощта на софтуера Millennium 32 (версия 2) (Waters, Milford, MA).
Обратна транскриптаза-полимеразна верижна реакция.
Обща РНК беше изолирана от H4IIE клетки, както е описано (26). Общата РНК се приготвя от замразени дробчета чрез бърз метод на гуанидиниев тиоцианат (2). Общата РНК (2 μg) беше обратно транскрибирана с помощта на комплект за обратна транскрипция в една стъпка и беше амплифицирана. Фрагмент от 1,219 bp (нуклеотиди +5 до +1224 спрямо началния кодон) на BHMT се амплифицира, като се използват следните праймери: 5'-ACCGATTGCCGGCAAGAA-3 'и 5'-CTGTGCGGATTTGAATTTTTG-3'. 764-bp фрагмент от β-актин на плъх беше съвместно амплифициран, използвайки праймери с набор от амплимер. PCR продуктите се разделят на 1% агароза. Лентите, оцветени с етидиев бромид, се визуализират чрез UV осветление. Петната бяха сканирани с ChemiImager 4000 и количествено определени със софтуера Alphaease (Alpha Innotech, San Leandro, CA).
Базиран на PCR ядрен анализ на протичане.
Статистически анализ.
Всички данни са анализирани от софтуера GraphPad Prism. Данните са представени като средно ± SD за шест отделни експеримента, освен ако не е посочено друго. Статистическите сравнения бяха направени с помощта на еднопосочен дисперсионен анализ, последван от тест за многократно сравнение на Newman-Keuls. A P стойност на 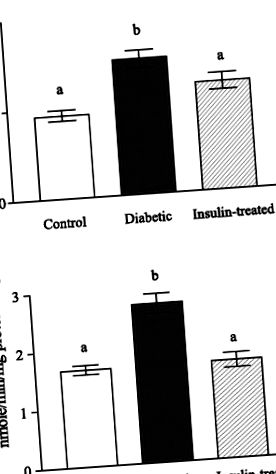
Фиг. 1.A: активност на бетаин-хомоцистеин метилтрансфераза (BHMT) в контрола, нелекувани диабетици и лекувани с инсулин плъхове с диабет. Б.: активност на холиндехидрогеназа в контрола, нелекувани диабетици и лекувани с инсулин плъхове с диабет. Данните са изразени като средства (SD); н = 6. Разликите в буквите над лентите означават значителни разлики (P
Фиг. 2.A: RT-PCR анализ на общата чернодробна РНК при контролни и диабетични плъхове. Б.: денситометрично количествено определяне на BHMT иРНК. ИРНК на BHMT се нормализира до нивата на β-актин. Данните представляват средства (SD); н = 6. Разликите в буквите над лентите означават значителни разлики (P
Ефект на диабета върху чернодробните концентрации на SAM и SAH.
Чернодробните концентрации на SAM и SAH са били значително повишени при стрептозотоцин-индуцирани диабетични плъхове; Концентрациите на SAM са с 25% над контролните стойности, а концентрациите на SAH са увеличени с 122%. Въпреки че лечението с инсулин намалява нивата както на SAM, така и на SAH, нивата им остават по-високи от нормалните. Съотношението SAM/SAH намалява при диабет. Лечението с инсулин води до увеличаване на съотношението SAM/SAH. Въпреки това той остава по-нисък от контролните стойности (табл. 1).
маса 1. Чернодробни SAM и SAH при контролни, диабетични и лекувани с инсулин диабетични плъхове
Резултатите са изразени като средни стойности (SD) за 6 животни. SAM, С-аденозил-1-метионин; SAH, С-аденозил-1 -хомоцистеин. Различията в горните букви представляват значителни разлики в редовете, P
Фиг. 3.A: BHMT активност в клетки H4IIE, третирани с триамцинолон (1 μM) в присъствието или отсъствието на инсулин (1 μM) в продължение на 18 часа. Данните представляват средства (SD) на 6 отделни експеримента. Резултатите се изразяват като U/mg, където единица се определя като 1 nmol произведен метионин (консумиран бетаин) на час. Разликите в буквите над лентите означават значителни разлики (P
Фиг. 4.A: RT-PCR анализ на BHMT иРНК в H4IIE клетки, стимулиран с нарастващи концентрации на триамцинолон. Б.: RT-PCR анализ на BHMT иРНК в третирани с триамцинолон (1 μM) H4IIE клетки в присъствието на нарастващи концентрации на инсулин.
Ефект на триамцинолон и инсулин върху скоростта на транскрипция BHMT.
Промените в скоростта на транскрипция на BHMT в отговор на глюкокортикоиди и инсулин бяха определени чрез PCR-базирани ядрени експерименти. Ефектите на тези хормони върху скоростта на транскрипция BHMT успоредно с ефектите върху нивата на BHMT иРНК (Фиг. 5). Триамцинолон увеличава скоростта на транскрипция BHMT и инсулинът премахва този ефект. Следователно инсулинът играе пряка роля в регулирането на транскрипцията на BHMT.
Фиг. 5.Ядрен анализ на скоростта на транскрипция на BHMT в клетките на H4IIE. A: изолирани са ядра от контролни, третирани с триамцинолон и триамцинолон + клетки, третирани с инсулин, и е извършен PCR-базиран ядрен анализ на транскрипция. Показани са относителни скорости на транскрипция на BHMT и β-актин, извършени в присъствието или отсъствието на rNTPs. Б.: денситометричен анализ на скоростта на транскрипция на BHMT. Данните представляват средства (SD) на 3 отделни експеримента. Разликите в буквите над лентите означават значителни разлики (P
В заключение, преките и специфични ефекти на глюкокортикоидите върху индукцията на BHMT и нейното потискане от инсулина, демонстрирани в тази работа, дават нови прозрения в механизма, чрез който инсулинът регулира метаболизма на хомоцистеин, силно атерогенна аминокиселина. Специфичният механизъм, чрез който инсулинът медиира своя инхибиторен ефект върху транскрипцията на BHMT, остава да бъде определен.
Тази работа беше подкрепена от безвъзмездни средства от Канадските институти за здравни изследвания (JT Brosnan), Канадската диабетна асоциация (Neil M. Miller грант за JT Brosnan и ME Brosnan) и от Националния институт по диабет и храносмилателни и бъбречни заболявания грант DK-52501 до TA Garrow. С. Ратнам е получил постдокторска награда на Одри Б. Кашман от Канадската диабетна асоциация, а Е. П. Уиджкоон е получил стипендия от Университета на Мемориал в Нюфаундленд.
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. Раздел 1734 единствено, за да посочи този факт.
Благодарна е експертната техническа помощ от Яна Стракова.
- Цитрусовите плодове могат да помогнат за предотвратяване на свързани със затлъстяването сърдечни заболявания, чернодробни заболявания, диабет -
- Диабет, преброяващ въглехидрати, ако използвате инсулин CS Mott Детска болница Мичиган Медицина
- Диабет и алкохолни ефекти на алкохола върху диабета
- Диабет за проследяване на кръвната глюкоза, инсулин, въглехидрати Log MyNetDiary
- Ефекти от диетите с високо съдържание на мазнини върху биоенергетиката на черния дроб на гризачите и окислителния дисбаланс - ScienceDirect
