Мира Шах
Отдел по ендокринология и метаболизъм Клиника Майо, 200 First ST SW, Рочестър, MN 55905, САЩ
Адриан Вела
Отдел по ендокринология и метаболизъм Клиника Майо, 200 First ST SW, Рочестър, MN 55905, САЩ
Резюме
Подобен на глюкагон пептид 1 (GLP-1) е продукт на разцепване на пре-проглукагоновия ген, който се експресира в α-клетките на панкреаса, L-клетките на червата и невроните, разположени в каудалния мозъчен ствол и хипоталамуса. GLP-1 е от значение за апетита и поддържането на теглото, тъй като има действия върху стомашно-чревния тракт, както и директното регулиране на апетита. Той забавя изпразването на стомаха и подвижността на червата при хората. В допълнение, интервентрикуларните инжекции на GLP-1 инхибират приема на храна, независимо от наличието на храна в стомаха или изпразването на стомаха. Периферно прилаганият GLP-1 също влияе върху централната регулация на храненето. Следователно синергичните действия на GLP-1 в червата и мозъка, действащи както върху централните, така и върху периферните рецептори, изглеждат отговорни за ефектите на хормона върху ситостта.
1 Синтез и секреция на GLP-1
Глюкагоноподобният пептид 1 (GLP-1) е продукт на разцепване на гена на предпроглукагон [1], който се експресира в α-клетките на панкреаса, l-клетките на червата и невроните, разположени в каудалния мозъчен ствол и хипоталамус [2]. GLP-1 се синтезира и секретира предимно от L клетките на дисталното тънко черво в отговор на хранително натоварване, въпреки че се съобщава и за ненутриентна секреция [3, 4]. GLP-1 също се синтезира от малка популация неврони в ядрото на самотния тракт (NTS) в каудалния мозъчен ствол, които се проектират към области в хипоталамуса и задния мозък, които експресират GLP-1 рецептори (GLP-1- R) [5 ]. Основните биоактивни видове при хората са GLP-1 (7–36) амид и GLP-1 (7–37).
2 Роля на GLP-1 в ситостта
Сигналите за насищане, произведени чрез активиране на стомашни механични рецептори, когато стомахът е разтегнат, се предават чрез вагусните нерви към NTS в мозъчния ствол. Размерът на стомашно разтягане поради прием на храна е частично повлиян от скоростта на изпразване на стомаха, което от своя страна засяга постпрандиалните гликемични екскурзии. GLP-1 забавя изпразването на стомаха и подвижността на червата при здрави слаби и затлъстели пациенти и пациенти с диабет тип 2 [15-17]. GLP-1 също допринася за промяната в обема на стомаха, която се случва в очакване на поглъщане на храна. Това явление е известно като стомашна акомодация и може да повлияе на възприемането на раздуване на стомаха след поглъщане на храна [18].
Ролята на блуждаещия нерв в насърчаването на ситостта изглежда зависи от начина на приложение на GLP-1, както е показано в експеримент върху ваготомирани плъхове. Интравенозно, за разлика от интраперитонеалната инфузия на GLP-1, не изисква непокътнат вагус, за да намали приема на хранителни вещества [19].
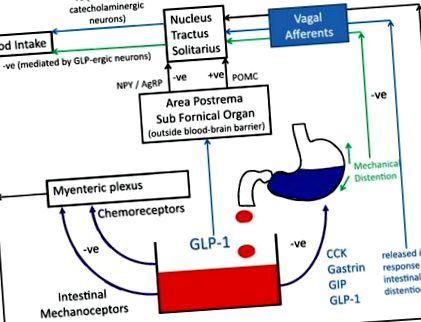
Централните (интервентрикуларни) инжекции на GLP-1 инхибират приема на храна, независимо от наличието на храна в стомаха или изпразването на стомаха [20]. Също така е доказано, че нокаутирането на препроглюкагоновия ген в NTS води до хиперфагия и наддаване на тегло [21]. Отразяващи тези констатации са невроизобразителни проучвания, които показват, че периферно прилаганият GLP-1 влияе върху мозъчната активност в области, участващи в регулирането на храненето [22, 23]. Следователно синергичните действия на GLP-1 в червата и мозъка, действащи както върху централните, така и върху периферните рецептори, изглеждат отговорни за ефектите на хормона върху ситостта (Фиг. 1).
Ролята на GLP-1 в модулирането на апетита. GLP-1 има ефекти върху централните и периферните рецептори. Аферентни клонове на блуждаещия реле предават информация от хеморецепторите и механорецепторите в стомашно-чревния тракт към ядрения тракт солитариус (NTS). Циркулиращите хормони теоретично биха могли директно да стимулират области извън кръвно-мозъчната бариера, въпреки че ролята на този път е с несигурно значение в нормалната физиология (–ve означава инхибиращ ефект, докато + ve означава разрешаващ/усилващ ефект) [72,73,74]
Освен това, интрацеребровентрикуларното приложение на GLP-1 е в състояние да предизвика условна неприязън на вкуса, вероятно поради едновременния ефект върху висцералното усещане [30].
Фармакологичните проучвания при животни показват, че потискането на приема на храна след периферно приложение на рецепторните агонисти на GLP-1 екзендин-4 и лираглутид се медиира чрез активиране на GLP-1R, изразено върху вагусни аферентни фактори, както и директно активиране на GLP-1R на ЦНС, подчертавайки значение на взаимодействието между периферните и централните рецептори [31].
3 Приносът на GLP-1 към бариатричната хирургия
Постпрандиалните концентрации на GLP-1 се повишават след стомашен байпас на Roux-en-Y, наблюдение, което подхранва интереса към изследването на ролята на GLP-1 за медииране на загуба на тегло и ремисия на метаболитни нарушения след операция [32-34]
Всички форми на бариатрична хирургия водят до загуба на тегло в по-голяма или по-малка степен. превъзходството на RYGB над регулируемата стомашна лента и може би гастректомия на ръкавите, подчертава важна разлика между чисто рестриктивни и рестриктивни/малабсорбционни процедури. В сравнение с чисто рестриктивната гастректомия на ръкавите, пациентите с диабет тип 2, подложени на RYGB, показват по-голяма загуба на мастна тъкан и подобрена функция на бета-клетките на 24 месеца, въпреки сравнима ремисия на диабета на 12 месеца [35]. Има някои важни предупреждения към това - това проучване може да бъде критикувано по отношение на малкия (-er) брой на изследваните и разликите между половете между RYGB и SG групите (като по този начин се въвежда конфудер по отношение на първоначалния състав на тялото), ограничаващ обобщаемостта на проучване [36].
Регулируемата стомашна лента (AGB) не предизвиква повишена секреция на GLP-1. Въпреки това, когато плъховете, които са претърпели AGB, са били третирани с GLP-1 агонист, телесното тегло е намаляло, докато лентата е била издута и напомпана. Интересното е, че лентовата инфлация задейства невронно активиране в области на NTS, за които е известно, че са насочени от агонизма на GLP-1 рецептора, предлагайки потенциален механизъм за взаимодействие [37].
Ние и други сме изследвали ролята на ендогенния GLP-1 в метаболизма на глюкозата след RYGB, използвайки Exendin 9,39, конкурентен антагонист на GLP-1 в неговия сроден рецептор [38]. Субектите без диабет, които са били средно 5 години след RYGB и със стабилно тегло, са получавали смесено хранене; глюкозните потоци бяха изследвани в присъствието или отсъствието на Exendin 9,39, инфузиран със скорост 300 pmol/kg/min. Възрастните и тегловните контролни субекти бяха изследвани в подобен експериментален дизайн. 111 In-DTPA етикетирането на твърдата част от храненето позволява измерване на изпразването на стомаха и ороцекалния транзит с гама камера. Установихме, че Exe-9,39 ускорява изпразването на стомаха, което предполага, че след операция на RYGB ендогенният GLP-1 забавя стомашно-чревния транзит. Измерването на изпразването на стомаха с помощта на сцинтиграфия под въздействието на екзендин 9,39 при иначе здрави хора е показало или никакъв ефект, или ускорено изпразване на стомаха [39, 40].
Макар и важен, големината на приноса на GLP-1 за загуба на тегло и ремисия на метаболитни аномалии след бариатрична хирургия беше оспорена от Wilson-Perez et al. които са изследвали гастректомия с вертикален ръкав в модели на нокаутирани рецептори на GLP-1 [41]. Тези мишки, в сравнение с техните колеги от див тип, реагират по подобен начин по отношение на намалено телесно тегло и телесни мазнини, подобрения в хомеостазата на глюкозата и променен избор на храна. Тези интригуващи открития могат да освободят GLP-1 от медиирането на голяма част от полезните резултати след гастректомия с вертикален ръкав, но не е задължително да се прилагат за RYGB, който също преконфигурира анатомията, като премества дисталното тънко черво до постъпващите хранителни вещества от стомаха и заобикаля проксималното тънко черво.
Дали GLP-1 допринася за загубата на тегло, наблюдавано след бариатрична операция, предстои да се определи.
4 Роля на GLP-1 в стомашно-чревния тракт
Изглежда, че GLP-1 влияе върху стомашно-чревната подвижност чрез действието си върху централните и периферните рецептори. Блуждаещият нерв играе важна роля за посредничеството на тези ефекти, както е показано както на животински, така и на човешки модели, може би чрез действието си върху кръговия мускул на червата [16, 42-44]. При модели на мишки беше установено, че GLP-1 инхибира чревната подвижност чрез директното взаимодействие и активиране на GLP-1R върху ентеричните неврони [44]. Когато GLP-1 се влива директно в интрацеребровентрикуларното пространство на плъхове, стомашното изпразване се инхибира, което предполага взаимодействие между периферни и централни GLP-1 рецептори [45]. За разлика от горната част на стомашно-чревния тракт, в дебелото черво GLP-1 служи за ускоряване на транзита на дебелото черво ефект, който също е вероятно медииран от парасимпатиковата нервна система [46, 47]. В допълнение, GLP-1 допринася за илеалната спирачка, инхибиторна обратна връзка, предназначена да оптимизира храносмилането и усвояването на хранителните вещества [48].
Ролята на блуждаещата нервна система при посредничеството на ефектите на GLP-1 върху стомашната акомодация е изследвана от същата група [50]. Две наблюдения предполагат важна роля за блуждаещия нерв: 1. Стомашният тонус се поддържа от вагусния холинергичен принос. 2. Постпрандиалното освобождаване на панкреатичен полипептид (под вагусен контрол) е притъпено в присъствието на GLP-1.
Групата е изследвала пациенти с диабет и кардиовагална невропатия в същия експериментален дизайн, както преди. GLP-1 не повлиява стомашния обем в тази група, което предполага, че вагиално индуциран механизъм е важен за действието на GLP-1 върху стомаха. Въпреки това реакцията на обема на стомаха при хранене при тези пациенти не се различава в сравнение със здрави доброволци. Това наблюдение илюстрира, че стомашната акомодация след ваготомия се възстановява с времето, както е показано както в проучвания върху животни, така и при хора.
5 Клинични ефекти върху теглото на GLP-базирана терапия
В отговор на хранене, GLP-1 забавя изпразването на стомаха и увеличава обема на стомаха. GLP-1 усилва секрецията на инсулин и инхибира освобождаването на глюкагон по глюкозозависим начин както при нормални индивиди, така и при пациенти с диабет тип 2 [51]. При пациенти с диабет тип 2 вливането на агонист на GLP-1 във фармакологични дози засилва засищането и насърчава загубата на тегло [52]. Следователно GLP-1 терапията при хора намалява приема на храна, апетита и глада и насърчава пълнотата и ситостта с крайния резултат от насърчаването на загуба на тегло.
Рандомизирано плацебо-контролирано проучване на GLP-1 агонистична терапия (екзенатид) при затлъстели юноши доведе до умерена загуба на тегло, ефект, който е еквивалентен или по-добър от подобна продължителност на терапията с метформин или орлистат при тази група пациенти [63]. Най-често съобщаваните странични ефекти на гадене и повръщане са подобни на тези, съобщени в литературата за възрастни и не водят до отпадане от проучването.
Загубата на тегло, наблюдавана при терапия с агонист на GLP-1, може да бъде свързана с намаляване на общите телесни мазнини, по-специално висцерална и тръбна мастна [64, 65].
Интерес представлява и успешното използване на GLP-1 агонисти при лечението на хипоталамусно затлъстяване, което предполага, че поне в тази кохорта аналозите на GLP-1 са способни да предизвикат загуба на тегло въпреки увреждането на хипоталамуса [66].
За разлика от чисто диетичните мерки, загубата на тегло може да се запази до период от 3 години в присъствието на GLP-1 агонистична терапия [67, 68]. След като терапията бъде прекратена, има известно възстановяване на теглото [69]. Изглежда, че има минимален ефект на GLP-1 върху разхода на енергия сам по себе си и по този начин общият отрицателен енергиен баланс, наблюдаван при терапия с GLP-1, е до голяма степен резултат от намаления енергиен прием [70].
6 Заключение
Ролята на GLP-1 в модулацията на апетита и теглото е организирана от сложна връзка между мозъка и червата. GLP-1 се секретира предимно от ентероендокринните клетки, но освен това има източник на GLP-1 от централната нервна система. Активирането на GLP-1 рецептори, присъстващи в ЦНС и червата, допълнително се модулира от холинергични сигнали от блуждаещия нерв. Чрез тези и други все още неточни механизми, GLP-1 както във физиологични, така и във фармакологични дози насърчава ситостта, засяга механистичните свойства на стомашно-чревния тракт и води до отрицателен енергиен баланс. Освен това успехът му в насърчаването на загуба на тегло прави терапията с агонист на GLP-1 привлекателна възможност за лечение на диабет тип 2. Това, което трябва да се балансира спрямо това, е съобщената връзка между терапията с агонисти на GLP-1 рецептор и панкреатит, панкреатична хиперплазия и панкреатична неоплазия [71]. Интересно е, че неотдавнашната работа в нов трансгенен модел на мишка потвърждава наличието на GLP-1 рецептори във васкулатурата на екзокринния панкреас само със спорадични GLP-1 рецептори, идентифицируеми в панкреатичните канали [29]. Изводът, че терапията с агонист на GLP-1 е пряко свързана с наблюдаваните неблагоприятни резултати, все още е много за обсъждане.
7 Бъдещи указания
Откритието на GLP-1 предизвика големи иновации в терапията на диабет тип 2, както и по-добро разбиране на взаимодействието между червата и панкреаса за модулиране на глюкозната хомеостаза, както и апетита и теглото. Понастоящем GLP-1 рецепторният агонизъм има относително малки, но значителни ефекти върху теглото. Причините за това все още са несигурни и се полагат усилия за по-добро разбиране на ендогенните фактори, които потискат сигнализирането на GLP-1. Освен това, съединенията, които са агонисти за GLP-1 и за други рецептори, важни за регулирането на теглото, могат да имат бъдещо терапевтично обещание.
Благодарности
Авторите признават подкрепата на Общия клиничен изследователски център на клиниката Mayo (DK TR000135). Д-р Вела се поддържа от DK78646 и от DK82396.
Д-р Вела е получил стипендии за научни изследвания от Merck и Daiichi-Sankyo. Той е изследовател в многоцентрови проучвания, спонсорирани съответно от Novartis и GI Dynamic. Консултирал се е за XOMA, Sanofi-Aventis, Novartis и Bristol-Myers Squibb.
Бележки под линия
Конфликт на интереси Д-р Шах няма съответни разкрития.
Информация за сътрудника
Meera Shah, Отдел по ендокринология и метаболизъм клиника Mayo, 200 First ST SW, Рочестър, MN 55905, САЩ.
Адриан Вела, Отдел по ендокринология и метаболизъм, клиника Майо, 200 First ST SW, Рочестър, MN 55905, САЩ.
- Консумацията на пълнозърнести зърнени храни по време на отслабване влияе върху диетичното качество, диетични фибри,
- Doc Загубата на апетит от лекарства може да доведе до загуба на тегло
- Лекарството за епилепсия води до загуба на тегло, странични ефекти Reuters
- Григор Димитров разкрива странични ефекти за отслабване в продължение на месец след положителен тест за COVID-19, Adria
- Тревен шаран Ефекти от солеността върху оцеляването, отслабването и съдържанието на вода в мускулната тъкан