Резюме
Мозъчният серотонин играе решаваща роля в регулирането на приема на храна и хомеостазата на телесното тегло. Предишни данни предполагат взаимодействие с кортикотропин-освобождаващ хормон (CRH). За по-нататъшно изследване на взаимодействието между тези невротрансмитери, селективният инхибитор на обратното захващане на серотонина (SSRI) флувоксамин се прилага интраперитонеално в фа/фа Zucker плъхове със и без CRH-рецептор-антагонист α-спирален CRH, прилаган интрацеребровентрикуларно (i.c.v.). Третираните с физиологичен разтвор животни наддават на тегло. Флувоксамин доведе до значителна загуба на тегло, като същевременно не влияе върху приема на храна. Освен това нивата на инсулин в този животински модел са намалени след приложение на флувоксамин. Тези ефекти са антагонизирани от α-спирална CRH и следователно най-вероятно се медиират чрез CRH или CRH-подобни пептиди.
Въведение
Селективните инхибитори на обратното поемане на серотонин (SSRI) обикновено се използват като медикаментозно лечение при депресивни разстройства. Известно е, че тези лекарства влияят централно на приема на храна и хомеостазата на телесното тегло. Това е в съответствие с експериментални данни, показващи силни аноректични свойства на серотонина, когато се инжектира в паравентрикуларното ядро (PVN) и други хипоталамусни области. 1,2
В настоящото проучване ние се фокусирахме върху аноректичните свойства на ssri флувоксамин, който е по-специфичен за серотонина в сравнение с други съединения от тази група лекарства, например флуоксетин, оказващи по-малко въздействие върху обратното поемане на норадреналин. 3
Предишни данни показват, че в рамките на PVN, серотонинът и кортикотропин освобождаващият хормон (CRH) взаимодействат, за да променят приема на храна и е показан засилен синтез на CRH в това конкретно ядро след инжектиране на серотонин. 4,5 В допълнение е демонстриран стимулиращ ефект на D -фенфлурамин, освобождаващ серотонин агент, върху невронално активиране на CRH експресиращи клетки в PVN. 6 CRH явно притежава аноректични свойства, когато се инжектира централно. 7 Причинно-следствена връзка между невротрансмитера серотонин и невропептида CRH все още не е доказана. В допълнение към своите аноректични действия, CRH стимулира метаболизма на кафявата мастна тъкан чрез активиране на симпатиковата нервна система при гризачи, когато се прилага централно, 8,9 потенциално причинява увеличение на енергийните разходи.
В фа/фа Zucker-плъхове, иРНК на рецептора CRH2-рецептор е намалена във вентромедиалния хипоталамус (VMH), което предполага евентуално участие на CRH-невроните в намалените енергийни разходи в този генотип; 10 в допълнение хиперинсулинемията при тези животни, която се приписва на повишена активност на вагусните еференти към панкреаса, 11 намалява след локално приложение на CRH върху VMH.
Това проучване беше насочено към по-нататъшно изследване на същността на мозъчния серотонин и взаимодействието на CRH при контрола на телесното тегло, което не е проучвано преди в дългосрочен план in vivo експеримент.
Методи
Хлоралхидратът и α-спиралната CRH са закупени от Sigma Chemie (Deisenhofen, Германия). Флувоксамин малеат е получен от Solvay Duphar. Инсулинът се определя от Insulin RIA 100 от Pharmacia и Upjohn Diagnostics AB, Швеция.
Мъжки хомозигота фа/фа са изследвани плъхове от Harlan-Winkelmann, Borchem, Германия. В началото на експеримента животните бяха на 12 седмици и тежаха между 300 и 400 g. Животните бяха държани в единични клетки при постоянна стайна температура от 23 ° C в продължение на 12 часа светъл и тъмен цикъл и им беше позволено да се адаптират към условията на отглеждане преди операцията в продължение на най-малко 4 дни. Дозировките на α-спирална CRH и флувоксамин са показали, че са ефективни от други автори 12 и са тествани от нас в пилотно проучване.
Животните бяха разпределени в четири експериментални групи: група 1—0,5 ml физиологичен разтвор i.p. и 10 µl физиологичен разтвор i.c.v., н= 7; група 2 - флувоксамин i.p. (25 mg/kg телесно тегло в 0,5 ml физиологичен разтвор) и α-CRH i.c.v. (25 µg в 10 µl физиологичен разтвор), н= 5; група 3 - флувоксамин i.p. (25 mg/kg телесно тегло в 0,5 ml физиологичен разтвор) и 10 µl физиологичен разтвор i.c.v., н= 6; и група 4—0,5 ml физиологичен разтвор i.p. и α-CRH i.c.v. (25 µg в 10 µl физиологичен разтвор), н= 4.
За вземане на кръв се извършва пункция на бедрената артерия и имплантиране на катетър. Хлорал хидрат в доза от 0,4 g на kg телесно тегло се дава i.p. за анестезия. По време на операцията телесната температура се поддържа от регулирана топлинна подложка. Стъклен капиляр беше поставен в лявата странична камера за инжектиране с помощта на стереотаксичен инструмент. Необходимите координати са взети от атласа на Паксинос и Уотсън. 13 През първия следоперативен ден експерименталните животни бяха поставени в специална клетка, осигуряваща свободен достъп до плъха без смущения. След период на адаптация от 30 минути се взема серумна проба за определяне на изходната стойност на инсулина и i.p. беше направена инжекция. След инжектирането се вземат кръвни проби на 30, 60, 90 и 120 минути. Изтегленият обем е заменен с физиологичен разтвор веднага след всяко събиране; общото количество взета кръв не надвишава 1,5 ml за всяко животно. Пробите се центрофугират незабавно; серумът се събира и замразява при -70 ° C до анализ на инсулина.
Приемът на храна и телесното тегло на животните са документирани през следващите 7 дни. Телесното тегло на плъховете е измерено в деня на операцията и веднъж на ден между 12:00 и 14:00 през периода на наблюдение. Експерименталните животни получиха i.p. и i.c.v. лечение в 8 часа сутринта в продължение на седем последователни дни. Плъховете бяха убити между 13:30 и 14:30 ч., В средата на светлинната фаза на цикъла светлина/тъмнина.
Статистическият анализ беше извършен с помощта на SPSS, версия 8.0 за windows. ANOVA за повторни измервания беше извършена върху сурови данни и 2 × 2 ANOVA беше извършена върху нормализирани данни. Tukey's т-тестът беше използван като post hoc тест за сравнение след повторните мерки ANOVA.
Резултати
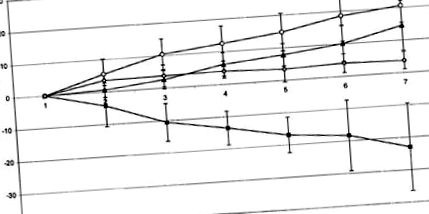
Фигура 1 показва развитието на телесното тегло по време на експеримента. Докато животните, лекувани с комбинация от физиологичен разтвор i.p. и физиологичен разтвор i.c.v. (група 1) са получили общо 20,57 ± 5,63 g телесно тегло в края на проучването, животни, лекувани с флувоксамин i.p. и физиологичен разтвор i.c.v. (група 3) показват забележима загуба на тегло от -22,97 ± 14,34 g. След комбинираното приложение на флувоксамин i.p. и α-спирална CRH i.c.v. (група 2) наддаването на тегло на животните беше частично възстановено (14.47 ± 8.29 g). Животните, лекувани с α-спирална CRH i.c.v./saline i.p. (група 4) са получили 3,74 ± 2,85 g по време на периода на наблюдение. Групи 1, 2 и 4 не се различават значително една от друга, докато загубата на тегло в група 3 е значително по-ниска в сравнение с другите групи (P Фигура 1
Кумулативният прием на храна е подобен в групи 1–3 (група 1; 42,55 ± 8,11 g; група 2, 68,35 ± 33,98 g; група 3, 56,82 ± 26,97 g), докато е установено, че е по-нисък в група 4 (14,61 ± 6,0 g). Общото съотношение на наддаване на телесно тегло към прием на храна в различните групи се различава значително помежду си: група 1, 0,5 ± 0,2, група 2, 0,2 ± 0,2; група 3, -0,4 ± 0,3; и група 4, съответно 0,3 ± 0,1. Въпреки кумулативния прием на храна от 56,8 ± 27,0 g в групата, приемаща само флувоксамин, това съотношение е очевидно по-ниско, отколкото в останалите групи (α = 0,048–0,002). Освен това се наблюдава значително взаимодействие на периферно (флувоксамин/физиологичен разтвор) и централно (α-CRH/физиологичен разтвор) лечение във всички групи.
След приложението на флувоксамин i.p. в комбинация с физиологичен разтвор i.c.v. се наблюдава намаляване на серумния инсулин с приблизително 30% (Таблица 1) в сравнение с контролните животни, получаващи физиологичен разтвор i.p. и i.c.v. След комбинираното приложение на флувоксамин i.p. и α-спирална CRH i.c.v., ефектите на ssri са ясно намалени и серумният инсулин остава стабилен на изходната стойност. Прилагането на физиологичен разтвор i.p. и α-спирална CRH i.c.v. няма ефект върху серумните концентрации на инсулин.
Дискусия
Базалната хиперинсулинемия на фа/фа Zucker плъховете е обяснено с засилен парасимпатиков отток към ендокринния панкреас 2,20 и може да бъде намален чрез i.c.v. администриране на CRH. 13 Нашите данни ясно подкрепят схващането, че ефектите на флувоксамин върху секрецията на инсулин се медиират чрез CRH, тъй като те са премахнати от α-спирална CRH поне отчасти.
В обобщение резултатите от нашите експерименти ясно показват, че CRH или CRH-подобни пептиди са силно включени в серотонинергичното регулиране на телесното тегло.
Препратки
Leibowitz SF. Поведенчески изследвания на хипоталамуса. В: Morgane PJ, Panksepp J (редактори). Наръчник на хипоталамуса Том 1, част А: Марсел Деккер: Ню Йорк 1980 299–437.
Leibowitz SF, Brown LL. Мозъчни невротрансмитери и регулиране на апетита Психофармак бик 1980 г. 21.: 412–418.
Йордания S, Kramer GL, Zukas PK, Moeller M, Petty F . In vivo изтичане на биогенен амин в медиалната префронтална кора с имипрамин, флуоксетин и флувоксамин Синапс 1994 г. 18.: 294–297.
Laflamme N, Bovetto S, Richard D, Rivest S. Ефект на дексфенфлурамин върху транскрипционното активиране на CRF и неговия рецептор тип 1 в паравентрикуларното ядро на плъховия хипоталамус Br J Pharmac 1996 г. 117: 1021–1034.
Bovetto S, Rouillard C, Richard D. Роля на CRF в ефектите на 5-HT-рецепторните агонисти върху приема на храна и скоростта на метаболизма Am J Physiol 1996 г. 271: R1231–1238.
Kamradt MC, Van de Kar LD, Grey TS. D -фенфлурамин индуцира медиирана от серотонин експресия на Fos в кортикотропин-освобождаващ фактор и окситоцинови неврони на хипоталамуса и серотонин-независима експресия на fos в енкефалин и невротензинови неврони на амигдалата Неврозиентност 1999 г. 90: 851–858.
Hotta M, Shibasaki T, Yamauchi N, Ohno H, Benoit R, Ling N, Demura H. Ефектите от хроничното централно приложение на кортикотропин-освобождаващ фактор върху приема на храна, телесно тегло и хипоталамо-хипофизарно-адренокортикалните хормони Life Sci 1991 г. 48: 1483–1491.
Rohner-Jeanrenaud F, CD на Walker, Greco-Perotto R, Jeanrenaud B. Централното приложение на кортикотропин-освобождаващ фактор предотвратява прекомерното наддаване на телесно тегло при генетично затлъстяване (фа/фа) плъхове Ендокринология 1989 г. 124: 733–739.
Egawa M, Yoshimatsu H, Bray GA. Централно регулиране на стресовите реакции: регулиране на вегетативната нервна система и висцералната функция чрез освобождаване на кортикотропин фактор-41 Am J Physiol 1991 г. 260: R328 – R334.
Ричард D, Rivest R, Naimi N, Timofeeva E, Rivest S. Експресия на кортикотропин-освобождаващ фактор и неговите рецептори в мозъка на слаби и затлъстели плъхове Zucker Ендокринология 1996 г. 137: 4786–4795.
Rohner-Jeanrenaud F, Hochstrasser AC, Jeanrenaud B. Хиперинсулинемия на преобес и затлъстяване фа/фа плъхове е частично медииран от блуждаещ нерв Am J Physiol 1983 г. 244: E317 – E322.
Krahn DD, Gosnell BA, Grace M, Levine AS. CRF антагонистът частично обръща CRF- и стрес-индуцираните ефекти върху храненето Мозъчен Res Bull 1986 г. 17: 285–289.
Paxinos G, Watson C . Мозъкът на плъх в стереотаксични координати Academic Press: Сан Диего, Калифорния 1986
Schulz C, Lehnert H. Активиране на норадренергични неврони в локуса coeruleus от освобождаващ кортикотропин фактор - изследване на микродиализата Невроендокринология 1996 г. 63: 454–458.
Браун MR, Grey TS, Fisher LA. Антагонист на рецептор на освобождаващ кортикотропин фактор: ефекти върху автономната нервна система и сърдечно-съдовата функция Регул Пепт 1986 г. 16.: 321–329.
Heinrichs SC, Pich EM, Miczek KA, Britton KT, Koob GF. Антагонистът на освобождаващия кортикотропин фактор намалява емоционалността при социално победени плъхове чрез директно невротропно действие Brain Res 1992 г. 581: 190–197.
Lehnert H, Schulz C, Dieterich K. Физиологични и неврохимични и аспекти на действието на кортикотропин-освобождаващ фактор в мозъка: ролята на locus coeruleus Neurochem Res 1998 г. 23.: 1039–1052.
Krahn DD, Gosnell BA, Grace M, Levine AS. CRF антагонистът частично обръща CRF- и стрес-индуцираните ефекти върху храненето Мозъчен Res Bull 1986 г. 17: 285–289.
Rothwell NJ & Lee FR. Термогенеза, кафява мастна тъкан и дексфенфлурамин при проучвания върху животни Int J Obes Relat Metab Disord 1992 г. 16.: (Suppl 3): S67 – S71.
Egawa M, Yoshimatsu H, Bray GA. Преоптичната инжекция на кортикотропин-освобождаващ хормон стимулира симпатиковата активност Am J Physiol 1990 г. 259: R799 – R806.
Благодарности
Флувоксамин е любезно предоставен от Pharmacia & Upjohn, Швеция. Експерименталните протоколи за животните и грижите за тях са в съответствие с германското законодателство и са одобрени от комисията по грижа за животните. Всички експерименти отговарят на най-високите стандарти за хуманна грижа за животните.
Информация за автора
Принадлежности
Катедра по ендокринология и метаболизъм, Университет Ото-фон-Герике, Магдебург, Германия
I Wieczorek, C Schulz & H Lehnert
Катедра по акушерство и гинекология, Университет Георг-Август в Гьотинген, Германия
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Ефектите на лактацията върху консумацията на енергия и протеини, промяна на теглото след раждането и тялото
- Диета на Виктория Бекъм, тегло, възраст, ръст, измервания на тялото - 2018
- Наддаване на тегло през зимата Наистина ли ниските температури карат тялото ви да съхранява мазнини
- Виктория Бекъм Тегло Височина Тело Статистика Размер, Адрес Телефон Имейл, Хоби Любими неща;
- Доматът намалява телесното тегло Врагът на затлъстяването