Въведение
Безалкохолната мастна чернодробна болест (NAFLD) се счита за чернодробна проява на метаболитен синдром и е свързана с инсулинова резистентност, захарен диабет тип 2, затлъстяване, хипертония и дислипидемия (T. Fukuhara et al. Hepatogastroenterology 2014; 61: 323 –328).
Настоящият златен стандарт за диагностика на чернодробна стеатоза е чернодробна биопсия с хистопатологична оценка. Понастоящем обаче се препоръчват по-малко инвазивни и много точни диагностични методи за откриване на мастен черен дроб, включително ултразвук на коремната кухина, КТ и ЯМР. Абдоминалната ехография може да бъде най-добрият и най-достъпен диагностичен метод за първоначална диагноза на мастния черен дроб (O.W. Hamer et al. Radiographics 2006; 26: 1637-1653).
Въз основа на диагностичните изображения има 3 установени модела на мастен черен дроб (OW Hamer et al. Radiographics 2006; 26: 1637–1653): i/дифузен хомогенен мастен черен дроб, ii/дифузен мастен черен дроб с фокусно мастно пестене (т.е. с участъци без стеатоза) и iii/фокални мастни лезии в иначе нормален черен дроб.
Съобщава се, че инхибиторът на дипептидил пептидаза-4 (DPP-4), ситаглиптин, подобрява или дори обръща чернодробната стеатоза при пациенти със захарен диабет тип 2 (T. Fukuhara et al. Hepatogastroenterology 2014; 61: 323–328).
Описание на случая
49-годишна жена с анамнеза за затлъстяване, 2-годишна история на лекуван с метформин захарен диабет тип 2 и хиперлипопротеинемия и 7-годишна история на артериална хипертония беше оценена в нашата амбулатория за диабет. Нейното лекарство включва дневно метформин 3 000 mg (антидиабетно лекарство), целипролол 200 mg (бета-блокер), рамиприл 5 mg (инхибитор на ангиотензин конвертиращия ензим), амилорид 5 mg (диуретик) и хидрохлоротиазид 50 mg (диуретик). Пациентът няма анамнеза за прием на алкохол и тютюнопушене.
Започвайки с първоначалната си диагноза захарен диабет тип 2, нейното редовно ежегодно ултразвуково изследване на корема, извършено от същия сонолог, разкрива тежка дифузна хомогенна чернодробна стеатоза (A.J. Sanyal. Gastroenterology 2002; 123: 1705–1725). Пациентът няма анамнеза или присъствие на друго чернодробно заболяване, като алкохолно мастно чернодробно заболяване, индуцирано от лекарства чернодробно заболяване, хроничен вирусен хепатит В или С, автоимунен хепатит, първична билиарна цироза, склерозиращ холангит, болест на Уилсън, хемохроматоза, α-1 -дефицит на антитрипсин. Чернодробните кръвни изследвания бяха многократно в нормалните граници. При тази клинична обстановка диагнозата безалкохолна мастна чернодробна болест беше много вероятна.
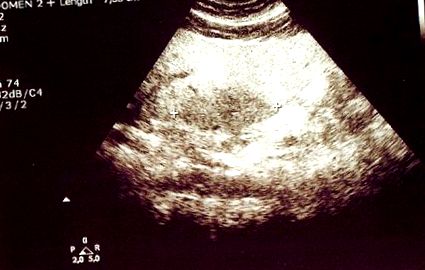
През май 2012 г., поради лоша компенсация на диабета, 100 mg дневно ситаглиптин (DPP-4 инхибитор) бяха добавени към гореспоменатите й лекарства. През април 2013 г. (единадесет месеца след започване на лечение със ситаглиптин), рутинно ежегодно изследване на коремната ултразвукова диагностика показа на чернодробен сегмент 2 хипоехогенна географски конфигурирана 7,55 см голяма лезия с лошо очертани граници и без ефект, заемащ пространство в B-режим (Фиг. 1 ). Нормалната васкуларизация беше открита с помощта на цветно доплер ултразвуково изследване. Тази констатация беше много подозрителна за фокусно пестене на мазнини (FFS), т.е. д., намалено съдържание на мазнини в определени чернодробни области. Диагнозата на FFS беше потвърдена с помощта на ядрено-магнитен резонанс, тъй като пациентът отказа чернодробна биопсия.
Трансабдоминалното УЗ при изследване в B-режим показва при чернодробен сегмент 2 хипоехогенна географски конфигурирана лезия (между кръстоски) с лошо очертани граници и без ефект, заемащ пространството. Максималният диаметър на лезията е 7,55 cm.
15 месеца след началото на лечението със ситаглиптин, пациентът отказва продължаване на лечението със ситаглиптин. Изненадващо, 16 месеца след прекратяването на лечението със ситаглиптин е установено намаляване на максималния диаметър (от 7,55 cm на 3,51 cm) на FFS (фиг. 2). Всички сонографски оценки бяха извършени от същия много опитен сонолог, като се използва ултразвукова система Phillips HD XE 11 с изпъкнал преобразувател 2–5 MHz.
Трансабдоминалното УЗ при B-режим изследване показва в чернодробен сегмент 2 същата лезия (между кръстоски) с намаляване на максималния диаметър до 3,51 cm.
Пациентката продължава да има много лошо диетично съответствие и начинът й на живот е хипокинетичен. По време на описания период (между май 2012 г. и януари 2015 г.), тя е получила наддаване на тегло от 82 на 84,9 кг, нейният ИТМ се е повишил от 34,1 на 35,3 кг/м 2, нейният HbA1c се е повишил от 46 на 59 ммол/мол и нейният хомеостатичен оценка на модела - инсулинова резистентност (HOMA-IR) се увеличава от 1,24 на 6,39 mU · mmol/l 2. Чернодробните тестове са в нормални граници по време на лечението със ситаглиптин, както и по-късно.
Дискусия
FFS е често срещано състояние, което обикновено се намира в чернодробни сегменти 2, 4 и 5 (т.е. в съседство с ligamentum falciforme или ligamentum venosum, в ямата на жлъчния мехур и в porta hepatis). Съобщава се, че механизмите на развитие на фокално пестене на мазнини в стеатотичния черен дроб са свързани с аберантно венозно кръвообращение (особено аберален ход на лявата стомашна вена или вени на жлъчния мехур), артериопортални шунтове и намалена портална перфузия в гореспоменатия черен дроб сегменти, което води до локално разреждане на нивата на хранителни вещества в кръвта, вливаща се в FFS (L. Liu et al. J Ultrasound Med 2008; 27: 387–394).
При нашия пациент открихме нов FFS в дифузен по-рано хомогенен мастен черен дроб след приложение на ситаглиптин. Предполагаме, че тази констатация е резултат от „демаскиране“ на FFS при дифузна хомогенна чернодробна стеатоза при индивид, който има вероятност да има анормална венозна циркулация на черния дроб. Тъй като е известно, че лечението със ситаглиптин намалява съдържанието на мазнини в хепатоцитите и че ефектът може да настъпи бързо в области с намалена портална перфузия, т.е. д., с намалени хранителни запаси от червата.
Wu et al. (S. Wu et al. J Ultrasound Med 2013; 32: 1695–1702) документира, че FFS се среща често при неалкохолна чернодробна стеатоза (приблизително при 19,2%) и че FFS може да се промени с мастни чернодробни промени с течение на времето. Същите автори (S. Wu et al. J Ultrasound Med 2014; 33: 1447–1452), използвайки коремни ултразвукови изследвания, проследяват 301 пациенти с дифузен хомогенен NAFLD в продължение на 3 години и не откриват нови FFS. Това проучване обаче имаше наблюдателен дизайн, при който не бяха приложени диети, упражнения, намаляване на теглото или фармакологични интервенции.
Наблюденията, направени при нашия пациент, са открити след фармакологична намеса. Като такова лечението със ситаглиптин е единственото разумно обяснение за фокалния спад на стеатозата при нашия пациент. Други влияния върху фокалната регресия на чернодробната стеатоза, като намаляване на теглото, физически упражнения, по-добра компенсация на диабета или подобряване на инсулиновата резистентност, могат да бъдат напълно изключени при нашия пациент. Нещо повече, наблюдавахме намаляване на максималния диаметър на FFS 16 месеца след прекратяване на приема на ситаглиптин. Това наблюдение допълнително подкрепя нашата хипотеза.
Нарастващите доказателства предполагат възможна ефикасност на терапии, базирани на инкретин, особено на (DPP-4) инхибитори за намаляване на чернодробната стеатоза. Доколкото ни е известно, това е първият доклад, че FFS може да се появи в клиничното протичане на NAFLD, особено след лечение със ситаглиптин. Такива констатации могат да бъдат предизвикателство за ултразвуковото интерпретиране. Въпреки това, с широкото използване на DPP-4 инхибитори, това предизвикателство ще трябва да се отговори.
И. Хофманова, П. Шкрха, А. Шедо, М. Андел; Чехия
Признание
Документът е подкрепен от проект NT12407-4/2011 на Агенцията за вътрешни безвъзмездни средства към Министерството на здравеопазването на Чешката република.
- Предсказване на риска по граници за безалкохолна мастна чернодробна болест въз основа на биохимични и диетични
- Метаболизмът на холин предоставя нови прозрения за безалкохолната мастна чернодробна болест и нейните
- Ефикасността на глутатиона за лечение на безалкохолна мастна чернодробна болест е отворена,
- Ефекти на физическата активност върху чернодробната функция при пациенти с безалкохолна мастна чернодробна болест А
- Диетичният капсаицин и антибиотиците действат синергично за намаляване на безалкохолната мастна чернодробна болест