Резюме
Заден план
Тежкото затлъстяване е нарастващо, общо бреме и конвенционалните терапии, включително радикална промяна в диетата и/или повишена физическа активност, имат ограничени резултати. Бариатричната хирургия е предложена като алтернативна терапия, показваща обещаващи резултати. Това води до значителна загуба на тегло и подобряване на съпътстващите заболявания като диабет тип 2. Повишеното затлъстяване е свързано с промени в епигенетичния профил, включително метилиране на ДНК. Изследвахме ефекта от бариатричната хирургия върху клиничния профил, метилирането на ДНК и биологичната възраст, оценена с помощта на епигенетичния часовник на Horvath.
Резултати
За да се определи въздействието на бариатричната хирургия и последващата загуба на тегло върху клиничните признаци, кохорта от 40 лица със силно затлъстяване (ИТМ = 30–73 kg/m 2) е изследвана по време на операцията и при три последващи посещения, т.е. 3, 6 и 12 месеца след операцията. По-голямата част от индивидите са жени (65%), а средната възраст при операция е 45,1 ± 8,1 години. Наблюдавахме значително намаляване с течение на времето на ИТМ, глюкоза на гладно, HbA1c, HOMA-IR, инсулин, общ холестерол, триглицериди, нива на LDL и свободни мастни киселини и значително малко увеличение на нивата на HDL (всички стр стойности −7). Включването на промяна на ИТМ в модела намалява броя на значително диференцирано метилираните CpG места с 51%. Анализът за обогатяване на генетичен набор установи свръхпредставяне на множество процеси, включително регулиране на транскрипцията, метаболитни РНК и биосинтетични процеси в клетката. Бариатричната хирургия при пациенти със силно затлъстяване е довела до намаляване както на биологичната възраст, така и на епигенетичното ускоряване на възрастта (EAA) (средно = - 0,92, стр стойност = 0,039).
Заключения
Нашето проучване показва, че бариатричната хирургия води до значително намаляване на ИТМ и подобряване на клиничните резултати, наблюдавани 12 месеца след операцията. Тези промени обясниха част от връзката между бариатричната хирургия и метилирането на ДНК. Наблюдавахме и малко, но значително подобрение на биологичната възраст. Тези епигенетични промени могат да бъдат модифицирани от фактори на околната среда и могат да бъдат използвани като потенциални биомаркери за затлъстяването и в бъдеще за свързаните със затлъстяването съпътстващи заболявания.
Заден план
Разпространението на затлъстяването в световен мащаб се е утроило почти през 1975 г. През 2016 г. 39% от възрастното население са с наднормено тегло (определено като индекс на телесна маса (ИТМ) ≥ 25) и 13% са със затлъстяване (определено като ИТМ ≥ 30), което прави затлъстяването глобална тежест [1]. Затлъстяването се признава като един от основните рискови фактори за хронични заболявания като сърдечно-съдови заболявания и диабет тип 2, както и рак и депресия [2]. Често се придружава от хронично, нискостепенно възпаление, високи нива на възпалителни цитокини и ниски нива на противовъзпалителни адипокини [3].
Заедно със затлъстяването стареенето е рисков фактор за много хронични заболявания [20]. Неотдавна разработен биологичен оценител на възрастта, базиран на метилиране на ДНК, известен като епигенетичен часовник, многократно е доказано, че е свързан с много свързани с възрастта състояния като рак, невродегенерация и менопауза [21,22,23], но също така с ИТМ и затлъстяване [ 20, 24]. Разликата между възрастта на метилиране на ДНК, наричана още биологична възраст, и хронологичната възраст се нарича възрастово ускорение. Положителните или отрицателните стойности на епигенетичното възрастово ускорение (EAA) предполагат, че определена тъкан старее по-бързо или по-бавно от очакваното. Към днешна дата EAA се свързва с ниво на образование, диета и други фактори на начина на живот [25]. Тук ние предположихме, че EA, която представлява биологична възраст, е по-висока при пациенти със силно затлъстяване преди, отколкото след бариатрична хирургия.
Настоящото проучване има за цел да изследва ефекта на бариатричната хирургия върху (а) антропометрични, метаболитни и липидни промени в три времеви точки след операцията (3, 6 и 12 месеца); (б) промени в метилирането на ДНК чрез сравняване на профилите на метилиране в периферната кръв непосредствено преди и 12 месеца след операцията; в) биологична възраст и ускоряване на епигенетичната възраст (EAA) чрез сравняване на тези непосредствено преди операцията и 12 месеца след операцията.
Методи
Проучвайте популация
Група от 40 пациенти с тежко затлъстяване са подложени на елективна бариатрична хирургия (вж. Допълнителен файл 1: Таблица S1 за подробности за операцията) в Катедрата по обща хирургия, Университетски медицински център на Маастрихт (Маастрихт, Холандия). Включихме изходни данни и данни за проследяване (3, 6 и 12 месеца след операцията) за тези лица. Подробности за изследването могат да бъдат намерени другаде [26, 27]. Това проучване е одобрено от Съвета по медицинска етика на Медицинския център на университета в Маастрихт, в съответствие с етичните насоки на Декларацията от Хелзинки от 1975 г. Информирано съгласие беше получено от всеки участник.
Измервания
Използван е стандартизиран протокол за получаване на кръвно налягане и антропометрични измервания като височина, тегло и обиколка на талията. Взети са кръвни проби след 8 часа на гладно сутринта на операцията за определяне на кръвната захар на гладно, HbA1c, инсулин, оценка на хомеостатичния модел (HOMA-IR), общ холестерол, HDL холестерол, LDL холестерол, триглицериди (TG), свободни мастни киселини ( FFA), аланин трансаминаза (ALAT), аспартат трансаминаза (ASAT) и С-реактивен протеин (CRP).
ДНК се изолира от проби от цяла кръв, събрани в две времеви точки, т.е. сутринта на операцията и 12 месеца след операцията. Общо 500 ng геномна ДНК се преобразува бисулфит с помощта на EZ ДНК метилиращ комплект (Zymo Research, Ървайн, Калифорния, САЩ) и се хибридизира с илюминационни 450 K масиви (Сан Диего, Калифорния, САЩ) съгласно протоколите на производителя. Данните са генерирани от Устройството за анализ на генома на UMCG (www.rug.nl/research/genetics/genomeanalysisfacility/), използвайки една и съща партида масиви за всички участници в изследването.
Контрол и нормализиране на качеството на метилирането на ДНК
Обработката, анализът и визуализацията на данните са извършени в R статистически софтуер версия 3.5.1 (http://cran.r-project.org). Интензитетът на суровия сигнал е импортиран в R и впоследствие е подложен на качествен контрол с помощта на пакета minfi [28]. Тези проверки на качеството не разкриха значителни партидни ефекти. Методът за функционално нормализиране е използван за нормализиране на данните, използвайки стандартната информация за проектиране на сондата Illumina (масив IlluminaHumanMethylation450k) [29]. Допълнително филтриране на сондата беше извършено за отстраняване от набора от данни сонди, съдържащи SNP в последователността на сондите, сонди с лошо откриване стр стойност (стр > 0,001) и сонди на X и Y хромозоми. Проверихме за наличие на екстремни отклонения в данните за метилиране (75-ия персентил + 3IQR), както беше предложено от консорциума PACE [30]. Това доведе до отстраняване на 19 допълнителни сонди (ако отклоненията бяха открити в> 20% от пробите) и задаване на всички идентифицирани отклонения на липсващи стойности. Крайният набор от данни за анализ включва 456 073 сонди.
Статистически анализ
Клинични промени
Използвани са линейни смесени модели за изчисляване на общата значимост на клиничните промени във времето от изходното ниво, със случаен интервал, случаен коефициент за време и неструктурирана ковариационна матрица. Нивата на CRP и TG са трансформирани в логаритъма, тъй като тези параметри не показват нормално разпределение. Всички анализи бяха коригирани за половите и възрастовите разлики и изчислени с помощта на пакета “lme4” в R.
Анализ на асоцииране в целия епигеном
Анализ на обогатяване на генен набор и асоцииране с генна експресия
За да намерим функционална интерпретация на резултатите, използвайки значимите открития от EWAS като вход, направихме анализ на обогатяване на генни комплекти с пакета “methylGSA” R [40], за да идентифицираме значително обогатени пътища на Reactome стр стойностите за обогатяване се коригират за многократно тестване, като се използва процент на фалшиво откриване (FDR
Резултати
Клинични черти преди и след бариатрична хирургия
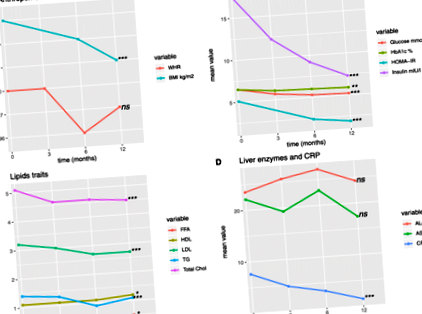
В тази популация от проучвания средните нива на CRP постоянно намаляват след интервенцията, което предполага намаляване на състоянието на хронично възпаление (фиг. 1, таблица 1). 37,5% от лицата, включени в проучването, са имали диабет в предихирургично състояние. Наблюдавахме подобрение на хипергликемията, отразено от значително намаляване на глюкозата на гладно (средно намаление - 1,17 mmol/L) и HbA1c (средно намаление - 0,6%) 12 месеца след операцията (стр стойностна тенденция във времето −7, Таблица 1).
ДНК метилиране преди и след бариатрична хирургия
Анализ на EWAS
Анализът на ДНК метилиране на периферна кръв се провежда за две времеви точки, т.е. преди и 12 месеца след операцията. Анализът на асоцииране в целия епигеном разкрива 4857 значително диференцирано метилирани места на CpG 12 месеца след операцията (при корекция на Bonferroni стр стойност -7; Допълнителен файл 1: Таблица S3; модел, коригиран за възрастта, пола, разпределението на клетъчния тип и партидните ефекти). Всички значими CpG места показват по-високи нива на метилиране след операция (средна бета промяна от 0,01% до 15%; Допълнителен файл 2: Фигура S1) и са разпределени във всички хромозоми (Допълнителен файл 2: Фигура S2). Сред значително диференциално метилираните CpG сайтове, ние идентифицирахме значително обогатяване на CpG сайтове, разположени в региони за промотор на гени, в 5’UTR и в 1-ви екзон, но също и в CpG острови в сравнение с общия масив (всички стр стойности -16 въз основа на точния тест на Фишър; Допълнителен файл 2: Фигура S3).
Оценката на разпределението на типа бели кръвни клетки, използвайки метода на Houseman [32], разкрива ясна промяна от преди операцията към операцията. Тази промяна, показана в Допълнителен файл 2: Фигура S4, е статистически значима (стр стойност Таблица 2 Брой значими диференциално метилирани места на CpG преди и след операцията преди и след корекция за клинични променливи (н = 30).
Съотношения между епигенетичните промени след операцията и клиничния профил
За да дешифрираме предполагаемо клинично значими места на CpG, изчислихме корелациите между промяната на ДНК метилирането на 4857 значими места на CpG и промените в клиничните признаци. Открихме 420 уникални значими корелации между CpGs и постбариатрични промени (коефициент на корелация R > 0,5, стр -16). Това е илюстрирано от Допълнителен файл 2: Фигура S6, която показва нивата на метилиране за първите 15 значими места на CpG от анализа на EWAS при пациенти преди и след операцията и двете подгрупи на Lifelines.
Епигенетична възраст и ускоряване на епигенетичната възраст преди и след бариатрична хирургия
За всички 40 пациенти епигенетичната възраст (EA) е изчислена с помощта на калкулатора на възрастта за метилиране на ДНК, разработен от Horvath. Преди операцията средният EA е бил 3,17 години по-висок в сравнение с хронологичната възраст, докато след операцията средният EA е бил 2,26 години по-висок в сравнение с хронологичната възраст (Таблица 3). Въз основа на EA на индивидите, средната разлика между преди и след операцията е 0,08 години, докато хронологично е изминала приблизително една година. Епигенетичното ускоряване на възрастта (EAA), обикновено дефинирано като разликата между EA и хронологичната възраст, е било по-малко след операция (средно = - 0,92, стр стойност = 0,039), което предполага значително подобрение на биологичната възраст.
Дискусия
Целите на настоящото проучване бяха да се идентифицират ефектите от бариатричната хирургия върху три области: клиничен профил, метилиране на ДНК и биологична възраст. Ние съобщаваме за значителни промени в клиничния профил на 3, 6 и 12 месеца след операцията и в профила на метилиране на ДНК и биологичната възраст 12 месеца след операцията, което предполага, че бариатричната хирургия има виден ефект върху индивидуалното здраве и епигенетика.
Благоприятни ефекти на бариатричната хирургия върху теглото и клиничния профил
След бариатрична хирургия наблюдаваме трайно намаляване на ИТМ, отразяващо значителна загуба на тегло в отговор на интервенцията. Значително намаляване на ИТМ се наблюдава и през първата година след операцията в други подобни проучвания [46,47,48]. В надлъжното кохортно проучване на CBS пиковото намаление на теглото е достигнато 2 години след операцията и остава стабилно поне 20 години [47]. Над 60% от пациентите, включени в нашето проучване, са подложени на RYGB, което е предпочитаният метод за бариатрична хирургия поради по-голяма загуба на тегло и по-висока степен на ремисия на диабета (62% срещу 47% и 80,3% срещу 56,7%, съответно) в сравнение с процедура за превръзка на стомаха [9, 49]. В нашия анализ сме комбинирали всички видове операции, за да увеличим силата на изследването. Като анализ на чувствителността повторихме анализа в най-голямата група (RYGB) и открихме подобни резултати с по-малко значими стр стойности (всички EWAS значими CpG сайтове, н = 4857, стр стойности −4; корелация на размера на ефекта между групата на RYGB и общата група, включително всички видове хирургични операции, е 0,99; данните не са показани).
Тежкото затлъстяване е известен рисков фактор за диабет тип 2 и почти 50% от пациентите с диабет тип 2 са със затлъстяване [50]. Рискът от развитие на диабет е дори 20 пъти по-висок при затлъстели, отколкото при слаби индивиди [51]. В съответствие с тези данни, повишените нива на глюкоза, HbA1c, инсулин и HOMA-IR при пациентите преди операцията предполагат или преддиабетно състояние, или напълно развит диабет тип 2 при 37,5% от тежко затлъстелите пациенти. В нашето проучване наблюдавахме подобрение в гликемичния профил след операцията: нивата на глюкоза на гладно и инсулин в кръвта бяха значително по-ниски с течение на времето през първата година след операцията. Ранното подобрение на гликемичните черти, наблюдавано в нашето проучване, може да бъде свързано с ограничаване на калориите, водещо до повишена чернодробна чувствителност към инсулин и подобрена функция на бета-клетките, също свързано с пост-бариатричната висока постпрандиална секреция на глюкагон-подобен пептид 1 [52]. По-късно загубата на тегло предизвиква подобряване на мускулната чувствителност към инсулин, което повишава общата чувствителност към инсулин и толерантността към глюкозата [53].
Хиперлипидемията, хиперхолестеролемията и хипертриглицеридемията, свързани с тежко затлъстяване, се подобряват след бариатрична операция при поне 70% от пациентите [9]. В нашите данни наблюдаваме подобни промени в нивата на триглицеридите, общия и LDL холестерола след операцията.
При прогресиращо тежко затлъстяване мастната тъкан става по-дисфункционална. Повишеното производство на провъзпалителни цитокини в мастната тъкан допринася за системно възпаление, което е отличителен белег на тежкото затлъстяване. Повишените FFA повишават секрецията на инсулин в панкреаса и намаляват инсулиновата чувствителност в черния дроб и мускулите, което допринася за метаболитни усложнения, свързани със затлъстяването [54]. С-реактивният протеин е значително по-нисък след бариатрична хирургия, което допълнително потвърждава намаленото възпаление след загуба на тегло.
Епигенетични промени след бариатрична хирургия
Заключения
В обобщение, нашето проучване показва, че бариатричната хирургия води до подобряване на клиничните резултати, включително значително намаляване на ИТМ, както и до епигенетични промени. Такава драстична намеса може да възстанови профилите на метилиране на ДНК при пациенти с тежко затлъстяване спрямо моделите, наблюдавани при здрави индивиди. Благоприятният ефект на бариатричната хирургия върху промените в маркерите за метилиране на ДНК може да бъде медииран от телесното тегло и метаболитните параметри и в бъдеще тези маркери могат да бъдат полезни при свързаните със затлъстяването съпътстващи заболявания.
Наличност на данни и материали
Наборите от данни, използвани и/или анализирани по време на настоящото проучване, са достъпни от съответния автор при разумна заявка.
- Каква е клиничната ефективност и разходната ефективност на употребата на лекарства при лечение на пациенти със затлъстяване
- Торакоскопска радикална операция за болно затлъстял пациент с ранен рак на белия дроб след
- Честота на щитовидната жлеза при пациенти със силно затлъстяване и риск от злокачествено заболяване при ултрасонография
- Ролята на обучението за затлъстяване в Медицинския факултет и пребиваване в знанията за бариатрична хирургия в
- Разбиране на разликата между наднорменото тегло, затлъстяването и бариатричния вестник на парамедицинската практика