Резюме
Цели/хипотеза
Целта на бозайниците на рапамицин комплекс 1 (mTORC1)/p70 рибозомна S6 киназа (S6K) 1 е свръхактивирана при затлъстяване, което води до инхибиране на фосфоинозитид 3-киназа (PI3K)/Akt сигнализация и инсулинова резистентност. Въпреки това, хроничното инхибиране на mTORC1 от рапамицин уврежда хомеостазата на глюкозата поради силната индукция на чернодробната глюконеогенеза. Тук сравнихме ефекта на рапамицин с този на селективния инхибитор S6K1, PF-4708671, върху метаболизма на глюкозата in vitro и in vivo.
Методи
Използвахме L6 миоцити и FAO хепатоцити, за да изследваме ефекта на PF-4708671 върху регулирането на усвояването на глюкозата, производството на глюкоза и инсулиновата сигнализация. Също така лекувахме затлъстели мишки с високо съдържание на мазнини (HF) в продължение на 7 дни с PF-4708671 в сравнение с рапамицин, за да оценим глюкозния толеранс, инсулиновата резистентност и инсулиновата сигнализация in vivo.
Резултати
Хроничното лечение с рапамицин индуцира инсулинова резистентност и нарушен метаболизъм на глюкозата в чернодробните и мускулните клетки. И обратно, хроничното инхибиране на S6K1 с PF-4708671 намалява производството на глюкоза в хепатоцитите и засилва усвояването на глюкоза в миоцитите. Докато лечението с рапамицин инхибира Akt фосфорилирането, PF-4708671 повишава Akt фосфорилирането и в двете клетъчни линии. Тези противоположни ефекти на mTORC1 и S6K1 инхибиторите също се наблюдават in vivo. Всъщност, докато лечението с рапамицин индуцира глюкозна непоносимост и не успява да подобри Akt фосфорилирането в черния дроб и мускулите на HF-хранени мишки, лечението с PF-4708671 подобрява глюкозния толеранс и увеличава Akt фосфорилирането в метаболитните тъкани на тези затлъстели мишки.
Заключения/тълкуване
Хроничното инхибиране на S6K1 от PF-4708671 подобрява глюкозната хомеостаза при затлъстели мишки чрез засилено активиране на Akt в черния дроб и мускулите. Нашите резултати показват, че специфичната блокада на S6K1 е валиден фармакологичен подход за подобряване на изхвърлянето на глюкоза при лица със затлъстял диабет.
Въведение
Инсулинът е основен хормон, който регулира много физиологични пътища като клетъчен растеж, пролиферация, глюкозна и липидна хомеостаза. Доказано е, че нарушеното действие на инсулина играе основна роля при метаболитни заболявания, като затлъстяване и диабет тип 2. Установено е, че няколко Ser/Thr кинази фосфорилират множество остатъци Ser в IRS-1 в отговор на растежни фактори, излишък от хранителни вещества или възпалителни стимули, които инхибират инсулиновата сигнализация и допринасят за инсулиновата резистентност. Те включват мишена за бозайници на рапамицин (mTOR) и p70 рибозомна S6 киназа (S6K), както и c-Jun NH2-терминална киназа (JNK) и инхибитор на ядрения фактор-kB (IKK) [1, 2].
И двете рибозомни S6 кинази - p70 рибозомна S6 киназа (S6K) и p90 рибозомна S6 киназа (RSK) - са добре разпознати ключови инсулинови сигнализиращи протеини [3, 4]. Двете S6K изоформи, S6K1 и S6K2, първоначално се смятаха за излишни протеини поради тяхната висока хомология. Последните проучвания обаче предполагат различни роли за всяка изоформа (прегледана в [5]). В действителност, S6K1 участва в инсулин-медиирания клетъчен растеж, но - подобно на mTORC1 - също така управлява вериги с отрицателна обратна връзка на различни нива на регулиране. Например, няколко проучвания показват, че както mTORC1, така и/или S6K1 фосфорилират специфични серинови остатъци върху IRS протеини [6, 7]. Освен това, някои от тези IRS-1 сайтове, по-специално Ser 1101 и Ser 636, бяха диференцирано регулирани от mTOR и S6K1 [8, 9]. Освен това докладваме, че Ser 1101 е важна цел на S6K1 и че този сайт е хиперфосфорилиран при животински модели на затлъстяване и при излишък на хранителни вещества при хората [10]. Наскоро Liu et al [11] съобщават, че S6K1 може също така да разруши mTORC2 чрез фосфорилиране на Sin1 както върху остатъците T86, така и върху T398. Всички тези механизми за контрол на отрицателната обратна връзка разкриват значението на S6K1 в регулирането на инсулиновите плейотропни действия.
Метаболитните функции на S6K1 също бяха демонстрирани с помощта на генетични модели. Всъщност мишките с нокаут S6K1 (KO) са устойчиви на индуцирано от високо съдържание на мазнини (HF) затлъстяване и показват подобрение на глюкозния толеранс и инсулиновата сигнализация [12]. Въпреки това, мишките S6K1 KO на стандартна диета с ниско съдържание на мазнини също са хипоинсулинемични, непоносими към глюкоза и имат намалена бета клетъчна маса поради лезия в чувствителността на глюкозата или производството на инсулин [13]. Younis et al [14] освен това наблюдават подобрение на глюкозния толеранс, използвайки антисенс олигонуклеотиди срещу S6K1 при мишки в продължение на 4 седмици; това обаче е свързано с намаляване на телесното тегло и приема на храна. Интересното е, че наскоро беше показано, че медиирано от адено асоцииран вирус (AAV) чернодробно изчерпване на S6K1/2 подобрява системната инсулинова резистентност, чернодробната глюконеогенеза и чернодробната стеатоза [15]. Тези проучвания предполагат, че инхибирането на S6K1 може да бъде интересна терапевтична възможност за облекчаване на свързаната със затлъстяването инсулинова резистентност и диабет тип 2.
Острото фармакологично инхибиране на mTORC1/S6K1 пътя с рапамицин увеличава инсулиновата сигнализация и метаболизма на глюкозата in vitro и при животински модели на инсулинова резистентност [10, 16–18]. Хроничното лечение с рапамицин обаче причинява подобни на диабет симптоми поради промени в чернодробните глюконеогенни гени и съхранение на липиди в мазнини [9, 19, 20]. Все още обаче няма проучвания за оценка на ефекта от специфичното инхибиране на S6K1 върху клетъчната инсулинова сигнализация, глюкозния метаболизъм и хомеостазата на глюкозата в цялото тяло. Наскоро селективният инхибитор на S6K1 - PF-4708671 - беше характеризиран [21], което ни позволи да тестваме ефекта на фармакологичното инхибиране на S6K1 върху метаболизма на глюкозата за първи път. Тук забелязахме, че PF-4708671 намалява производството на чернодробна глюкоза и стимулира усвояването на глюкоза в мускулите in vitro, заедно с повишено фосфорилиране на Akt както в хепатоцитите, така и в миоцитите. Освен това, PF-4708671 подобрява глюкозния толеранс при HF-хранени затлъстели мишки чрез възстановяване на Akt S473 фосфорилиране в метаболитните тъкани, което предполага, че инхибирането на S6K1 може да представлява валиден подход за подобряване на контрола на глюкозата при затлъстели индивиди с диабет тип 2.
Методи
Реактиви и антитела
Реагентите и антителата са включени в методите за електронен допълнителен материал (ESM).
Клетъчна култура
L6 миобластите са отгледани в α-MEM (Invitrogen, Burlington, ON, Канада), допълнени с 10% (об./Об.) FBS и диференцирани в миотръби в α-MEM с 2% (об./Об.) FBS, както преди описано [22]. L6 клетките бяха лишени от серум в продължение на 5 часа преди експериментите и 100 nmol/l инсулин бяха използвани за стимулиране на клетките през последните 5 минути на лишаване. Хепатоцитите на FAO се поддържат в RPMI среда (Invitrogen), лишават се от серум за една нощ и се стимулират с посочената концентрация на инсулин. Носител (диметил сулфоксид, DMSO 0,02% [об./Об.]) Или рапамицин (25 nmol/l) или PF-4708671 (10 μmol/l) са използвани, тъй като p70 S6 киназата е напълно инхибирана при тази доза [21]. Използвани са само клетки, свободни от микоплазма.
Западни анализи
Уестърн петна се извършват, както е описано [19]. Накратко, равни количества протеини се разделят чрез SDS-PAGE (7,5% [тегл./Об.]) И се прехвърлят върху нитроцелулозната мембрана. Мембраните бяха блокирани в 5% (тегл./Об.) Рибен желатин, разреден в Tris рН 7,4 + 0,1% (об./Об.) Tween (TBS-T) и инкубирани за една нощ при 4 ° C със съответните антитела, разредени в 1% (тегл./об.) рибен желатин в TBS-T.
Поглъщане на глюкоза
Поглъщането на глюкоза (2-DG) се извършва, както е описано по-рано [22] (вж. ESM методи).
Производство на глюкоза
Производството на глюкоза се оценява в хепатоцитите на FAO, както е описано по-горе [23] (вж. ESM методи).
Изследвания върху животни
Боравенето с животните и третирането им са одобрени от Комитета за грижи и боравене с животните към Университета Лавал. Мъжки мишки C57Bl/6 (на 6 седмици) са закупени от Charles River Laboratories (St Constant, QC, Канада) и са настанени индивидуално в клетки в стая, държана при 23 ± 1 ° C с 12 h светлина/12 h тъмен цикъл. Мишките бяха разпределени на случаен принцип между групи, но в началото на проучванията бяха съпоставени с телесното тегло. Тестовете за поносимост към глюкоза и пируват са направени заслепени. Мъжки мишки C57Bl/6 (на 6 седмици) са били хранени с високо съдържание на мазнини (HFD, 60% енергия от мазнини, Research Diets, D12492 (New Brunswick, NJ, USA)) в продължение на 12 седмици, преди да бъдат разпределени на случаен принцип в три групи: ( 1) контролен (HF) приемник (8% EtOH [об./Об.], 0,2% [тегл./Об.] Карбоксиметилцелулоза стерилен); (2) третирани с PF-4708671 (35 mg kg -1 ден -1, i.p.); или (3) лекувани с рапамицин (2 mg kg -1 ден -1, i.p.) в продължение на 7 дни, докато се държат на същия HFD (ESM методи).
i.p. тестове за толерантност към глюкоза и пируват
След 12 седмици HFD хранене, мишките бяха на гладно в продължение на 6 часа и инжектирани i.p. с глюкоза (1 g/kg), разредена във физиологичен разтвор, 0,9% (тегл./об.) (NaCl 154 mmol/l). За теста за толерантност към пируват (PTT), мишките са гладували в продължение на 6 часа и са инжектирани i.p. с пируват (2 g/kg; Sigma-Aldrich, Oakville, ON, Канада), разреден във физиологичен разтвор, 0,9% (тегл./об.).
Определяне на плазмата/тъканите
Нивата на кръвната глюкоза се измерват с One Touch Mini Ultra Glucometer (LifeScan, Калифорния, САЩ). Плазменият инсулин се определя чрез радиоимуноанализ (Linco Research, St Charles, MO, USA). Нивата на триацилглицерол (TG) в плазмата и черния дроб се измерват чрез ензимни методи в съответствие с инструкциите на производителите (Randox Lab kit, WV, USA). Общият липид се изолира от 0,1 g замразен черен дроб чрез екстракция с хлороформ-метанол [24]. Чернодробното съдържание на TG се определя ензимно от разтворения липиден екстракт. Чернодробният гликоген се определя с помощта на реакцията на фенолсулфурна киселина [25].
Ядрени екстракти
Чернодробните ядрени екстракти се приготвят, както е описано по-рано [19] и се подлагат на имуноблотинг, както е описано по-горе.
Екстракция на РНК и количествен PCR анализ
Извличането на РНК и количественият PCR анализ са извършени, както е описано по-рано [19] (виж ESM методи).
Количествено определяне и статистически анализи
Едно- и двупосочен ANOVA с Newman – Keuls post hoc беше извършен със Sigma Plot версия 12 (Systat Software, Сан Хосе, Калифорния, САЩ); стр стойностите се считат за значими, ако са с 20% отклонение от средното тегло на другите животни от същата група. Критерият за изключване на която и да е точка от данни беше разстояние> ± 2,5 × SD от средната стойност на другите данни от същата група.
Резултати
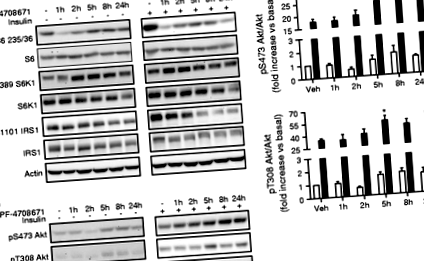
Инхибирането на S6K1 намалява фосфорилирането на S6 и увеличава фосфорилирането на Akt в хепатоцитите
Като основна цел на S6K1, рибозомното фосфорилиране на S6 протеин беше измерено за първи път след лечение с PF-4708671 в хепатоцити. Както основното, така и стимулираното от инсулин фосфорилиране на S6 върху S235/6 бързо се инхибират от PF-4708671 и инхибиторният ефект се поддържа до 24 часа в третирани с инсулин клетки (фиг. 1). Нещо повече, фосфорилирането на S6K1 Thr389 се е увеличило след лечение с PF-4708671, констатация, която е в съответствие с предишни доклади и се предлага да включва някои пътища за обратна връзка, чрез които S6K1 може да регулира собственото си фосфорилиране чрез mTORC1 [21, 26]. Както беше показано по-рано, използвайки генетични инструменти в клетки [10], фармакологичното инхибиране на S6K1 чрез PF-4708671 намалява фосфорилирането на IRS1 S1101, стимулирано от инсулин. Лечението с PF-4708671 увеличава индуцираното от инсулин фосфорилиране на Akt от 5 часа и този ефект се запазва до 24 часа (фиг. 1б, в). Също така изключихме, че PF-4708671 може да инхибира митоген и активирана от стреса киназа 1 (MSK1), тъй като този инхибитор не инхибира Thr581 MSK1 и Ser133 сАМР отговор на свързващ елемент протеин (CREB), индуциран от форбол миристат ацетат (РМА) в хепатоцити (ESM Фиг. 1), в съответствие с предишната работа на Pearce et al [21].
Инхибирането на S6K1 намалява производството на глюкоза в чернодробните клетки
Инхибирането на S6K1 увеличава усвояването на глюкоза в L6 миоцитите
In vivo лечението с PF-4708671 подобрява глюкозната хомеостаза при затлъстели мишки
За да оценим терапевтичния потенциал на PF-4708671 in vivo, ние лекувахме затлъстели мишки, хранени с HFD, с PF-4708671 в продължение на 1 седмица и сравнихме неговия ефект с този на рапамицин. Както се очаква, HFD индуцира наддаване на телесно тегло, затлъстяване, хипергликемия и хиперинсулинемия в сравнение с мишки, хранени с чау диета (Таблица 1). Докато PF-4708671 не повлиява телесното тегло или затлъстяването, установено е, че лечението с рапамицин значително намалява телесното тегло, което отчасти е свързано с намалено тегло на ингвиналната мастна тъкан. Интересното е, че само 1 седмица лечение с PF-4708671 е установено, че подобрява глюкозата на гладно, докато рапамицин допълнително увеличава хипергликемията на гладно при затлъстели мишки. В допълнение към глюкозата на гладно, установено е също, че лечението с рапамицин увеличава инсулинемията на гладно, както се съобщава по-рано в различни модели на гризачи [19, 20, 28, 29].
За да се определи въздействието на инхибирането на S6K1 върху хомеостазата на глюкозата, ние след това извършихме тест за толерантност към глюкоза (GTT). HFD индуцира непоносимост към глюкоза, която е частично обърната от инхибирането на S6K1, но допълнително се влошава от лечението с рапамицин (Фиг. 4а, b). Подобряването на глюкозния толеранс чрез инхибиране на S6K1 е независимо от промените в плазмените нива на инсулин, докато рапамицинът повишава инсулиновия отговор по време на GTT (фиг. 4в). HF храненето също повишава чернодробната TG, но намалява съдържанието на гликоген в черния дроб (фиг. 4г, д). PF-4708671 има тенденция да намалява леко чернодробния TG и съдържанието на гликоген в сравнение с HF групата, докато рапамицинът има тенденция да ги увеличава, което води до статистически значима разлика между лекарствата.
Хроничен PF-4708671 и рапамицин ефект върху глюконеогенезата in vivo
Индуцираното от рапамицин влошаване на глюкозния толеранс също е свързано с повишена глюконеогенеза, измерено чрез PTT, което не е било засегнато от лечението с PF-4798671 (Фиг. 5а). Съответно, третирани с PF-4798671 мишки изразяват подобно ниво на ядрени PGC1α, HNF4α и CREB в сравнение с контролни мишки, хранени с HF (Фиг. 5b). Както се очакваше от увеличената чернодробна глюконеогенеза при лекуваните с рапамицин мишки, ние открихме по-висока експресия на ядрени клетки на CREB и HNF4α в черния дроб на тези животни. HF-хранени мишки, третирани с инхибитор S6K1, експресират сходни нива на mRNA на глюконеогенни ензими в сравнение с третирани с носител HF-контроли, докато нивата на mRNA с G6Pase са увеличени в черния дроб на мишки, лекувани с рапамицин (Фиг. 5в).
Хронично PF-4708671 подобрено фосфорилиране на Akt S473 в HF-хранени миши тъкани
За по-нататъшно изследване на механизмите, лежащи в основата на метаболитния фенотип на третирани с PF-4708671 мишки, ние след това анализирахме фосфорилирането на Akt в черния дроб, мускулите и мастните тъкани. В черния дроб HFD индуцира намаляване на стимулираното от инсулин фосфорилиране Akt S473 във всички тъкани, което беше напълно възстановено от PF-4708671 в черния дроб и мускулите, но само частично подобрено в мастната тъкан. За разлика от това, лечението с рапамицин само частично възстановява фосфорилирането на Akt S473 в черния дроб, но не и в мускулите и мастните тъкани (фиг. 6а – в). Ефектът на лекарството върху фосфорилирането на Akt Thr308 е по-малко ясен. Докато лечението с PF-4708671 и рапамицин има тенденция към подобряване на индуцираното от инсулин фосфорилиране на Thr308 в черния дроб и мускулите (фиг. 6а, б), установено е, че само рапамицин подобрява фосфорилирането на това място в мастната тъкан на затлъстели мишки (фиг. 6в) . Установено е, че както PF-4708671, така и рапамицинът притъпяват индуцираното от HFD повишено фосфорилиране на S1101 на IRS-1 в черния дроб и мастната тъкан (ESM фиг. 2). IRS-1 фосфорилиране на S1101 не може да бъде открито в мускулите (данните не са показани).
За да определим дали специфичните за тъканите ефекти на PF-4708671 върху фосфорилирането на Akt могат да бъдат свързани с диференциалното инхибиране на S6K1 в черния дроб, мускулите и мастната тъкан, ние допълнително оценихме състоянието на фосфорилиране на S6 в тези тъкани. Неочаквано PF-4708671 не инхибира фосфорилирането на S6, което обаче е напълно инхибирано от рапамицин както при базални, така и при стимулирани от инсулин условия (Фиг. 7а-с). От друга страна, лечението с PF-4708671, но не и с рапамицин, причинява значително увеличение на фосфорилирането на S6K1, поне в черния дроб и мастната тъкан (Фиг. 7а – в). Това е в съответствие с инхибирането на S6K1 от PF-4708671, както се вижда in vitro (Фиг. 1) и предишни доклади [21, 26], което предполага, че други кинази могат да фосфорилират рибозомни S6 протеини в тези тъкани in vivo.
Дискусия
Пътят mTORC1/S6K регулира много основни процеси като растеж, пролиферация, синтез на протеини и липогенеза. В допълнение, няколко проучвания подчертават ролята на mTORC1/S6K1 в метаболизма, тъй като този път усеща хранителни вещества и енергия (АТФ), но също така регулира инсулиновата сигнализация на различни нива. Острото лечение (24 часа) рапамицин също има важни неблагоприятни метаболитни ефекти при модели на гризачи и при хора, причинявайки хиперлипидемия, хипергликемия и хиперинсулинемия [9, 19, 30, 31].
Нашите проучвания върху чернодробни и мускулни клетки допълнително предполагат, че PF-4708671 увеличава метаболизма на глюкозата независимо от действието на инсулина. В действителност, ние забелязахме, че производството на глюкоза от хепатоцитите намалява след остро и хронично лечение с PF-4708671, докато медиираното от инсулин потискане не се засилва допълнително от инхибирането на S6K1. По същия начин, PF-4708671 значително увеличава поглъщането на базална глюкоза в миоцитите L6 и инсулина не увеличава допълнително стимулиращия ефект на PF-4708671 върху този процес. Този независим от инсулина ефект на инхибитора S6K1 е в съответствие с констатацията, че S6K-медиираното фосфорилиране на Sin1 отрицателно регулира mTORC2 независимо от инсулиновата сигнализация [11].
Настоящите фармакологични лечения не успяват да постигнат оптимален гликемичен контрол и поради това е изключително важно да се разработят нови терапевтични възможности за пациенти с диабет тип 2. В това проучване ние предоставяме доказателства, че специфичният инхибитор на S6K1 PF-4708671 намалява производството на чернодробна глюкоза и усвояването на глюкоза в мускулите in vitro и подобрява глюкозния толеранс in vivo, което може да бъде от клинично значение за лечение на диабет тип 2. Всъщност, за разлика от инхибирането на mTORC1/S6K1 от рапамицин - което има неблагоприятни метаболитни ефекти, когато се прилага хронично in vivo - селективното инхибиране на S6K1 ясно подобрява глюкозния толеранс и инсулиновата сигнализация в метаболитните тъкани, както се разкрива чрез подобряване на Akt фосфорилирането при HF-хранени затлъстели мишки. По този начин нашите резултати предполагат, че фармакологичното инхибиране на S6K1 е валиден терапевтичен подход за лечение на диабет тип 2, свързан със затлъстяването.
- Връзка между психологически стрес и метаболизъм при пациенти със затлъстяване SpringerLink
- Програма "Сестри заедно" увеличава консумацията на плодове и зеленчуци и физическата активност на африканците
- Рецепти за стимулиране на метаболизма
- Изследване на механизма на масажната терапия при разстройство на енергийния метаболизъм при просто затлъстяване - Пълно
- Връзки между глюкозата, енергийния прием и диетичния състав при затлъстели възрастни с тип 2