Лаборатория по основна и клинична миология, Катедра по физиология, Университет в Мелбърн, Мелбърн, Виктория, Австралия;
Лаборатория по основна и клинична миология, Катедра по физиология, Университет в Мелбърн, Мелбърн, Виктория, Австралия;
Лаборатория по основна и клинична миология, Катедра по физиология, Университет в Мелбърн, Мелбърн, Виктория, Австралия;
Лаборатория по основна и клинична миология, Катедра по физиология, Университет в Мелбърн, Мелбърн, Виктория, Австралия;
Хранене и метаболизъм, Институт по здравеопазване и медицински изследвания в Южна Австралия, Аделаида, Южна Австралия, Австралия; и
Училище за биологични науки, Университет в Аделаида, Аделаида, Южна Австралия, Австралия
Хранене и метаболизъм, Институт по здравеопазване и медицински изследвания в Южна Австралия, Аделаида, Южна Австралия, Австралия; и
Училище за биологични науки, Университет в Аделаида, Аделаида, Южна Австралия, Австралия
Лаборатория по основна и клинична миология, Катедра по физиология, Университет в Мелбърн, Мелбърн, Виктория, Австралия;
Лаборатория по основна и клинична миология, Катедра по физиология, Университет в Мелбърн, Мелбърн, Виктория, Австралия;
Адрес за заявки за препечатка и друга кореспонденция: Р. Коопман, катедра по физиология, Унив. от Мелбърн, Мелбърн, Виктория 3010 Австралия (имейл: [имейл защитен]).
Резюме
аминокиселините, особено левцин, силно стимулират протеиновия синтез и намаляват разграждането на протеините в здравите скелетни мускули (34). В резултат на това се предлага богата на левцин аминокиселинна добавка като потенциално средство за лечение на загуба на мускулна маса. Към днешна дата обаче нито едно дългосрочно, изокалорично, плацебо контролирано проучване при хора не е показало благоприятни ефекти от добавката на левцин върху скелетната мускулна маса или функция (25). Въпреки много проучвания, показващи засилен протеинов синтез след прием на богати на левцин добавки в здрави скелетни мускули, приложението на левцин не е задължително да подобри синтеза на протеин при загуба на мускулна маса. Този намален (или пълна липса) синтетичен отговор на протеини към аминокиселините е наречен „анаболна резистентност“ (46) и е наблюдаван при много загуби на мускулна маса, включително обездвижване (19), стареене (9), ракова кахексия (54, 55) и сепсис (17). Възмущението в нормалния синтез на протеини, стимулиран от аминокиселини, се счита за основен фактор за загубата на мускулна маса в редица условия за загуба на мускули и стратегиите за справяне с анаболната резистентност са важни (9, 19, 40, 46).
Въпреки че точните механизми, отговорни за анаболната резистентност, са неясни, се смята, че свръхпроизводството на провъзпалителни цитокини и реактивни кислородни видове (ROS), свързано с много загуби на мускулна маса, играе централна роля (3, 9, 28). Възпалението и ROS инхибират активността на механистичната цел на рапамицинов комплекс 1 (mTORC1) и намаляват фосфорилирането на еукариотния иницииращ фактор 4Е-свързващ протеин 1 (4E-BP1) и p70 S6 киназа 1 (S6K1) (17). Намаляване на ∼80% в индуцираното от левцин фосфорилиране на mTOR и неговите субстрати 4E-BP1 и S6K1 и свързаното с това инхибиране на левцин-стимулиран протеинов синтез са наблюдавани в скелетните мускулни клетки по време на възпаление (36). Анаболната резистентност към левцин при възпалителни състояния е в съответствие с разочароващите резултати от клинични проучвания, опитващи се да противодействат на загубата на мускулна маса при пациенти с травма, използващи хранителни добавки, богати на аминокиселини с разклонена верига (10). Предвид неуспеха на диетичното приложение на аминокиселини като стратегия за преодоляване на анаболната резистентност и намаляване на загубата на мускули, предположихме, че една по-обещаваща стратегия за борба с мускулната загуба е да се съсредоточи върху възстановяването на нормалния анаболен отговор на аминокиселините.
Тествахме потенциала на глицина за възстановяване на основния метаболизъм на протеините и нормалния анаболен отговор на аминокиселините, използвайки добре установен модел на остро възпаление в скелетните мускули. Възпаление се индуцира при мишки C57BL/6 чрез прилагане на 1 mg/kg липополизахарид (LPS) чрез интраперитонеално инжектиране и относителните скорости на базален и левцин-стимулиран протеинов синтез се измерват 4 часа по-късно. Въпреки че е добре известно, че клиничното протичане и прогресирането на заболяването при миши модели на LPS е много по-бързо, отколкото при хората, LPS моделът представлява добре разпознат, прост и възпроизводим ендотоксемичен модел на остро възпаление (18, 45). Освен това, този протокол е показан по-рано, че намалява синтеза на базален протеин и напълно премахва протеино-синтетичния отговор на левцин (37). Предположихме, че предварителната обработка с 1 g/kg глицин ще намали възпалението и ще запази анаболния отговор на левцин (0,5 g/kg) при мишки, третирани с LPS.
Животни.
Синтез на протеини.
За да се определи относителната скорост на протеинов синтез, беше използвана методологията SUnSET, както е описано по-рано (22). Накратко, пуромицин се прилага на мишки (ip) в доза 0,04 μmol/kg 30 минути след инжектиране на 0,5 g/kg левцин или еквивалентен обем физиологичен разтвор. Точно 30 минути след приложението на пуромицин, мишките бяха евтаназирани чрез дислокация на шийката на матката и мускулите на тибиалиса отпред (TA) и квадрицепсите (QUAD) бързо се дисектираха, попиха на филтърна хартия и замразиха (
Таблица 1. Използвани последователности от грундове
Имената на гените са известни също както следва: Trim63, специфичен за мускулите RING пръст 1; Fbxo32, MAFbx или атрогин-1; Bnip3, BCL2/аденовирус E1B 19-kDa-взаимодействащ протеин 3; Ccl2, хемокин (С-С мотив) лиганд 2; Ccl5 (хемокин (С-С мотив) лиганд 5; Socs3, супресор на цитокиновата сигнализация 3. Праймерите са проектирани с помощта на софтуер Invitrogen от генни последователности, получени от GeneBank. Специфичността на грунда беше определена с помощта на инструмента за основно търсене на местно подравняване.
Хистология на скелетните мускули.
Имуноблотинг.
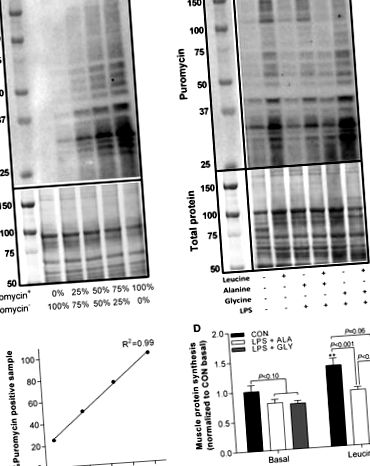
Фиг. 1.Глицинът противодейства на LPS-индуцирана анаболна резистентност към левцин. Стандартна крива за серийни разреждания на представителното Western blot (A) и пуромицин-положителен с пуромицин-отрицателен белтък (Б.). Количественото определяне на белези, белязани с пуромицин (синтез на протеини), коригирано с помощта на представителни Western blots (° С) и стандартна крива на пуромицин (д). Значителни разлики (P
статистически анализи.
Всички стойности са изразени като средни стойности ± SE. Данните бяха нормализирани към съответната контролна група за улеснение на визуализацията, освен ако не е посочено друго. Данните бяха тествани за нормалност и хомогенност на дисперсията, като се използва съответно тест на Шапиро-Уилк и Левен. Двупосочните ANOVA (лечение × базално/хранено) са използвани за сравнение между групите, където е подходящо, докато еднопосочните ANOVA са използвани за всички други сравнения. Post hoc тестът на Tukey е използван за определяне на значителни основни ефекти, докато тестът за най-малко значима разлика на Fisher е използван за сравнение между отделните групи за взаимодействия. За прозрачност и двете съществени разлики (P
Фиг. 2.LPS отслабва стимулираната от левцин интензивност на оцветяване с пуромицин както в скелетните мускулни влакна тип IIa, така и в IIb. Представителни индивидуални изображения на ламинин, N2.261 (MyHCIIa) и пуромицин (синтез на протеини) и 3 изображения се сливат (A), количествено определяне на интензивността на оцветяване на специфичен за влакната пуромицин (Б.) и% тип влакна (° С) в мишки, третирани с глицин (GLY) и аланин (ALA; контролна аминокиселина) 4 h след инжектиране на физиологичен разтвор (CON) или LPS (1 mg/kg) и 1 h след инжектиране на физиологичен разтвор (базален) или левцин . Значителни разлики (P
Тенденцията към по-ниска базална относителна скорост на протеинов синтез е свързана с по-ниска активация на някои (но не всички) сигнални протеини, участващи в регулирането на протеиновия синтез (Фиг. 3). По пътя на Akt-mTORC1 наблюдавахме по-ниско базално съотношение на фосфорилирания към общия Akt (p-Akt/Akt, ALA: -52 ± 7%; GLY: 50 ± 7%, P
Фиг. 3.Глицинът подобрява стимулираната от левцин бозайник цел на активиране на комплекс 1 на рапамицин (mTOR). Количествено определяне на съотношението на фосфорилирания към общия протеин за mTOR (A), S6 (Б.), еукариотен иницииращ фактор 4Е-свързващ протеин 1 (4E-BP1; ° С), еукариотен фактор на удължаване 2 (eEF2; д), Akt (Е.) и ERK (F) и представителни Western blots (G) в мишки, третирани с глицин (GLY) - и аланин (ALA; контролна аминокиселина) 4 часа след инжектиране на физиологичен разтвор (CON) или LPS (1 mg/kg) и 1 час след инжектиране на физиологичен разтвор (базален) или левцин. Значителни разлики (P
В отговор на приложението на 0,5 g/kg левцин, протеинов синтез (35 ± 12%, P
Фиг. 4.Глицинът възстановява индуцираното от левцин инхибиране на автофагичното сигнализиране. експресия на иРНК на Fbxo32 (атрогин-1; A), Trim63 (MurF1; Б.), и Bnip3 (д) и количествено определяне на протеиновата експресия за еукариотния иницииращ фактор 3f (eIF3f; ° С) и съотношението на LC3BII към LC3BI (Е.) и представителни Western blots (F) в мишки, третирани с глицин (GLY) - и аланин (ALA; контролна аминокиселина) 4 часа след инжектиране на физиологичен разтвор (CON) или LPS (1 mg/kg) и 1 час след инжектиране на физиологичен разтвор (базален) или левцин. Значителни разлики (P
Глицинът намалява оксидативния стрес, но не и възпалителната сигнализация в скелетните мускули.
В сравнение с CON, интензивността на DHE оцветяването е значително по-висока след инжектиране на LPS в групата ALA, без ефект на приложение на левцин (Фиг. 5, A и Б.). За разлика от тях, интензивността на DHE оцветяването е по-ниска в GLY групата, отколкото в двете групи CON и ALA, без ефект на левцин. Натрупване на белязани с 4HNE протеини не се наблюдава 4 часа след приложението на LPS и не се различава между никоя група (Фиг. 5° С). Интересното е, че състоянието на фосфорилиране на p38 MAPK, потенциална връзка между оксидативния стрес и нарушения метаболизъм на протеините, е значително по-високо (P
Фиг. 5.LPS насърчава и глицинът намалява оксидативния стрес в скелетните мускули. Представителни изображения на оцветяване с дихидроетидиумбромид, маркер на реактивни кислородни видове (A) и количествено определяне на интензивността на оцветяване (Б.), количествено определяне на 4HNE-белязани протеини (° С), съотношението на фосфорилирания към общо 38 MAPK (д) и представителни Western blots (Е.) за мишки, третирани с глицин (GLY) - и аланин (ALA; контролна аминокиселина) 4 h след инжектиране на физиологичен разтвор (CON) или LPS (1 mg/kg) и 1 h след инжектиране на физиологичен разтвор (базален) или левцин. Значителни разлики (P
Прилагането на LPS значително повишава експресията на иРНК на Ил-6 (∼80 пъти), Tnfα (∼15 пъти), Socs3 (∼35 пъти), Ccl2 (∼65 пъти) и Ccl5 (∼7 пъти) и състоянието на фосфорилиране на STAT3 (Tyr 705) в четириглавия мускул (фиг. 6, A – F). Имаше обаче тенденция (P = 0,09) за по-ниска концентрация на IL-6 протеин в GLY групата в сравнение с ALA групата. Въпреки притъпената интензивност на DHE оцветяване при мишки, третирани с глицин, възпалителното сигнализиране не се различава между ALA и GLY групите при базални или левцин-стимулирани условия. По подобен начин, лечението с глицин не променя възпалителния отговор на LPS в култивирани миотуби на скелетни мускули C2C12 (Фиг. 7, A – E). Неочаквано приложението на левцин при мишки изглежда усилва възпалителния отговор на LPS, със значителен основен ефект за левцин, наблюдаван за Tnfα и Socs3 и тенденция към по-висока Ил-6 (P = 0,11) и Ccl2 (P = 0,06) иРНК. Въпреки непроменен възпалителен отговор, глицинът отслабва LPS-индуцираното намаляване на диаметъра на миотръбата на C2C12, когато клетките се инкубират в 1 μg/ml LPS в продължение на 24 часа (Фиг. 7, F и G).
Фиг. 6.Глицинът не намалява възпалителния отговор на LPS в скелетните мускули. експресия на иРНК на Ил-6 (A), Tnfα (Б.), супресор на цитокиновата сигнализация 3 (Socs3; ° С), Ccl2 (д), и Ccl5 (Е.) в третирани с глицин (GLY) - и аланин (ALA) мишки 4 h след инжектиране на физиологичен разтвор (CON) или LPS (1 mg/kg) и 1 h след инжектиране на физиологичен разтвор (базален) или левцин и количествено определяне експресия на протеин за IL-6 (G), SOCS3 (З.) и съотношението на фосфорилирания към общия STAT3 (F) и представителни Western blots (Аз). експресията на mRNA се нормализира до съдържанието на cDNA. Основните ефекти за лечение или левцин са съобщени в горе вляво ъгъл на всяка графика, където е подходящо.
Фиг. 7.Глицинът запазва диаметъра на миотръбата, но не намалява възпалителния отговор на LPS в скелетните мускулни клетки C2C12. експресия на иРНК на Ил-6 (A), Tnfα (Б.), Socs3 (° С), Ccl2 (д), и Ccl5 (Е.) в зрели 5-дневни миотуби, третирани с 2,5 mM глицин (GLY) или аланин (ALA) и след това инкубирани в 1 μg/ml LPS за 0 (контрола) или 1, 2 или 4 часа и представителни изображения (F) и количествено определяне (G) от диаметъра на миотръбата след 24-часова инкубация в диференцираща среда, обработена с PBS (CON), LPS и аланин (LPS + ALA) или LPS и глицин (LPS + GLY). експресията на иРНК се нормализира до Gapdh израз. Различните букви означават значителна разлика в P b> c и bc не се различава от b или c.
Неесенциалната аминокиселина глицин подобрява mTORC1 сигнализирането и ефективно възстановява протеиновия синтетичен отговор на левцин в скелетните мускули на мишки, третирани с LPS. Подобрението на протеиновия метаболизъм е свързано с намаляване на ROS на скелетните мускули, но не променя възпалителната сигнализация на скелетните мускули in vivo или in vitro. Глицинът представлява обещаваща хранителна намеса за намаляване на загубата на скелетни мускули.
Глицинът подобрява стимулираното от левцин mTORC1 сигнализиране и синтеза на протеин при мишки, третирани с LPS.
В съответствие с предишни наблюдения при хора (52) и плъхове (36–38), наблюдавахме тенденция (P Европейско общество за клинично хранене и метаболизъм .
Не се декларират конфликти на интереси, финансови или други, от авторите.
D.J.H. и Р.К. концепция и дизайн на научните изследвания; D.J.H., M.K.C., V.C., A.C., X.W. и R.K. проведени експерименти; D.J.H. и M.K.C. анализирани данни; D.J.H., M.K.C., C.G.P. и G.S.L. интерпретирани резултати от експерименти; D.J.H. подготвени фигури; D.J.H. изготвен ръкопис; D.J.H., C.G.P., G.S.L. и R.K. редактиран и преработен ръкопис; D.J.H., M.K.C., V.C., A.C., X.W., C.G.P., G.S.L. и R.K. одобрена окончателна версия на ръкописа.
ПРЕПРАТКИ
ЗАБЕЛЕЖКИ НА АВТОРА
* D. J. Ham, M. K. Caldow и R. Koopman са допринесли еднакво за тази статия.
- Ефекти от диета с високо съдържание на мазнини върху чревната микробиомна дисбиоза в миши модел на болестта в Персийския залив
- Диета и упражнения при лечението на хиперлипидемия - американски семеен лекар
- Диетата и теглото могат да повлияят на отговора на лечението с биполярно разстройство - ScienceDaily
- Могат ли кучетата да имат зелен боб; Американски киноложки клуб
- Мотивиране чрез използване на виртуален модел симулатор за отслабване