Резюме
Заден план
Затлъстяването значително увеличава риска от атеротромботични събития, патологично състояние, при което хроничното състояние на оксидативен стрес играе основна роля. Това проучване има за цел да изследва участието на (NO) -разтворим гуанилилциклаза (sGC) сигнален път в дисфункцията на тромбоцитите от плъхове с високо съдържание на мазнини (HFF).
Методи
Мъжките плъхове Wistar са били хранени в продължение на 10 седмици със стандартна чау (SCD) или диета с високо съдържание на мазнини (HFD). Оценени са ADP (10 μM) - и тромбин (100 mU/ml) индуцирана агрегирана тромбоцитна агрегация. Измерването на вътреклетъчните нива на нивата на ROS се извършва с помощта на поточна цитометрия. Цикличните нива на GMP бяха оценени с помощта на ELISA комплекти.
Резултати
Хранените с високо съдържание на мазнини плъхове показват значително увеличение на телесното тегло, епидидималните мазнини, нивата на глюкозата на гладно и непоносимостта към глюкоза в сравнение с групата на SCD. Агрегация на тромбоцити, индуцирана от ADP (н = 8) и тромбин от HFD плъхове (н = 8) са значително по-големи (P
Заден план
Тромбоцитите играят важна физиологична функция в системата за хемостаза в отговор на съдови увреждания чрез предотвратяване на кръвоизлив [1]. Ефективната адхезия и агрегация на тромбоцитите изисква синергичен принос на множество взаимодействия рецептор-лиганд, които предават активиращи сигнали, иницииращи набор от биохимични и морфологични реакции на тромбоцитите, свързани с ремоделиране на цитоскелета, секреция на гранули и генериране и освобождаване на ендогенни разтворими агонисти, като ADP и тромбоксан А2 (TXA2) [2–5].
Полученият от ендотелни клетки азотен оксид (NO) оказва инхибиторен ефект във функцията на тромбоцитите чрез активиране на cGMP/PKG пътя, което от своя страна води до намаляване на концентрацията на Ca 2+, като по този начин предотвратява адхезията и агрегацията на тромбоцитите към съдовата стена [ 6]. Независимо от това, ендотелната дисфункция, налична при определени патологични състояния, се характеризира с намалена бионаличност на NO, което подтиква ненормално активиране на тромбоцитите, водещо до съдова тромбоза [7, 8]. Тромбоцитната дисфункция се счита за краен стадий на сърдечно-съдови усложнения при захарен диабет тип II, затлъстяване и атеросклероза, което води до клинични резултати като инфаркт на миокарда, инсулт и заболяване на периферните артерии [9].
Затлъстяването е важен проблем за общественото здраве, засягащ всички възрасти и социално-икономически групи, което значително повишава честотата на сърдечно-съдови и ендокринно-метаболитни нарушения. Хроничното състояние на оксидативен стрес и възпаление са отличителен белег на затлъстяването, които играят ключова роля във физиопатологичните събития при това разстройство [10, 11]. Тези провъзпалителни и прооксидантни ефекти са свързани с повишено производство на реактивни кислородни видове (ROS) и намалена бионаличност на NO, което увеличава риска от атеро-тромботични събития [12]. Независимо от това, точните механизми, чрез които затлъстяването предизвиква дисфункция на тромбоцитите, остават слабо проучени. В допълнение, повечето фатални сърдечно-съдови събития като последица от тромботично усложнение не са свързани с пълна съдова стеноза, а по-скоро с промени в провъзпалителни и прооксидантни биомаркери, които могат да предскажат бъдещи сърдечно-съдови събития. Ние предположихме, че производството на интратромбоцитни ROS при затлъстяване допринася за тромботични събития при ендокринно-метаболитни нарушения. Следователно, ние изследвахме ex-vivo реактивността на тромбоцитите в отговор на ADP и тромбин при плъхове с високо съдържание на мазнини и участието на ROS и NO-cGMP, получени от тромбоцити, в модулирането на реактивността на тромбоцитите.
Методи
Животни и диета с високо съдържание на мазнини
Експерименталните протоколи бяха одобрени от Етичните принципи в изследванията на животните, приети от Бразилския колеж за експерименти с животни (COBEA) и изпълнени в съответствие с насоките ARRIVE за изследване върху животни [13]. Мъжките плъхове Wistar бяха настанени в контролирани от температурата помещения на 12-часов цикъл светлина-тъмнина. Животните бяха настанени по две на клетка и хранени в продължение на 10 седмици или със стандартна диета с чау (въглехидрати: 70%; протеини: 20%; мазнини: 10%) или диета с високо съдържание на мазнини, която предизвиква затлъстяване (въглехидрати: 29%; протеин: 16%; мазнини: 55%), според предишната ни работа [14].
Телесно тегло, епидидимална мастна маса и гликемия
Телесното тегло и епидидималната мастна маса бяха оценени в началото и в последния момент от проучването. Концентрацията на глюкоза е измерена в кръвта от опашната вена (Accu-Check Performa, Roche Diagnostics, Indianapolis, IN, USA).
Тест за орален глюкозен толеранс (OGTT) и инсулинов толеранс (ITT)
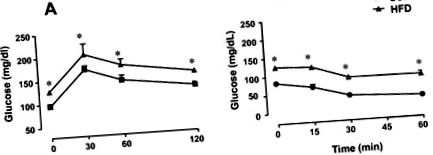
Тест за орален глюкозен толеранс се извършва след 12 часа на гладно. Контролните и хранени с високо съдържание на мазнини (HFF) плъхове получават 20% разтвор на глюкоза (2 g/kg) чрез сонда. Кръвни проби бяха събрани от опашната вена при основно състояние и след 30, 60 и 120 минути натоварване с глюкоза. Чувствителността към цялото тяло към инсулина се анализира чрез тест за толерантност към инсулин (ITT). Взети са проби от венозна кръв преди (0 минути) и 15, 30 и 60 минути след интраперитонеална инжекция на редовен инсулин (0,75 U/kg).
Изолиране на кръвни тромбоцити и тестове за агрегация
Плъховете се обезболяват с изофлуран и кръвта се събира от коремната аорта в 1: 9 (v/v) ACD-C (12.4 mM натриев цитрат, 13 mM лимонена киселина, 11 mM глюкоза). Богата на тромбоцити плазма (PRP) се получава чрез центрофугиране на пълна кръв при 200 g в продължение на 15 минути при стайна температура. Пет милилитра PRP бяха добавени към 7 ml промивен буфер (140 mM NaCl, 0.5 mM KCl, 12 mM тринатриев цитрат, 10 mM глюкоза, 12.5 mM захароза, pH6) и центрофугирани (800 ж, 13 минути). Пелетата се суспендира отново в промиващ буфер и процедурата се повтаря веднъж. Тромбоцитите се суспендират внимателно в разтвор на Krebs (118 mM NaCl, 25 mM NaHC03, 1.2 mM KH2PO4, 1.7 mM MgS04, 5.6 mM глюкоза, рН 7.4). Броят на тромбоцитите се коригира на 1,2 х 108 тромбоцита/ml в присъствието на 1 mM CaCl2. Агрегацията на тромбоцитите беше измерена в двуканален агрегаметър (Chronolog Lumi-Aggregometer модел 560-Ca, Havertown, PA, USA) при 37 ° С при разбъркване (1000 rpm). Анализите за агрегация на тромбоцитите са проведени с използване на ADP (10 μM) или тромбин (100 mU/ml).
Измерване на реактивни кислородни видове (ROS) чрез поточна цитометрия
Измерването на вътреклетъчните нива на ROS се извършва съгласно предишно проучване [15]. Накратко, измитите тромбоцити (получени, както е описано по-горе) бяха ресуспендирани в разтвор на Krebs-Ringer при 1.2 × 10 8 тромбоцити/ml в присъствието на 1 mM калций и 5 μM 2'-7'-дихлорофлуоресцин диацетат (DCFH-DA) . Тромбоцитната суспензия (500 μL) бяха предварително инкубирани с N-ацетилцистеин (NAC, 1 mM) или PEG-каталаза (1000 U/ml) в продължение на 15 минути преди добавяне на DCFH-DA. След това суспензията на тромбоцитите се инкубира или не с ADP (20 М) или H2O2 (8 тМ; положителен контрол) в продължение на 20 минути. След това пробите от тромбоцити се центрофугират (800 g 10 минути) и пелетите се суспендират отново в разтвор на Krebs (500 μL). Пробите бяха анализирани с помощта на проточен цитометър Becton Dickinson (FACSCalibur, Becton Dickinson, San José, CA, USA), оборудван с 488 nm дължина на вълната аргонов лазер, 510 × 540 nm лентови филтри. Тромбоцитите бяха идентифицирани от предния и страничния разсейващ сигнал. Десет хиляди специфични за тромбоцитите събития първоначално бяха анализирани от цитометъра. Неактивираните и активираните тромбоцити се затварят, за да не се анализират тромбоцитните агрегати и микрочастици. След това вратите бяха анализирани за средна флуоресценция.
Извличане и измерване на cGMP
Измитите тромбоцити (1,2 х 108 тромбоцити/мл) се инкубират с фосфодиестеразния инхибитор 3-изобутил-1-метил-ксантин (IBMX; 2 тМ) за 15 минути. След това тромбоцитите бяха инкубирани с натриев нитропрусид (SNP, 10 μM), S-нитрозо-N-ацетилпенициламин (SNAP, 10 μM) или BAY 41-2272 (10 μM) за 3 минути, след което реакцията беше прекъсната от добавянето на студено подкиселен абсолютен етанол (67%, обем/обем) и пробите се разбъркват енергично в продължение на 30 s. Клетъчните проби бяха центрофугирани (4000 ж, 30 минути при 4 ° С). Супернатантите се сушат при 55-60 ° С под поток от азот. Цикличният GMP се измерва с помощта на комплект от Cayman Chemical (Ann Arbor, MI). Анализите се извършват в два екземпляра. Границата на откриване на cGMP е 1 pmol/mL.
Материали
Аденозин дифосфат (ADP), тромбин, PEG-каталаза, N-ацетилцистеин (NAC), натриев нитропрусид, S-нитрозо-N-ацетилпенициламин (SNAP) са закупени от Sigma Chem. Co. (Сейнт Луис, Мисури, САЩ). 5-циклопропил-2- [1- (2-флуоро-бензил) -1Н-пиразоло [3,4-Ь] пиридин-3-ил] -пиримидин-4-иламин (BAY 41-2272) е предоставен от Pharma Research Център, Байер (Вупертал, Германия). Iloprost се доставя от Schering (Германия).
Статистически анализ
Данните са изразени като средни стойности ± SEM от н плъхове. Статистическата значимост между групите се определя чрез използване на еднопосочен ANOVA, последван от теста на Bonferroni. Където е уместно, беше използван несдвоен t-тест на Student за сравняване на конкретни групи. Значението беше установено в P
Резултати
Телесно тегло, тест за толерантност към глюкоза през устата (OGTT) и тест за толерантност към инсулин (ITT)
Плъховете, лекувани с диета с високо съдържание на мазнини (HFD), показват значително увеличение на телесното тегло и епидидималните мазнини в сравнение с животните, получаващи стандартна диета с чау (SCD), приблизително 20% и 135% (P Таблица 1 Ефект на диетата с високо съдържание на мазнини върху телесното тегло, теглото на епидидима и нивата на глюкозата
ADP- и тромбин-индуцирана измита тромбоцитна агрегация
Агрегацията на тромбоцитите, индуцирана от ADP (10 μM), е значително по-голяма (P Фигура 2
Ефект на NAC и PEG-каталаза върху хиперагрегирането на тромбоцитите на HFF плъхове
Предварителната обработка на тромбоцитите с NAC (1 mM, 3 min) или PEG-каталаза (1000 U/ml, 3 min) не повлиява значително тромбин или ADP-индуцирана агрегация на тромбоцити при плъхове SCD (н = 4-7; Фигура 3). Въпреки това, NAC и PEG-каталазата напълно предотвратяват хиперагрегацията на тромбоцитите, индуцирана от тромбин или ADP в HFD група (Фигура 3).
Ефект на натриевия нитропрусид (SNP), S-нитрозо-N-ацетилпенициламин (SNAP) и BAY 41-2271 върху агрегацията на тромбоцитите и cGMP вътреклетъчните нива
При плъховете на SCD, ADP-индуцираната тромбоцитна агрегация е до голяма степен намалена чрез предварителна инкубация с NO донори SNP (10 μM; н = 4) и SNAP (10 μM; н = 5), както и от NO-независимия разтворим гуанилилциклазен стимулатор BAY 41-2272 (10 μM; н = 7), както е показано на фигура 4А. Намаляването на тромбоцитната агрегация чрез SNP, SNAP и BAY 41-2272 бяха придружени от 7,0-, 7,6- и 12,3-кратно увеличение (P Фигура 4
Ефект на илопрост върху агрегацията на тромбоцитите
Предварителната обработка на тромбоцитите с илопрост (1 μM, 3 минути), аналог на простациклин, който действа директно в cAMP/PKA сигналния път, почти премахва индуцираната от ADP агрегация на тромбоцитите, както се наблюдава както при плъховете SCD, така и при HFD (н = 4; Таблица 2). Не са открити статистически разлики между контролни и HFF плъхове.
Дискусия
Настоящото изследване показва, че плъховете, хранени с диета с високо съдържание на мазнини (HFD), показват ex-vivo хиперагрегация на тромбоцитите към ADP и тромбин, което е придружено от по-високо производство на ROS в рамките на тромбоцитите. Хиперагрегирането на тромбоцитите е предотвратено от антиоксидантните съединения PEG-каталаза и NAC в групата на HFD, което показва критична роля за вътреклетъчната ROS в това явление. Нещо повече, NO донорите SNP и SNAP, както и разтворимият стимулатор на гуанилил циклаза BAY 41-2272 показаха по-ниска ефективност при инхибиране на тромбоцитната агрегация при плъхове с HFD, вероятно в резултат на по-ниска продукция на тромбоцити в този модел на затлъстяване.
Тромбоцити, хипергликемия и оксидативен стрес
Повишеният оксидативен стрес може също да повлияе на функцията на тромбоцитите чрез намаляване на бионаличността на NO [12]. Азотният оксид е ROS, участващ в множество биологични функции, необходими за сърдечно-съдовата система и функцията на тромбоцитите. Съответно, в нашето проучване ADP-индуцираната тромбоцитна агрегация беше значително намалена от NO донорите, SNP и SNAP, при плъхове SCD, което беше придружено от значително повишаване на нивата на cGMP, както се очакваше. Интересното е, че при плъховете с HFD тромбоцитите са устойчиви на повишенията на cGMP в отговор на SNP и SNAP, както и на инхибиторните действия на тези агенти върху агрегацията на тромбоцитите. Вероятно излишъкът на O2 - производство в тромбоцитите на HFD плъхове дезактивира NOP, получен от SNP- и SNAP. Това е в съответствие с проучвания, проведени при пациенти със затлъстяване и пациенти със затлъстяване с диабет тип 2, при които тромбоцитите са устойчиви на глицерил нитрат и SNP [33, 34].
Хиперагрегируемост на тромбоцитите и роля на цикличните нуклеотиди
Освен пътя на NO - cGMP - PDE5, активирането на тромбоцитите се инхибира от сАМР-повдигащи агенти [46]. Повишаването на вътреклетъчните нива на сАМР може да се постигне чрез активиране на аденилат циклаза директно или чрез подходящо свързани мембранни рецептори, както и чрез предотвратяване на хидролизата на сАМР от цикличните нуклеотидни фосфодиестерази. В нашето проучване, сАМР-повишаващият агент илопрост (стабилен аналог на простациклин) потиска индуцираната от ADP агрегация на тромбоцитите както в SCD, така и в HFD групи, с изключение на това, че хиперагрегирането при HFD плъхове отразява промените в cAMP сигналния път.
Заключения
Нашите открития ясно показват, че метаболитните аномалии като последица от HFD при плъхове причиняват хиперагрегация на тромбоцитите, включваща повишена продукция на интратромбоцитни ROS и намалена бионаличност на NO, придружена от потенциални дефекти в групата на протезния хем на sGC.
- Роля на Keystone видове в екосистема National Geographic Society
- Роля на променения бъбречен липиден метаболизъм в развитието на бъбречна травма, предизвикана от високо съдържание на мазнини
- Профил на видовете тихоокеански херинга, Аляска, Департамент по риба и дивеч
- Профил на тихоокеанския вид камбала, Департамент по риба и дивеч в Аляска
- Немлечни ферментирали напитки; пробиотик; пребиотична роля на носител