Резюме
При предаване, човешкият имунодефицитен вирус тип 1 (HIV-1) установява инфекция на лимфния резервоар, което води до дълбоко изчерпване на паметта CD4 + Т-клетъчна популация, въпреки индуцирането на адаптивния имунен отговор. Бързата еволюция и асоцииране на вирусните варианти, които имат различни характеристики с различни етапи на инфекция, нивото на вирусното натоварване и скоростта на прогресиране на заболяването предполагат роля за вирусните варианти в този процес. Тук разглеждаме литературата за вариантите на ХИВ-1 и болестта и обсъждаме значението на вирусната годност за предаване и заболяване.
Предаване и избор на варианти
Предаването на ХИВ-1 може да се случи по сексуален, парентерален или вертикален път на инфекция (Lamers et al., 1993; Mulder-Kampinga et al., 1993; Pang et al., 1992; Scarlatti et al., 1993; Wolfs et, 1992; Wolinsky et al., 1992; Zhang et al., 1993; Zhu et al., 1993). Всеки от тях представлява отделна среда и следователно отделен набор от фактори, влияещи върху избора на вирусни варианти. Изследванията, фокусирани върху фактори, влияещи върху селекцията на ХИВ-1, са разгледали множество въпроси, вариращи от стохастични срещу селективни модели на предаване, единични срещу множество варианти на предаване, безклетъчно срещу свързано с клетки предаване на вируси, критерии за подбор за ограничаване на предаването на варианти и разделяне на варианти в хоста избор на вариант на пристрастия по време на предаване.
Вертикалното предаване или предаването от майка на дете (MTCT) също е широко проучено и изследванията се опитват да отговорят на подобни въпроси като при предаването по полов път. При MTCT обаче възниква допълнителен слой фактори по отношение на временния характер на събитието за предаване. По-конкретно, предава ли се предапарум (in utero), интрапартума (при раждане) и/или след раждането (чрез кърмене) и какъв, ако има такъв, ефект има върху профилите на варианта на предаване? Проучванията са установили, че предаването на вируса може да се случи по време на всяка от тези фази на бременността, но ефектът върху вариацията на предаване остава неуловим (Courgnaud et al., 1991; Ehrnst et al., 1991; De Rossi et al., 1992; Lepage et al., 1987; Soeiro et al., 1992; Ziegler et al., 1985). Подобно на предаването по полов път, големи, незначителни и множество варианти на предаване се наблюдават и в случаите на MTCT (Dickover et al., 2001; Kliks et al., 1994; Lamers et al., 1994; Narwa et al., 1996; Nowak et, 2002; Briant et al., 1995; Pasquier et al., 1998; Wade et al., 1998; van't Wout et al., 1994). Повечето проучвания обаче откриват единични варианти на предаване и по-голяма хомогенност в рамките на новозаразеното дете в сравнение с майката, което предполага селективен натиск по време на предаването (Dickover et al., 2001; Becquart et al., 2002; Nowak et al., 2002; Wike et al., 1992; Wolinsky et al., 1992; Mulder-Kampinga et al., 1993; Ahmad et al., 1995; Roth et al., 1996; Scarlatti et al., 1993). Дали тези селективни критерии са еднакви или подобни на тези, участващи в предаването по полов път, остава неизвестно.
Квазивидова еволюция след предаване
След като настъпи успешно събитие за предаване, мутациите във вирусния геном, имунния натиск на гостоприемника и наличността на целевите клетки стимулират диверсификацията и еволюцията на HIV-1, което в крайна сметка води до вирусни варианти, които се различават от основните родители вируси. Въпреки че първоначално може да има малка загуба на репликационен капацитет, тези нови варианти са способни да избегнат имунната защита на гостоприемника, да продължат и в крайна сметка да предизвикат изчерпване на CD4 + Т клетки и прогресия към СПИН.
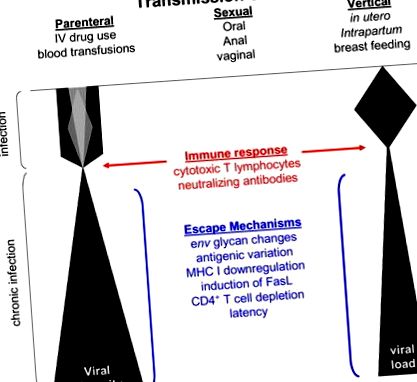
Еволюцията на HIV-1 е бърза поради висока степен на репликация на вируса, репликация на обратна транскриптаза (Coffin, 1995; Mansky and Temin, 1995; Preston et al., 1988; Roberts et al., 1988), транскрипция от гостоприемник РНК полимераза II (Laakso и Sutton, 2006), рекомбинационни събития между коинфекция на вирусни варианти на HIV-1 (Charpentier et al., 2006; Coffin, 1995; Jung et al., 2002; Kemal et al., 2003; Levy et al., 2004; Philpott et al., 2005; van Rij et al., 2003; Zhuang et al., 2002) и бърза медиирана от имунната система селекция на вирусни варианти (Jung et al., 2002; Williamson et al., 2005). Комбинацията от тези събития непрекъснато води до разнообразие на HIV-1 при заразените гостоприемници (Фигура 1). Въпреки това се поставят ограничения върху мутациите, които могат да бъдат включени във вирусния геном поради структурни и функционални изисквания на кодираните протеини, участващи във вирусната репликация (Draenert et al., 2006).
Схематична диаграма, представяща промени във вирусното разнообразие и вирусно натоварване по време на инфекцията. Количеството вирусно разнообразие при или скоро след предаването се посочва от различните засенчвания по време на първичната инфекция. Показани са фактори, които могат да повлияят на вирусното разнообразие, селекция и постоянство.
По време на началните етапи на инфекцията, избрани мутации изглежда благоприятстват имунното бягство, а не засилената вирусна репликация (Martinez-Picado et al., 2006; Leslie et al., 2004; Goepfert et al., 2008). Въпреки това, късно по време на асимптоматичния хроничен стадий на инфекция, когато имунното налягане е било премахнато чрез унищожаване на имунните клетки или изчерпване на имунните отговори, мутациите с нарастваща вирусна репликация започват да се появяват или да се появяват отново в популацията на вируса (Mild et al., 2007). Тези данни предполагат, че ранните мутации по време на инфекцията се избират въз основа на имунно избягване, а не на засилена вирусна репликация, докато през по-късните етапи на инфекцията изглежда, че по-патогенни, но по-малко имуноуклонни вируси стимулират прогресията на заболяването. Тази хипотеза се подкрепя от проучвания на SIV при макаци, където има разходи за фитнес, за да се избяга от CTL отговорите рано след инфекцията (Friedrich et al., 2004). С течение на времето обаче се появяват варианти с повишен репликативен капацитет и в крайна сметка стимулират прогресията на заболяването (Kimata et al., 1999; Rudensey et al., 1995).
Допълнителните корелати на прогресията на СПИН включват по-бавен процент на синонимни заместителни нива, показателен за общите, неселективни мутационни нива (Lemey et al., 2007; Stilianakis and Schenzle, 2006), повишена вирусна репликация (Kimata et al., 1999; Birch et al., 2001; Dyer et al., 1999; Kirchhoff et al., 1995; Learmont et al., 1999), персистираща имунна активация (Bofill et al., 1996; Grossman et al., 2006; Giorgi et al. ., 1999; Sousa et al., 2002), широкообхватни CTL отговори (Karlsson et al., 2007; Fernandez et al., 2007) и специфични алели на гостоприемник на човешки левкоцитен антиген (HLA) клас I (Carrington et al., 1999; Trachtenberg et al., 2003).
Корелати на патогенността: фенотипни промени по време на вирусна инфекция
Фенотипните характеристики на ХИВ-1, които са широко проучени за корелация с прогресията на заболяването, включват репликационен капацитет (наричан също репликативна годност), който обикновено се класифицира като бърз/висок или бавен/нисък във връзка с репликацията и производството на вирус ( De Rossi et al., 2005; De Rossi et al., 1993; Connor et al., 1993), индуциране на синцитий, класифициран като несинцитиев индуциращ (NSI) или синцитиев индуциращ (SI) вирус (Koot et al., 1992; Jurriaans et al., 1994), използване на ко-рецептори с по-голямата част от вирусни варианти, класифицирани като CCR5-използващи (R5), CXCR4-използващи (X4) или двойно-тропични (R5X4) вируси (Littman, 1998; Doms и Peiper, 1997) и варианти на макрофаги-тропици (М-тропик) или Т-клетки-тропици (Т-тропици). Преди се смяташе, че тези фенотипни характеристики са тясно свързани, така че бързите/високо вирусни варианти са също SI, X4, Т-тропните варианти и бавните/ниските вируси са NSI, R5, М-тропните варианти (Alkhatib et al., 1996a; Tersmette et al., 1988; Tersmette et al., 1989). Въпреки това, въпреки че има корелация с употребата на ко-рецептори, способността на SI и тропизма, това са отделими фенотипни характеристики и следователно трябва да бъдат индивидуално тествани при характеризиране на вирусни изолати (Aquino-de Jesus et al., 2000; Peters et al., 2006).
След предаването R5-тропните вируси обикновено преобладават в ранните стадии на инфекции (Connor et al., 1997). Въпреки това остава неясно дали R5 вирусите са единствените предавани вируси или и R5, и X4 вирусите могат да бъдат предадени, но че X4 вирусите са по-малко годни, което води до откриване само на варианти R5 по време на ранните етапи на инфекцията. Тези проучвания за изолиране на вируси също показват, че Х4 и двойно-тропните вируси обикновено не се откриват до много късно при инфекции на прехода от асимптоматична инфекция към СПИН. Освен това, варианти на X4 се откриват само в 50% от случаите (Berger et al., 1999), което показва, че вариантите X4 не са необходими, за да стимулират прогресията към СПИН (Campbell et al., 2003; Kimata et al., 1999; Kwa et al., 2003; Koot et al., 1993; Tersmette et al., 1989).
Има експериментални доказателства, че вариантите на X4 могат да бъдат по-податливи на контрол от CD8 + цитотоксични Т клетки, отколкото R5 вируси (Harouse et al., 2003). Всъщност, вариантите на X4 могат бързо да бъдат избрани по време на първичната инфекция, което позволява да се появят варианти R5 и да преобладават в инфекцията. По този начин X4 вирусите, които се появяват късно при инфекция, не е задължително да стимулират прогресията на заболяването, а по-скоро служат като индикатори за изтощена и нефункционираща имунна система, която позволява неконтролирана репликация на вируси и унищожаване на останалата популация на CD4 + Т клетки.
Клетъчният тропизъм също е широко проучен in vivo и in vitro. Съвременният модел е, че М-тропните вируси преобладават по време на ранните етапи на предаване, тъй като се смята, че пребиваващите в тъканите макрофаги, моноцити и дендритни клетки са първоначални клетъчни мишени по време на действителното събитие на предаване. Докато инфекцията от тези клетъчни типове остава важна по време на прогресията на заболяването по отношение на латентно заразени клетъчни популации (Aquino-de Jesus et al., 2000), промяна в клетъчния тропизъм се случва рано и бързо, тъй като вирусът се пренася от мястото на инфекция в лимфните тъкани, където може да се осъществи силна репликация в CD4 + Т клетки.
И накрая, изглежда има избор на варианти на NSI по време на предаването (van't Wout et al., 1994; Zhu et al., 1993; Tersmette et al., 1988; Keet et al., 1993), но дали фенотипната промяна от предадения NSI вирус към вариант SI е важен за прогресирането до СПИН изисква по-нататъшно проучване. Вирусологичните проучвания показват, че преминаването от фенотип на NSI към SI не е необходимо за прогресия на СПИН (Fitzgibbon et al., 1998; Spencer et al., 1994), но може да увеличи скоростта на прогресия на СПИН (Fauci, 1996; Glushakova et al., 1998).
Простото обяснение на появата на всяка от тези фенотипни характеристики по време на инфекцията е, че с увеличаване на вирусното разнообразие се увеличава степента на прогресия на СПИН, като по този начин разнообразието, както се посочва от появата на тези фенотипове, а не от функциите на съответните фенотипове води до СПИН прогресия (Sagar et al., 2003). Следователно може да не е присъствието само по себе си на вирусни варианти X4 и SI, а по-скоро отслабването на селективния натиск от имунния отговор на гостоприемника върху генерализирана вирусна репликация, което позволява израстване на фенотипове, насочени преди това към имунен отговор, които служат просто като индикатори на отслабен и дисфункционален имунен отговор (Troyer et al., 2005).
Вирусни детерминанти, променящи фенотипа
Фенотипните разлики между вирусните варианти са проучени и картографирани в специфични региони на вирусния геном, включително env, pol и nef. Генът env е основна детерминанта във вирусната репликативна годност, тъй като неговите протеинови продукти, gp120 и gp41, посредничат за клетъчното свързване чрез рецептора и ко-рецепторите и сливането на клетъчната плазмена мембрана и вирусната мембранна обвивка (Baribaud and Doms, 2001; Berger et al., 1999; Poignard et al., 2001). Многобройни проучвания са документирали, че env последователностите влияят върху вирусното предаване (Hsu et al., 2003; Tersmette et al., 1988), клетъчен тропизъм (Berger, 1997; Hoffman and Doms, 1999; Alkhatib et al., 1996b; Choe et al., 1996; Deng et al., 1996) и са основни цели на имунния отговор на гостоприемника (Levy, 1993; Richman et al., 2003; Wei et al., 2003b), включително CTL и неутрализиращи отговори на антитела (Jones et al. ., 2004; Borrow et al., 1997; Geels et al., 2003). Освен това env последователностите изглежда оказват най-голямо влияние върху конкурентната вирусна репликативна годност in vitro в сравнение с други региони на вирусния геном (Ball et al., 2003).
Моделни системи за измерване на вирусен фенотип и годност
В цялата литература се откриват корелации на вирусния фенотип и репликативната годност. Повечето проучвания за определяне на фенотип и фенотипни промени (напр. Тропизъм, инфекциозност и способност за индуциране на синцитий) обикновено се извършват при in vitro тестове за репликация на единичен вирус. Класическото определение за годност задължително изисква някакъв аспект на пряката конкуренция за ограничени ресурси; следователно едновирусни инфекции и анализи не могат да бъдат приложени за директен отговор дали един вирусен вариант е по-подходящ в дадена среда спрямо друг вариант в същата среда. Относително малко проучвания са комбинирали изследвания на вирусен фенотип с анализи за репликация на двойни вируси, за да се определи пригодността на вирусния вариант.
Поради ограниченията за изучаване на пригодността на HIV-1 in vivo, заразяването на макаци с SIV остава критичен модел за изследване на въпросите за пригодността на HIV-1 и патогенезата. Моделната система позволява включване на вирусни резултати за фитнес при наличие на променящи се популации от целеви клетки, имунен отговор и вариабилност на гостоприемника и в контекста на инфекция със свързан лентивирус. Той също така позволява да се изследва годността с варианти на известен in vitro фенотип и in vivo патогенност. Всъщност скорошно проучване показа, че вариант на SIV с повишен репликационен капацитет и патогенност демонстрира по-висока конкурентна способност за репликация на вируса in vitro в сравнение с бавно репликиращия се и минимално патогенен родителски клон (Voronin et al., 2005). Този тип изследвания предоставят важни експериментални доказателства в подкрепа на хипотезата, че вирусната годност влияе върху патогенезата на HIV-1.
Системата за макак модел също е използвана за изследване на ефектите от двойни вирусни инфекции в гостоприемника. Тези проучвания са използвали предимно химерни конструкции на R5- и X4-тропични SHIV (Burke et al., 2006; Wolinsky et al., 2004; Otten et al., 1999). Тези проучвания с двойни вирусни инфекции са жизненоважни за разбирането на вирусната годност в пълния контекст на инфекция, където присъстват както вирусни, така и гостоприемни фактори и влияят върху резултатите от фитнеса на вариантите. Въпреки това са проведени малко проучвания с използване на двойни вирусни инфекции, за да се изследва конкретно относителната годност на вариантите и кои детерминанти са в състояние да предоставят предимства за фитнес на различни етапи на инфекция и болестни състояния (Harouse et al., 2003). Освен това, тези проучвания са ограничени до състезания с R5-тропични и X4-тропични вируси. Допълнителни проучвания с различни варианти, включително R5-тропни вируси с различни фенотипи, допълнително ще подобрят нашето разбиране за вирусните детерминанти, влияещи върху предаването, персистирането и заболяването.
ЗАКЛЮЧЕНИЕ
Пътят на предаване на ХИВ-1 изглежда диктува до известна степен вида и броя на вирусните варианти, които включват първоначалната популация от вируси в новоинфектиран гостоприемник. Особено интересни, както беше обсъдено по-горе, са аспектите, контролиращи селекцията по време на предаване, при които различни фактори, вариращи от времето на контакт между вирусите, попаднали във вагиналната кухина, спрямо ректалните тъкани до безклетъчните вириони спрямо вирусите, свързани с клетките, до моделите на гликозилиране, открити на gp120, изглежда влияят на броя и вида на предадените вируси. Освен това, имунните отговори на гостоприемника и съответните противозащитни мерки на заразяващите варианти, които позволяват избягване на имунния отговор, представляват среда на износване. Докато силата на имунния отговор може първоначално да определи вирусните зададени точки и скоростта на загуба на CD4 + Т клетки, латентността и високата променливост позволяват на HIV-1 да подкопае някои имунни отговори на гостоприемника и да избегне други имунни отговори, което води до дълбоко изчерпване на CD4 + Популации от Т клетки и поява на СПИН.
Свързването на вирусните фенотипове с патогенността е довело до идентифициране на областите от интерес във вирусния геном, които оказват влияние върху репликацията и персистирането. Ще бъдат необходими допълнителни проучвания на способността за конкурентно възпроизвеждане, за да се хвърли допълнителна светлина върху значението на тези промени за вирусната годност в ранните и късните етапи на инфекцията. Във връзка с това ще е необходима инфекция на макаци с варианти на SIV, за да се осигурят безценни резултати за дешифриране на детерминантите за годност за предаване и патогенеза.
Благодарности
J. T. K. се подпомага от грант на NIH R01 AI047725, а T. B. се подпомага от грант за обучение по NIH по молекулярна вирусология (T32-AI07471).
- Фактори на риска от хипокинетични заболявания - упражнения и здравен фитнес
- Гъбата ли е изчезналото лекарство срещу затлъстяването и съвременните заболявания - Dre Fitness
- Гастроезофагеалната рефлуксна болест свързана ли е със сърдечни заболявания
- Гастроезофагеалната рефлуксна болест свързана ли е със сърдечни заболявания; Член; Армията на Съединените щати
- Четене на етикети; фондацията на FDA за целиакия