Недохранването, обхващащо дефицит както на макро-, така и на микро-хранителни вещества, остава едно от най-честите усложнения на свързаното с алкохола чернодробно заболяване (ArLD). Протеиново-енергийното недохранване може да причини значителни усложнения, включително саркопения, слабост и имунодепресия при пациенти с цироза. Недохранването намалява оцеляването на пациента и влияе отрицателно върху качеството на живот на хората с ArLD. Освен това, хранителният дефицит увеличава вероятността от чернодробна декомпенсация при цироза. Бързото разпознаване на рисковите индивиди, ранната диагностика и лечението на недохранването остава ключов компонент на управлението на ArLD. В този преглед ние описваме патофизиологията на недохранването при ArLD, разглеждаме скрининговите инструменти, налични за хранителна оценка и обсъждаме стратегии за управление на храненето, свързани с различните етапи на ArLD, вариращи от остър алкохолен хепатит до декомпенсиран краен стадий на чернодробно заболяване.
Основен съвет: Недохранването е често усложнение на свързано с алкохола чернодробно заболяване (ArLD), което, ако не се лекува, може да повлияе неблагоприятно на резултата и възстановяването на пациента. Бързото разпознаване на хранителното изчерпване може да идентифицира тези пациенти, които са изложени на по-висок риск от клинична декомпенсация, но има малко насоки за информиране на клиничното управление на тези сложни пациенти. В тази статия ние обсъждаме патофизиологията и лечението на дефицит на микро- и макро-хранителни вещества в ArLD и предоставяме препоръки за лечението на пациенти в различни етапи на тяхното заболяване.
- Цитат: Kamran U, Towey J, Khanna A, Chauhan A, Rajoriya N, Holt A. Хранене при свързано с алкохола чернодробно заболяване: Физиопатология и управление. Свят J Gastroenterol 2020; 26 (22): 2916-2930
- URL:https://www.wjgnet.com/1007-9327/full/v26/i22/2916.htm
- DOI:https://dx.doi.org/10.3748/wjg.v26.i22.2916
Не може да има съмнение, че липсата на насоки за клинична практика, насочени към оценка и степенуване на недохранването, свързано с ArLD, обяснява лошото разпознаване, диагностика и лечение на това състояние в клиничната практика. Целта на тази статия е да определи съответната патофизиология, да обобщи режимите на оценка и да обсъди оптималното управление на храненето при различни форми на ArLD.
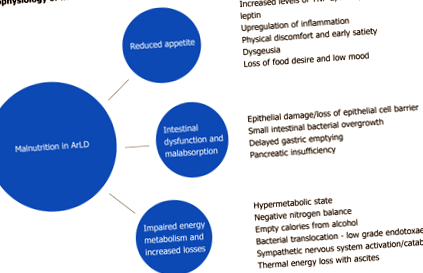
Недохранването в ArLD и AcLD е многообразно и се състои от много взаимозависими елементи, но просто увеличаването на наличността на енергийни добавки не е достатъчно, за да противодейства на мощните сили, които движат катаболното състояние. Тук изследваме някои от елементите, които допринасят за състоянието (Фигура 1).
Алкохолът се абсорбира чрез дифузия в стомаха и в по-малка степен дванадесетопръстника и йеюнума. Докато острата и прекомерна консумация на алкохол може да причини стомашни и дуоденални ерозии и преобладаваща вилусна загуба на епител в горната част на йеюнума [29], ефектите от хроничната консумация на алкохол върху чревната лигавица са слабо разбрани. Те могат да включват чревна фиброза и свръхрастеж на аеробни и анаеробни микроорганизми, които допринасят за функционални и морфологични аномалии на тънките черва [30]. Герова и др [31] съобщава за по-висока честота на бактериална колонизация в тънките черва при пациенти с ArLD, като промените настъпват независимо от етапа на чернодробна дисфункция, което предполага, че директният ефект на алкохола върху подвижността на червата и имунитета създава пермисивна микросреда за свръхрастеж на тънките черва сайтове.
В допълнение към промените в чревния микробиом, хроничният прием на алкохол може да доведе до намаляване на адхезията на епителните клетъчни плътни връзки [32], което води до повишена чревна пропускливост, бактериална транслокация и последващо увеличаване на провъзпалителните цитокини и липополизахариди [33]. Хроничната консумация на алкохол нарушава подвижността на червата и индуцираният от алкохол химичен гастрит забавя изпразването на стомаха, като и двете значително увеличават времето за транзит на оро-цекал [34], което води до нарушена абсорбция на хранителни вещества. Освен това алкохолът е важен рисков фактор за хроничен панкреатит и екзокринна недостатъчност на панкреаса (PEI), който може да влоши малабсорбцията [35] .
Прекомерният прием на алкохол за продължителен период води до нарушена инсулинова резистентност и повишена сърдечно-съдова заболеваемост и смъртност [48, 49]. При хронична консумация на алкохол гликогенните запаси на черния дроб се изчерпват, докато при остри епизоди на тежка консумация на алкохол (препиване) глюконеогенезата се инхибира и се стимулира чернодробната гликогенолиза за предотвратяване на хипогликемия. Следователно, докато при здрав индивид острата консумация на алкохол е малко вероятно да причини промени в евгликемичното състояние, при пациенти с хронично чернодробно заболяване острата консумация на алкохол може да предизвика хипогликемия [50, 51] .
Ниските до умерени дози алкохол имат малък или никакъв ефект върху баланса на мускулния протеин, но острото поглъщане на големи дози алкохол и хроничната злоупотреба с алкохол причиняват промени както в метаболизма на цялото тяло, така и в специфичния за тъканите метаболизъм чрез увеличаване на екскрецията на азот [52]. Миопатията е често усложнение на хроничния алкохолизъм и е резултат от продължителен дисбаланс между растежа и разграждането на мускулните протеини [53, 54] .
Черният дроб играе централна роля в липидния метаболизъм, който следва сложна мрежа от реакции и взаимодействие на хормони, ядрени рецептори, вътреклетъчни сигнални пътища и транскрипционни фактори. Свободните мастни киселини (FA) се синтезират от черния дроб от гликолитични пътища и се мобилизират директно от червата и мастната тъкан. Алкохолът инхибира пътищата на окисляване на FA (чрез намаляване на експресията на няколко PPARα-регулирани гени) [55] и увеличава естерификацията на FAs, което води до повишено натрупване на интрахепатален триглицерид [56]. Алкохолът също влияе върху износа на FA от черния дроб чрез потискане на микрозомалния триглицериден трансферен протеин, както се наблюдава при черния дроб на животни, хранени с етанол, което е необходимо за сглобяването на липопротеини с много ниска плътност преди износа [57]. Резултатът е интрахепатално натрупване на мазнини, което в крайна сметка прогресира до цироза в резултат на итеративни цикли на нараняване и клетъчна смърт, свързани с продължителен излишък на алкохол.
Хроничната консумация на алкохол и жълтеница водят до спадане на нивата на витамин А [61]. Метаболизмът на витамин А е подобен на алкохолния метаболизъм в човешкото тяло, тъй като и двата включват окислителни пътища и следователно са уязвими от промени в основното редокс състояние на черния дроб [62]. Алкохолната дехидрогеназна активност и цитохром 2Е1 влияят негативно на ретиноидната хомеостаза [63], а хроничната консумация на алкохол води до изчерпване на чернодробните и плазмените нива на ретиноидите и ретиноид свързващите протеини [64, 65]. Смята се също, че алкохолът инхибира разцепването на β-каротин, хранителен провитамин А каротеноид [66]. Недостигът на витамин А може да доведе до клиничното представяне на нощната слепота.
Различни механизми, в допълнение към диетичната недостатъчност, се предполагат, че отчитат дефицита на витамин С в контекста на хронична консумация на алкохол [67]. Алкохолно индуцираната ентероцитна токсичност води до чревна малабсорбция и хепатотоксичност, които инхибират чернодробната трансформация на различни витамини (включително витамин С) до техните активни метаболити [68]. Дисбалансът във витамин С се влошава от повишената екскреция на аскорбинова киселина с урината след епизоди на излишък на алкохол [69]. Някои проучвания предполагат, че предварителната обработка с витамин С значително подобрява клирънса на етанол в кръвта, вероятно в резултат на способността му да доставя пероксид и по този начин позволява на каталазата да допринася за окисляването на етанол [70]. Клиничната проява на недостиг на витамин С е именно скорбут и може да се прояви като лошо зарастване на рани, подуване на венците, кървене от венците, загуба на зъби и лигавични петехии; късното заболяване може да бъде животозастрашаващо с анасарка, хемолиза и жълтеница [71, 72] .
Цинкът се абсорбира чрез метаболитни транскрипционни фактори и играе ключова роля в регулирането на генната експресия. При мишките, хранени с алкохол, алкохолът нарушава пропускливостта на червата и увеличава оксидативния стрес, предимно на нивото на дисталното тънко черво, което пречи на хомеостазата на цинка и води до намалена концентрация на цинк в илеума [73]. Проучванията при животни показват, че добавките с цинк запазват чревната цялост и предотвратяват ендотоксемия, което води до инхибиране на индуцираното от ендотоксин производство на TNF-α в черния дроб както при остри, така и при хронични условия на излагане на алкохол [74]. В допълнение към намалената ентерална абсорбция и увеличената екскреция на цинк с урината, пациентите с цироза, свързана с алкохола, често имат диети, в които липсват протеини и цинк, като недостигът на цинк е често срещана (и лесно коригируема) причина за дисгевзия. Дефицитът на цинк може да се прояви като акродерматит, анорексия, хипогонадизъм, променена имунна функция, лошо заздравяване на рани, нарушено нощно виждане, диария, нарушена умствена функция и портална системна енцефалопатия [75, 76] .
Магнезият е вторият най-разпространен микроелемент в човешкото тяло и дефицитът е почти универсален при лица с високи нива на консумация на алкохол и/или чернодробни заболявания. Това е критична детерминанта на метаболизма, действайки като кофактор в повече от 300 ензимни реакции, участващи в синтеза на протеини и нуклеинови киселини и енергийния метаболизъм. Алкохолът увеличава отделянето на магнезий с урината и общите запаси от магнезий в тялото се изчерпват при почти всички пациенти с цироза, свързана с алкохола [77]. По-нататъшни нечувствителни загуби възникват в резултат на свързана с алкохола диария, повръщане и едновременна употреба на лекарства като диуретици и аминогликозиди. Хипомагнезиемията предразполага към метаболитни костни заболявания, сърдечно-съдови съпътстващи заболявания и е свързана с припадъци, депресия и нервно-мускулни аномалии [78, 79] (Таблица 1).
| Хранителни вещества | Ефект от приема на алкохол | Резултати | |
| Въглехидрати | Остър прием на алкохол | Инхибира глюконеогенезата; стимулира чернодробната гликогенолиза | Хипогликемия; хипергликемия |
| Хроничен прием на алкохол | Инхибира стимулираната от лактат глюконеогенеза; богата на въглехидрати храна, приета с алкохол | Хиперлактатемия; забавено парадоксално хипогликемично състояние | |
| Протеини | Остър и хроничен прием на алкохол | Повишава отделянето на азот; дисбаланс между растежа и разграждането на протеините | Изхабяване на мускулите и миопатия |
| Липиди | Остър и хроничен прием на алкохол | Инхибира β-окисляването и увеличава естерификацията на мастните киселини | Повишено натрупване на триглицериди в хепатоцитите Фиброза |
| Тиамин | Хроничен прием на алкохол | Недостатъчен хранителен прием Намалена абсорбция | Синдром на Вернике Корсаков |
| Фолат | Хроничен прием на алкохол | Намален хранителен прием; чревна малабсорбция; намалено поемане на черния дроб, съхранение; повишено отделяне на урина | Макроцитна анемия; мускулна дисфункция |
| Витамин А | Хроничен прием на алкохол | Потискат разцепването на β-каротин, хранителен провитамин А каротеноид | Ксерофталмия и нощна слепота |
| Витамин Ц | Хроничен прием на алкохол | Чревна малабсорбция; хепатотоксичността инхибира чернодробната трансформация до техните активни метаболити | Скорбут и лошо зарастване на рани |
| Цинк | Хроничен прием на алкохол | Нарушава пропускливостта на червата; намалява концентрацията на илеална цинк; повишено натрупване на реактивни кислородни видове и нива на ендотоксин в плазмата | Акродерматит; анорексия; хипогонадизъм; променена имунна функция; лошо заздравяване на рани; нарушено нощно виждане; диария; нарушена умствена функция и портална системна енцефалопатия |
| Магнезий | Хроничен прием на алкохол | Увеличава отделянето на магнезий с урината | Сърдечно-съдови: Хипертония, инсулт и инфаркт на миокарда; Неврологични: Припадъци, депресия и нервно-мускулни аномалии |
Взаимодействията на дефицити на двувалентен катион като селен и магнезий са слабо разбрани, но изглежда играят ключова роля в имунната пареза, наблюдавана при цироза, свързана с алкохола. Дефицитът на селен е често срещан при алкохолна зависимост [80, 81] и е пропорционален на стадия на заболяването и повишените нива на противовъзпалителни цитокини, които играят роля при увреждане на черния дроб и фиброза. Съвременните данни сочат, че метаболизмът на микроелементите е нарушен при декомпенсирано чернодробно заболяване и че чрез заместване на тези елементарни дефицити, клиницистите могат да бъдат в състояние да противодействат на някои от имуно-парезите и разстройствата на настроението, често срещани в тези недохранени състояния [82, 83] .
Няма златен стандарт за оценка на недохранване при чернодробни заболявания и нито един специално разработен за пациенти с ArLD, но има редица скринингови инструменти [97], които са разработени за оценка на риска от недохранване, въпреки че повечето нямат външна валидация. Инструментът за скрининг за недохранване на чернодробните заболявания [98] е инструмент за скрининг на хранене с 6 въпроса, за който е установено, че точно идентифицира недохранването (93%) при пациенти с чернодробна цироза, въпреки че не е проучен при по-дългосрочни резултати. Докато Инструментът за приоритетно определяне на хранителните нужди на Royal Free Hospital (RFH-NPT) [99] е адаптиран да отчита претоварването с течности. RFH-NPT е лесен за употреба, бърз за изпълнение и е добър предиктор за клинично влошаване. Като се има предвид голямото разпространение на недохранване и саркопения при свързана с алкохола цироза, всички пациенти трябва да се подложат на хранителен скрининг в точката на представяне, в идеалния случай като се използва стандартизиран скринингов инструмент като RFH-NPT [100] .
Индексът на телесна маса (ИТМ) често се изкривява при пациенти с хронично чернодробно заболяване от състояния на задържане на течности като анасарка или асцит. Нещо повече, саркопенното затлъстяване е друга същност, характеризираща се с прекомерна мастна тъкан и лоша мускулна маса и функция [101]. В тези условия ИТМ се оказва неадекватна метрика, чрез която да се предскажат усложнения и трябва да се използва в комбинация с обективни измервания на мускулната маса и сила.
При пациенти с декомпенсирана цироза, дължаща се на ArLD, почти винаги е посочена допълнителна хранителна подкрепа, особено при пациенти с асцит. Важно е да се избягват продължителни периоди на гладно, за да се сведе до минимум разграждането на мускулните и мастните запаси за използване като метаболитно гориво, а редовният режим на хранене на 2-3 часа, включително закуска преди лягане, може да го подкрепи. Въпреки че корекциите на честотата на доставяне на енергия са ефективно средство за предотвратяване на ускорена загуба на скелетна мастна маса чрез инхибиране на глюконеогенезата; пациентите, които пасат непрекъснато през целия ден, защитават мускулите, но може да не консумират достатъчно калории, за да запазят мастните запаси и може да са необходими допълнителни калории, за да се предотврати загубата на мастна тъкан [106]. Следователно енергийните нужди при компенсирана цироза се изчисляват на 25-30 kcal/kg на ден и 30-35 kcal/kg на ден при декомпенсирана цироза. За пациенти със затлъстяване (ИТМ> 30 kg/m 2) енергийните нужди се оценяват на около 25 kcal/kg на ден (Фигура 3). Всички изисквания трябва да се основават на изчисленото сухо телесно тегло и изчисления ИТМ.
Назо-стомашното (NG) или назо-йеюналното (NJ) хранене е клинично показано, когато енергийните и/или протеиновите нужди не могат да бъдат задоволени само чрез перорален прием. Други показания за започване на хранене с NG/NJ при цироза на черния дроб включват ранно насищане от асцит, огнеупорен асцит, оптимизиране на енергийните и протеинови нужди или хронично повръщане. Кърнс и др [107] назначи контролна група с AAH със съпътстваща цироза, за да получи стандартен орален прием, докато друга група получи ентерално хранене в допълнение към 40 kcal/kg на ден и 1,5 g/kg на ден протеин през устата. Ентерално хранената група получава 200% повече енергия от контролите и показва подобрение в азотния баланс, серумния албумин и HE (P ≤ 0,02) след 3 седмици. Докато това проучване демонстрира краткосрочно подобрение на хранителния статус и намаляване на свързаните с черния дроб нежелани събития, малкият размер на извадката и естеството на напречното сечение на това проучване ограничават оценката на дългосрочните резултати. Други проучвания подчертават рисковете от интензивно хранене със сонда при цироза и запазването на поставянето на краткотрайни епруветки за хранене in situ може да бъде предизвикателство, особено при объркани пациенти [18, 108] .
Симптомите на бактериален свръхрастеж в тънките черва (SIBO) включват диария, стеаторея, хронична коремна болка, подуване на корема и метеоризъм, въпреки че някои пациенти могат да бъдат безсимптомни. Често се диагностицира чрез изследването и лечението на дишане с водород или метан обикновено изисква курс на неусвоени антибиотици като рифаксимин или неомицин. Един мета-анализ [114] идентифицира потенциална роля за употребата на пробиотици, пребиотици и симбиотици - като стигна до заключението, че пробиотиците се понасят по-добре от лактулозата, подобрява SIBO и управлението на минимално ВО [съотношение на риска (RR) 0,40, 95% CI: 0,32-0,50, P [115] и трябва да се отбележи, че употребата на хемоглобин като директен маркер на гликемичния контрол може да бъде неточна в контекста на анемия или скорошни кръвопреливания и трябва да се тълкува с повишено внимание.
Хранителната оценка и управлението на пациенти с ArLD се усложнява от броя на патогенните механизми, участващи в клиничното влошаване на състоянието на пациентите. Изчерпването на хранителните и микроелементите обикновено се свързва с ArLD и пациентите могат бързо да развият характеристики на тежката PEM, освен ако стратегиите за хранително управление не бъдат инициирани незабавно. Освен това усложнения като хранителна имуно-пареза, саркопения и слабост могат да бъдат трудни за отстраняване, след като бъдат установени. Недохранването и саркопенията са силно свързани с развитието на усложнения от цироза, а лошото хранене остава силен предиктор както за краткосрочната, така и за средносрочната преживяемост. Независимо от това, обръщането на енергийния и протеинов дефицит както при AAH, така и при свързаната с алкохола цироза подобрява резултатите на пациентите чрез подобряване на функцията и физическото състояние и намаляване на смъртността и заболеваемостта. В този контекст е важно за клиницистите, управляващи такива пациенти, да имат добри работни познания относно хранителните терапии, специфични за чернодробни заболявания, така че лечението да може да започне бързо и да се приложи по научен начин.
Източник на ръкописа: Поканен ръкопис
Съответстващо авторско членство в професионални общества: член на Британското общество по гастроентерология, № 1193.
Тип специалност: Гастроентерология и хепатология
Държава/територия на произход: Обединено кралство
Класификация на научното качество на доклада за рецензия
Степен А (отличен): A
Степен B (много добър): B
P-рецензент: Barone M, Cravo M S-редактор: Yan JP L-редактор: E-редактор: Liu MY
- Хранене и упражнения при лечение на чернодробна цироза
- Ролята на храненето в патогенезата и профилактиката на безалкохолни мастни чернодробни заболявания
- NASPGHANESPGHAN Позиция Подкрепа за хранене на хартия за деца с хронична чернодробна болест;
- Хранително управление на холестаза - Изпрати - 2020 - Клинично заболяване на черния дроб - Онлайн библиотека Wiley
- Безалкохолна мастна чернодробна болест - храна; Списание за хранене