Резюме
Заден план
Добре известно е, че микробиотата на индуцираните с диета затлъстели мишки с високо съдържание на мазнини (HF) се различава от тази на постните мишки, но до каква степен тази разлика отразява състоянието на затлъстяване или диетата е неясна. За да разграничим промените в чревната микробиота, свързани с високо HF хранене, от тези, свързани със затлъстяването, ние се възползвахме от различната чувствителност на мишките C57BL/6JBomTac (BL6) и 129S6/SvEvTac (Sv129) към индуцирано затлъстяване и на различните им реакции до инхибиране на активността на циклооксигеназата (COX), където инхибирането на COX активността при BL6 мишки предотвратява индуцирано от HF затлъстяване, но при мишките Sv129 акцентира върху затлъстяването.
Резултати
Използвайки HiSeq-базирано цялостно геномно секвениране, ние идентифицирахме таксономични и функционални разлики в чревната микробиота на двата миши щама, хранени с редовни диети с ниско съдържание на мазнини или СН, със или без добавяне с COX-инхибитора, индометацин. Високочестотното хранене, а не развитието на затлъстяване доведе до отчетливи промени в чревната микробиота. Наблюдавахме силно нарастване на алфа разнообразието, броя на гените, изобилието от родове, за които се знае, че са производители на бутират, и изобилие от гени, участващи в производството на бутират при мишки Sv129 в сравнение с мишки BL6, хранени с LF или HF диета. И обратно, изобилието от гени, участващи в метаболизма на пропионат, свързано с повишена реколта от енергия, е по-високо при мишки BL6, отколкото при мишки Sv129.
Заключения
Промените в състава на чревната микробиота се дължат предимно на хранене с високо съдържание на мазнини, вместо да отразяват затлъстяването на мишките. Разликите в изобилието на бактерии, произвеждащи бутират и пропионат в червата, могат поне отчасти да допринесат за наблюдаваните разлики в склонността към затлъстяване при мишки Sv129 и BL6.
Заден план
Склонният към затлъстяване щам на мишка C57BL/6JBomTac (BL6) и устойчивият на затлъстяване щам на мишката 129S6/SvEvTac (Sv129) са едни от най-често използваните щамове за проучвания върху генетично и диетично затлъстяване. Ние показахме, че инхибирането на циклооксигеназната активност засилва затлъстяването, индуцирано от HF, при резистентни на затлъстяване мишки Sv129 чрез намаляване на индуцираната от диетата термогенеза и индуциране на експресията на UCP1 в ингвиналната бяла мастна тъкан [22], докато инхибирането на циклооксигеназната активност при нормално затлъстяване BL-мишки, предотвратяващи HF, предотвратяват затлъстяването, предизвикано от HF хранене [23].
Да се получи по-нататъшна представа за свързаните с диетата и затлъстяването промени в чревната микробиота и да се разграничи дали наблюдаваните промени са резултат от затлъстяване или HF хранене, ние се възползвахме от различната чувствителност на тези два миши щама към индуцирано от диетата затлъстяване и от различните им отговори на инхибиране на циклооксигеназната активност. Нашите резултати показват, че промените в чревната микробиота до голяма степен отразяват високочестотното хранене, а не затлъстяването.
Резултати
Експериментална настройка и изграждане на референтен набор от метагеном на червата
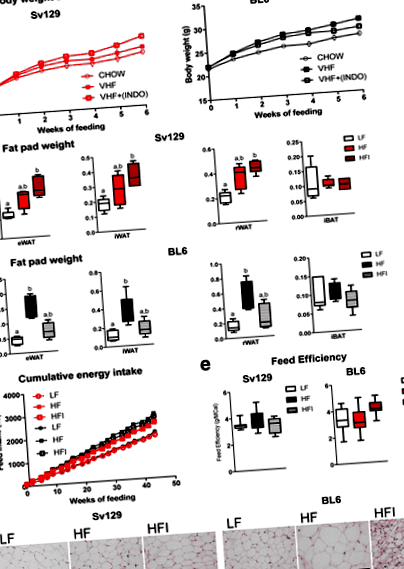
За да разграничим промените в чревната микробиота, които настъпват в отговор на обезогенна диета, от промените, дължащи се на развитието на затлъстяването, ние използвахме различната склонност на мишките BL6 и Sv129 да развият индуцирано от диетата затлъстяване и техните дивергентни реакции към лечението с общия инхибитор на циклооксигеназата индометацин . Мишките са били на диета с ниско съдържание на мазнини (LF) или са били хранени с HF диета, допълнена (HFI) или не (HF) с индометацин. В съгласие с по-ранни открития [22], включването на индометацин акцентира върху увеличеното тегло с мазнини, масата на бялата мастна тъкан (WAT) и хипертрофията при мишки Sv129 (фиг. 1). За разлика от това, добавките с индометацин предотвратяват повишено тегло, WAT маса и хипертрофия при мишки BL6 (фиг. 1) [23].
Диета-индуцирани и зависими от щама промени в чревната микробиота
Анализ на основни координати на гени, родове и KO профил (PCoA) (Фиг. 2 и Допълнителен файл 3: Фигура S2) посочи съдържанието на мазнини в храната като основен разделителен фактор (PC1) и специфичните за щама разлики между мишките Sv129 и BL6 като вторичен разделителен фактор (PC2). По-нататък PCoA демонстрира, че няма значимо разделяне между HF- и HFI-хранени мишки въз основа на микробиомните генни профили (фиг. 2) и чрез тестване на сумата на ранга на Wilcoxon (Допълнителен файл 4: Фигура S3 и Допълнителен файл 5: Фигура S4), въпреки ясния ефект на индометацин върху развитието на затлъстяването.
PCoA анализ на всички проби въз основа на генни профили. The различни цветове и форми обозначават проби от различни подгрупи, докато празен, полуизпълнен, и пълни точки съответстват на мишки, характеризирани като „слаби“ или „без значително увеличение на масата на мастната тъкан (NSI)“ и „значително увеличение на масата на мастната тъкан (SI)“. PCoA демонстрира как щамът на мишката и диетата са основните двигатели за разделяне на генно ниво
Тест PERMANOVA по подобен начин демонстрира, че диетата има по-голямо въздействие върху чревната микробиота, отколкото щам и важно е, че добавките с индометацин не оказват значително влияние върху състава на чревната микробиота на ниво ген, ниво на рода и ниво KEGG (Допълнителен файл 6: Таблица S2 ).
Съобщава се, че затлъстяването е свързано с намален брой микробни гени [11, 12]. При мишки, хранени с LF, броят на гените е значително по-висок при мишките Sv129, отколкото при мишките BL6 (фиг. 3b). HF храненето с или без добавка на индометацин увеличава броя на гените и в двата щама. По този начин се наблюдава увеличаване на броя на гените в отговор на HF хранене, независимо дали мишките остават слаби или затлъстяват. За отбелязване е, че след HF хранене не се наблюдава значителна разлика в броя на гените между двата щама (Фиг. 3b).
Консумацията на високочестотни диети предизвиква таксономични промени независимо от напрежението и развитието на затлъстяването. Тестът за ранг-сума на Уилкоксън (P Фиг. 4
Мрежа от родовете, характеризиращи мишки Sv129 и BL6. The зелени кръгове представляват родове, присъстващи в по-голямо количество в мишки Sv129, отколкото в BL6 и червени кръгове родове, присъстващи в по-голямо количество в мишки BL6, отколкото в Sv129. The площ на кръга представлява относителното изобилие на рода. The плътна линия представлява положителна корелация между два рода, докато a прекъсната линия представлява отрицателна корелация
Анализите на пътеките от ниво 1 на KEGG разкриват допълнителни промени, предизвикани от високочестотна диета, независимо от щама и затлъстяването. Относителното изобилие на KOs, свързани с клетъчни процеси и информационни процеси за околната среда, се увеличава след хранене с високочестотна диета, докато изобилието на KO, свързано с общия метаболизъм, намалява (Допълнителен файл 4: Фигура S3). За по-нататъшен анализ на засегнатите метаболитни пътища използвахме z метод за оценка [32] за функционален анализ на ниво пътеки и модули, последван от подробен анализ на промените в KO във всеки избран път и модул. Независимо от щама на мишката, HF храненето увеличава изобилието от гени, участващи в пътища и модули, свързани с метаболизма на мастните киселини, клетъчната подвижност, транспорта, метаболизма на метана и разграждането на ксенобиотиците, както и намалява в изобилието на гени, участващи в транслацията и биосинтезата на витамини. (Допълнителен файл 16: Таблица S4 и Допълнителен файл 17: Таблица S5).
Използването на глицероловата част на триглицеридите е необходимо за извличане на енергия от триглицеридите в HF диети в анаеробна среда. За да проучим дали микробиотата на червата се адаптира към повишено използване на глицерол в отговор на високочестотна диета, използвахме KEGG и NCBI за търсене на ключовия ензим в използването на глицерол, глицерол киназа, в най-разпространените родове. За отбелязване е, че глицерол киназата е открита в 18 от 25-те най-разпространени рода (Допълнителен файл 18: Таблица S6). Освен това по-голямата част от родовете, притежаващи гени, кодиращи глицерол киназа, са обогатени при мишки, хранени с високочестотни диети, докато родовете, които не могат да използват глицерол, са обогатени при мишки с ниско съдържание на мазнини, хранени с диета (Допълнителен файл 18: Таблица S6). Заедно това предполага, че повишеният капацитет за усвояване на глицерола характеризира индуцираните от HF промени в чревната микробиота в двата щама на мишки.
Жлъчните киселини играят важна роля в метаболизма на мазнините в червата и HF храненето може да доведе до повишено изискване за 7α-дехидроксилиране на жлъчната киселина. Съответно, чете класифицирани като Clostridium scindens, Clostridium hiranonis, Clostridium hylemonae, и Clostridium leptum, всички, за които се съобщава, че ускоряват 7α-дехидроксилирането на жлъчна киселина [33, 34], са открити в по-големи количества след HF хранене (Допълнителен файл 19: Фигура S13). Освен това относителното изобилие на Клостридий родът е увеличен и при двата щама на мишки в отговор на високочестотна диета (Допълнителен файл 5: Фигура S4).
Дискусия
При мишки, хранени с LF диета, забелязахме характерни разлики между мишките Sv129 и BL6. Докато Фиксира са били с по-голямо количество в Sv129, отколкото в BL6 мишки, Verrucomicrobia са били по-разпространени при мишки BL6, отколкото при мишки Sv129. Изненадващо забелязахме, че относителното изобилие на A. muciniphila, съобщава се, че поддържа функцията на чревната бариера и е свързана с резистентност към индуцирано от диетата затлъстяване [28], е по-ниска при резистентната на затлъстяване Sv129, отколкото при BL6 мишките както при LF, така и при HF диети. Това откритие подчертава, че въпреки че колонизацията от тази бактерия се противопоставя на предизвиканото от диетата затлъстяване [28, 44, 45], функцията на тази бактерия може да зависи от конкретна общностна среда, както се посочва и от големите разлики в относителната изобилие от A. muciniphila във фекални проби от мишки, държани в различни помещения за настаняване [15].
Извличането на енергия от триглицериди в анаеробна среда зависи от метаболизма на глицерола. Използвайки KEGG и NCBI за търсене на ключови ензими в използването на глицерол в най-разпространените родове, открихме, че гените, кодиращи глицерол кинази, ацилглицерол киназа или диацилглицерол киназа, са открити в 10 от 25-те най-разпространени рода и 8 от тези родове са обогатен с мишки, хранени с високочестотни диети, докато родовете, които не могат да използват глицерол, са обогатени с мишки, хранени с диета с ниско съдържание на мазнини. Това предполага, че подобна адаптация допринася за промените в чревната микробиота, предизвикани от диетата с високочестотна диета По същия начин, високочестотното хранене доведе до увеличаване на изобилието от Клостридий видове, за които се съобщава, че ускоряват 7α-дехидроксилирането на жлъчните киселини [33, 34], може да са свързани с необходимостта от метаболизъм на жлъчните киселини в отговор на приемането на диета с високо съдържание на триглицериди, но очевидно е необходима повече работа, за да се установи дали HF храненето променя жлъчката киселинен метаболизъм.
Заключения
Методи
Тествани съединения и диети
Диети с ниско съдържание на мазнини (Ssniff EF R/M) и с високо съдържание на мазнини (Ssniff EF R/M съгласно D12492) са получени от Ssniff Spezialdiäten GmbH (Германия). Диетата с ниско съдържание на мазнини (LF) съдържа 70 енергийни (e)% въглехидрати, 20 e% протеини и 10 e% мазнини, а диетата с високо съдържание на мазнини (HF) съдържа 21 e% въглехидрати, 19 e% протеини и 60 e% мазнини. За СН диета, допълнена с индометацин (HFI), 0,0016 g/100 g са включени в диетата.
Животни и жилища
Двадесет и четири мъжки мишки C57BL/6JBomTac и 30 мъжки мишки 129S6/SvEvTac, на 10 седмици, бяха получени от Taconic (Ry, Дания). Всички мишки бяха поставени в отделни клетки с дървени стърготини, държани при контролирани условия на околната среда (температура 26 ± 0,5 ° C, 12/12-часов цикъл светлина/тъмнина) и имаха свободен достъп до храна и вода.
След 1 седмица на аклиматизация, мишки от всеки щам бяха поставени в три групи (10 LF-, 10 HF- и 10 HFI-хранени мишки Sv129; 7 LF-, 8 HF- и 9 HFI-хранени BL6 мишки) и хранени с тях различни диети за 6 последователни седмици. Телесното тегло се записва два пъти седмично, а приемът на фураж се записва седмично. Всички мишки са наблюдавани поне два пъти на ден за всякакви аномалии в клиничния вид. В края на експеримента мишките се анестезират с изофлуран (Isoba-vet, Schering-Plough, Дания) и се евтаназират чрез сърдечна пункция. Съответните мастни тъкани незабавно се дисектират, претеглят, замразяват се в течен азот и се съхраняват при -80 ° C. Експериментът с животни е одобрен от Националния държавен съвет по биологични експерименти с живи животни (Норвегия и Дания) и е извършен в съответствие с одобрените насоки.
ДНК екстракция
Преди прекратяването се взема проба от пресни изпражнения и незабавно се замразява при -80 ° C. ДНК екстракциите се извършват върху 200 mg изпражнения на проба, като се използва комплектът на Macherey-Nagel Nucleospin Soil. Екстракциите се извършват съгласно протокола на комплекта, с изключение на това, че клетъчният лизис се извършва чрез биене на проби от проби два пъти за 30 s с инкубация в продължение на 2 минути върху лед между биенето на зърната. Получените концентрации на геномна ДНК се измерват чрез нанодроп и целостта на ДНК се изследва чрез електрофореза в агарозен гел. Метагеномното секвениране беше проведено, използвайки HiSeq 2000 и 90-bp PE стратегия [24].
Де ново сглобяване и прогнозиране на гени
След премахване на адаптери бяха премахнати нискокачествени четения и четения, които принадлежат на хоста, получени са 46 100 196 96 967 672 (средно ± s.e.m.) висококачествени четения. След това тези висококачествени четения от 54-те проби бяха сглобени в contigs, използвайки SOAPdenovo (v1.06), като бяха използвани същите параметри, които бяха използвани в каталога на MetaHIT гени [24]. За всяка проба са получени 53 226 ± 2 097 (средно ± s.e.m.) контиги с дължина 102 946 516 ± 2 678 730 bp (средно ± s.e.m.). GeneMark (v2.7) беше използван за предсказване на отворени рамки за четене (ORF).
Изграждане на справка за метагеном на червата
За да изследваме метагеномичната информация на микробиотата на червата на мишката, първо създадохме метагеномичен каталог въз основа на пробите, получени в настоящото проучване. Всички ORFs, предвидени от 54-те проби, бяха обединени и подравнени един с друг, използвайки BLAT. Генните двойки с повече от 95% идентичност (не се допуска пропуск) и подравнени четения, обхващащи над 90% от по-кратките четения, бяха групирани заедно. Най-дългият ORF във всяка група е използван за представяне на групата, а останалите ORF на групата се считат за излишни последователности. Впоследствие ORF с дължина по-малка от 100 bp бяха филтрирани. И накрая, беше създаден генен каталог, съдържащ 793 847 не-излишни гена, обхващащ 77,4 ± 0,3% (средно ± s.e.m.) от висококачествените показания във всяка проба.
Въз основа на този референтен набор от гени, извършихме таксономично разпределение и функционално анотиране, използвайки базата данни NR (v3) и базата данни KEGG (версия 59.0). В това проучване 80% от гените в каталога могат да бъдат надеждно присвоени към базата данни NR, останалите гени вероятно са от неопределени в момента микробни видове. На функционално ниво идентифицирахме 4846 KEGG ортолога (KO), покриващи 46,43% от гените в каталога.
Таксономично разпределение и функционална класификация
Нуклеотидните последователности на предсказани гени бяха преведени в протеинови последователности с помощта на NCBI генетични кодове 11. BLASTp беше използван за провеждане на таксономично разпределение и функционална класификация на предсказани гени спрямо базата данни NR (v3) и базата данни KEGG (версия 59.0) с Е. стойност ≤1 × 10 −3. Всички гени бяха търсени срещу IMG (v3.4) с BALSTN, като се използват параметри по подразбиране, с изключение на Е. стойност беше зададена на 1 × 10 −5. Таксономичната асоциация на ген е решена от най-ниския общ прародител от всичките му резултати от таксономични анотации. Гени, анотирани от KEGG, бяха присвоени на пътищата на KEGG. Общо идентифицирахме 4846 KOs в референтния набор от гени с 80.0 и 46.4% гени от референтен набор от гени, имащи съответно таксономична и функционална информация.
Относително изобилие от гени и KO
Висококачествените чисти сдвоени отчитания от всяка проба бяха подравнени спрямо референтните гени, зададени от САПУН2 използване на критерий, изискващ идентичност> 90%. Преброихме само броя четения, които отговарят на следните критерии: (i) Четенията на сдвоени краища могат да бъдат картографирани върху генната последователност с умерен размер на вмъкване; (ii) Едно от сдвоените четения може да бъде картографирано в края на генната последователност, докато другото четене е картографирано извън генната област. И в двете ситуации картографираните сдвоени четения се броят като едно копие. Броят на четенията, картографирани върху определен ген, се нормализира от дължината на гена. Впоследствие таблицата на относителното изобилие е построена чрез нормализиране на сумата на всички гени на проба до 1. В уравнение. (1), \ (_i \) обозначава броя четения, които са картографирани върху определен ген, и L i дължината на този ген, тогава относителното изобилие на този ген \ (_i \) се равнява на
където \ (j \) преминава през целия набор от референтни гени.
Всички проби бяха третирани по същия начин, което доведе до таблица, съдържаща относителното изобилие на всички гени на всички проби. Профилът на КО е получен чрез сумиране на относителното изобилие от гени, които се подравняват към същия КО. Тъй като един и същ ген може да принадлежи към повече от една KO група, ние включихме относителното изобилие от тези гени във всички KO.
Анализ на биологичното разнообразие
Индексът на Шанън и индексът на подобие на Sørensen-Dice бяха изчислени въз основа на таблицата на относителното изобилие от 54 проби.
Статистически анализ
Всички статистически анализи са приложени от софтуера R. Анализът на основните координати (PCoA) е реализиран с помощта на пакета “ade4” [46]. За да се изравни относителното значение на често срещаните и редки гени/видове/KOs, преди PCA е извършена трансформация на квадратни корени. За извършване на сравнителния анализ беше използван тест на Wilcoxon за класиране. За сравнение на разликите между експериментални групи е използван двойно-тест на Уилкоксън с ранг-сума, в който методът на Hommel е използван за противодействие на проблема с множество сравнения [47].
Определението на размера на ефекта, използвано при функционален анализ, е показано в уравнението. (2), където \ (> _i \) е средното изобилие от функции на експерименталната група \ (i \). Коефициентът на корелация на Пиърсън е използван за измерване на корелацията между две характеристики. Нивото на значимост беше зададено на 0,05.
- Хипертрофична кардиомиопатия при диета, предизвикана от затлъстяване с високо съдържание на мазнини, роля на потискане на вилицата
- Идентифициране на генетични локуси, свързани с различни реакции на затлъстяване, предизвикано от диета с високо съдържание на мазнини
- Повишена чувствителност на миокарда към повтаряща се исхемия при затлъстяване, индуцирано от високо съдържание на мазнини
- Промени в начина на живот при затлъстяване и отслабване HealthEngine Blog
- Дългосрочната дисбиоза насърчава инсулиновата резистентност по време на затлъстяване, въпреки бързите промени, предизвикани от диетата