Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Катедра по кардиология, Национален сърдечен център Сингапур, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Кореспонденция
Филип Т. Х. Лий, сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, 11 Biopolis Way # 02-02, 138667 Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Катедра по кардиология, Национален сърдечен център Сингапур, Сингапур
Група за функционален метаболизъм, Сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, Сингапур
Кореспонденция
Филип Т. Х. Лий, сингапурски консорциум за биоизображение, Агенция за наука, технологии и изследвания, 11 Biopolis Way # 02-02, 138667 Сингапур
Резюме
Да се изследват ефектите на дългосрочната нисковъглехидратна нискобелтъчна кетогенна диета (KD) върху сърдечния метаболизъм и състоянието на диабетна кардиомиопатия при слаби диабетични плъхове Goto-Kakizaki (GK).
Материали и методи
Диабетичните GK плъхове са хранени с KD в продължение на 62 седмици. Сърдечната функция и метаболизмът се оценяват с помощта на ядрено-магнитен резонанс и 13 C магнитно-резонансна спектроскопия (13 C-MRS), в покой и под стрес от добутамин. 13 C-MRS е извършен след инжектиране на хиперполяризиран [3-13 C] ацетоацетат, [1-13 C] бутират или [1-13 C] пируват, за да се оцени съответно кетонното тяло, мастнокиселината с къса верига или глюкозата. Експресията на протеин и структурата на кардиомиоцитите се определят съответно чрез Western blot и histology.
Резултати
KD понижава нивата на кръвната глюкоза, триглицеридите и инсулина, като същевременно повишава нивата на кръвните кетони в тялото. При диабетни плъхове, хранени с KD, миокардното кетонно тяло и окислението на глюкозата са по-ниски, отколкото при диабетните плъхове, хранени с чау, докато гликолизата на миокарда и окислението на мастни киселини с къса верига са непроменени. Стресът от добутамин разкрива повишено сърдечно предварително натоварване и намалено сърдечно съответствие при диабетни плъхове, хранени с KD. Индуцираната от добутамин стимулация на гликолизата на миокарда е по-засилена при диабетни плъхове, хранени с KD, отколкото при диабетни плъхове, хранени с чау, което е потенциално улеснено чрез повишаване на базалната експресия на протеини, участващи в транспорта на глюкоза и гликолиза в сърцата на KD хранени плъхове . Метаболитният профил, индуциран от KD, е придружен от сърдечна хипертрофия, тенденция за повишено съдържание на липиди и колаген в миокарда и повишен маркер на оксидативен стрес.
Заключение
KD изглежда изостря диабетната кардиомиопатия при GK плъхове, което може да бъде свързано с неадаптивна сърдечна метаболитна модулация и липотоксичност.
1. ВЪВЕДЕНИЕ
Диабетът е рисков фактор за сърдечно-съдови заболявания. 1 Сърцето с диабет може да развие кардиомиопатия въпреки липсата на основни сърдечно-съдови заболявания, което може да се дължи на повишеното му предпочитание към метаболизма на мастните киселини. 2 Всъщност развитието на сърдечна недостатъчност също е свързано с променен метаболизъм на сърдечния субстрат. 3 Трябва да се отбележи, че ролята на кетонните тела в кардиометаболитното здраве също се оценява все по-често. 4, 5 Проучвания както при хора, така и при животни разкриват регулиране на използването на кетон на миокарда при напреднала сърдечна недостатъчност. 6, 7 Все още обаче не е ясно дали увеличаването на употребата на кетонни тела в сърцето с увреждания е адаптивно или дезадаптивно. При експерименти с реперфузия на исхемия при плъхове, предизвикана от гладуване кетоза 8 и интравенозно инжектиране на β-хидроксибутират (β-OHB) 9 могат да отслабят исхемичното увреждане. В скорошно клинично проучване се смята, че благоприятният ефект на инхибитора на натриев глюкозен ко-транспортер-2 (SGLT2) емпаглифлозин върху сърдечно-съдовия изход при пациенти с диабет 10 също е свързан с хиперкетонемия. 11 Въпреки това, скорошни проучвания показват, че въпреки хиперкетонемията, емпаглифлозин или понижава 12, или не променя използването на тялото на миокарден кетон 13 при модели на диабет при гризачи.
Кетогенната диета (KD) става популярна при лечението на диабет. 14 При пациенти е доказано, че KD предизвиква загуба на телесно тегло, въпреки че ползите от KD могат да надхвърлят и загубата на телесно тегло, като например намаляване на риска от сърдечно-съдови заболявания (ССЗ). 15-17 Интересното е, че при мишки са съобщени и противоположни ефекти на KD върху рисковете от ССЗ. 17-21 Въпреки противоречивите констатации за риска от ССЗ, понастоящем има ограничени изследвания за въздействието на KD върху сърдечната физиология. Средата с високо съдържание на кетони, както и с ниско съдържание на въглехидрати и мазнини, индуцирана от KD, може да предизвика сърдечни метаболитни адаптации в дългосрочен план, което може или не може да бъде от полза за сърцето на диабета. Тук се опитахме да проучим дали KD може да модулира метаболизма на сърдечния субстрат и/или да предизвика функционални промени в сърцето на диабета. За тази цел използвахме слаб модел на гризачи на диабет и диабетна кардиомиопатия, плъхове Goto-Kakizaki (GK). 22-24 Избран е постно диабетен модел, за да се намалят объркващите ефекти на затлъстяването върху находките.
2. МАТЕРИАЛИ И МЕТОДИ
2.1 Животни
Мъжки слаби диабетни плъхове Goto-Kakizaki (GK/MolTac), отглеждани от Taconic (Ню Йорк), са закупени от InVivos (Сингапур). Започвайки от 12-седмична възраст, те са били хранени или с диета с чау (N = 4; Диета за плъхове/мишки # 1324 мод., Алтромин, Германия; 16 kcal% мазнини, 21 kcal% протеин, 63 kcal% въглехидрати) или с въглехидратна нискобелтъчна кетогенна диета (LCLPKD; наричана по-долу KD; N = 6; AIN ‐ 76A Modified # F3666, Bio-Serv, New Jersey; 93,5 kcal% мазнини, 4,7 kcal% протеин, 1,8 kcal% въглехидрати) за 62 седмици ad libitum. Започвайки от 53-та седмица на диетата, дългосрочните ефекти на KD бяха оценени с помощта на ЯМР и хиперполяризиран 13 C-MRS при условия на покой или инфузия на добутамин (135 μg/kg/min, при концентрация от 1 mg/ml; общо доза: 1,35-2,7 mg/kg). В края на проучването се вземат проби от органи и кръв при хранене. Всички процедури, включващи животни, са одобрени от институционалния комитет за грижи и употреба на животни A * STAR (# 171204).
2.2 In vivo ЯМР и хиперполяризиран 13 C-MRS
MR измерванията са извършени на 9,4 T MR скенер (Bruker, Германия) под изофлуранова анестезия. Бяха приготвени две линии за инфузия във вените на опашката за прилагане на хиперполяризирани 13 С субстрати и добутамин. FLASH MRI е придобита преди и по време на 10-20 минути инфузия на добутамин за измерване на сърдечната функция (на 53-54 седмици диета). За измерване на употребата на сърдечен субстрат се инициира сърдечно-задействана 13 C импулсна спектроскопия, последвана незабавно от инжектиране на хиперполяризиран [3-13 C] ацетоацетат (3 μL/g при 53-54 седмици диета), [1-13 C] пируват (7 μL/g на 57-58 седмици диета) или [1-13 C] бутират (7 μL/g на 61‐62 седмици диета). 13 C ‐ MRS за всеки хиперполяризиран субстрат се повтаря при две различни условия, с интервал от една седмица, или след 20 минути вливане на физиологичен разтвор (състояние на почивка) или вливане на добутамин (състояние на стрес). Редът на експериментите за почивка или стрес беше случаен. Подробностите за ядрено-магнитен резонанс на кината, хиперполяризирана подготовка на субстрат от 13 С и 13 С-МРС са предоставени в подкрепящата информация за тази статия.
2.3 Анализ на кръвта
Проби от серум се събират преди инфузия на добутамин и след 20 минути инфузия на добутамин и през няколко точки през периода на изследването (условия на хранене или на гладно). Кръвната глюкоза, триглицеридите (TG) и β-OHB бяха определени с помощта на измервателни уреди. Серумният ацетоацетат, свободната мастна киселина (FFA), ANP и инсулинът се определят с помощта на комплекти за анализ (вижте подкрепящата информация за тази статия).
2.4 Ex vivo анализ на тъканите
Експресията на протеини от интерес се определя чрез Western blot. Активността на сърдечната сукцинил-CoA-3-оксалоацидна CoA трансфераза (SCOT) се извършва, както е описано по-горе. 28 Активността на сърдечната пируват дехидрогеназа (PDH) и сърдечните нива на триглицеридите бяха определени с помощта на комплекти за анализ. Хистологията на Sirius Red е извършена за оценка на фиброзата. Подробностите за тъканния анализ са предоставени в допълнителните материали (вижте подкрепящата информация за тази статия).
2.5 Статистика
Статистическият анализ беше извършен с t-тест на Student за данни ex vivo. Многократните мерки ANOVA са използвани за анализ на in vivo и серумни данни (диетични ефекти: чау срещу KD, ефекти на добутамин: почивка/физиологичен разтвор спрямо добутамин), с изключение на 13 C пируват MRS, където е използван обикновен двупосочен ANOVA, тъй като две животните липсват данните за останалото или добутамин. Ако срокът на взаимодействие беше важен, бяха направени многобройни сравнения, коригирани от Bonferroni. Корелациите на данните бяха извършени с корелация на Пиърсън. Статистическата значимост беше определена на P
3 РЕЗУЛТАТА
3.1 KD засяга телесното тегло и кръвните параметри
Първоначално KD доведе до по-ниско телесно тегло при диабетни плъхове, хранени с KD, отколкото при плъхове с диабет, хранени с чау (P Таблица 1. Кръвни параметри, тегло на органите, експресия на протеини, протеинова активност, съдържание на липиди и фиброза, определени след 60-63 седмици диета
3.2 KD атенюирано индуцирано от добутамин намаляване на крайния диастоличен обем
В покой няма разлика в параметрите на сърдечната функция между диабетни плъхове, хранени с KD, и диабетни плъхове, хранени с чау (Таблица 2). Инфузията на добутамин води до 25% увеличение на сърдечната честота и фракцията на изтласкване, независимо от диетата (Таблица 2). Добутамин намален краен диастоличен обем (EDV) (P Таблица 2. Параметри на функцията на лявата камера в покой и под стрес на добутамин, измерени с помощта на ЯМР
3.3 KD и стресът на добутамин понижават окисляването на тялото на миокарда в кетона в TCA цикъла
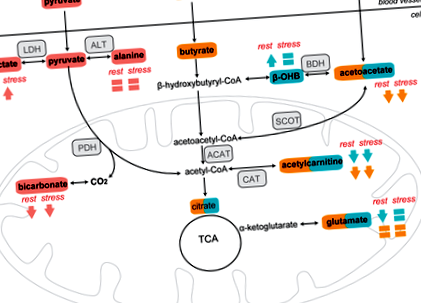
За да изследваме ефектите на KD върху метаболизма на сърдечния кетон, ние извършихме сърдечен 13 C-MRS след инжектиране на хиперполяризиран [3-13 C] ацетоацетат (Фигура 1, пътища в синьо). [1-13 C] Ацетилкарнитин (172,6 ppm), [5-13 C] глутамат (продукт от цикъла на трикарбоксилна киселина [TCA]; 181,2 ppm) и [3-13 C] β-OHB (68,5 ppm) са видими в сърдечни 13 C MR спектри в рамките на 1 минута след [3-13 C] ацетоацетат (209.9 ppm) приложение (Фигура 2A, B).
В покой, хранените с KD плъхове с диабет показват 34% по-ниско производство на [5-13 C] глутамат (P = 0,001 спрямо диабетни плъхове, хранени с чау; Фигура 2C) и с 42% по-ниско [1-13 C] производство на ацетилкарнитин (общ диетичен ефект: P 13 C] производството на β-OHB е 75% по-високо при диабетични плъхове, хранени с KD, в сравнение с диабетни плъхове, хранени с чау (P 13 C] производство на глутамат с 47% при диабетни плъхове, хранени с чау (P 13 C] производство на ацетилкарнитин с 51% (общ ефект на добутамин: P = 0,01; Фигура 2D). [3-13 C] Производството на β-OHB се увеличава с 88% при стрес на добутамин при диабетни плъхове, хранени с чау (P
3.4 KD не повлиява миокардното късоверижно окисление на мастните киселини в TCA цикъла
Направихме сърдечен 13 C-MRS след прилагане на хиперполяризиран [1-13 C] бутират (Фигура 1, пътища в оранжево). Метаболитните продукти на метаболизма на [1-13 C] бутират (т.е. [1-13 C] ацетоацетат (174,6 ppm), [1-13 C] ацетилкарнитин (172,6 ppm) и [5-13 C] глутамат (181,2 ppm)) са количествено измерим в 13 C MR спектрите в рамките на 1 минута след [1-13 C] приложение на бутират (184 ppm) (Фигура 3A, B).
При инжектиране на [1-13 C] бутират, производството на [1-13 C] ацетоацетат и [1-13 C] ацетилкарнитин е съответно 31% и 37% по-ниско при диабетни плъхове, хранени с KD, отколкото при хранени с чау диабетични плъхове (общ диетичен ефект: P = 0,002 и P 13 С] глутаматът е сходен и в двете групи и не се променя от добутаминов стрес (ANOVA P = 0,43; Фигура 3Е), което предполага, че KD не повлиява миокардното късоверижно окисление на мастните киселини в TCA цикъла.
3.5 KD понижава окисляването на глюкозата в покой, като същевременно засилва гликолизата при стрес на добутамин
За да оценим метаболизма на глюкозата в миокарда, извършихме 13 C-MRS след инжектиране на хиперполяризиран [1-13 C] пируват (Фигура 1, пътища в розово). Производството на метаболитни продукти (т.е. [1-13 C] лактат (183 ppm), [13 C] бикарбонат (160 ppm) и [1-13 C] аланин (177 ppm)) може да се наблюдава в рамките на 1 минута след [1 - 13 С] приложение на пируват (170 ppm) (Фигура 4А, В).
В покой производството на [1-13 C] лактат и [1-13 C] аланин не се различава между диабетни плъхове, хранени с чау и KD (P = 0,19 и общ диетичен ефект: P = 0,12, съответно; Фигура 4C, D). Производството на [13 C] бикарбонат обаче е със 75% по-ниско при диабетни плъхове, хранени с KD (P 13 C] производство на лактат със 195% при диабетни плъхове, хранени с чау (P 13 C] производство на лактат при диабетни плъхове, хранени с KD (P 13 C] аланин при диабетни плъхове, хранени с KD, и при диабетни плъхове, хранени с чау, с 34% (общ ефект на добутамин: P = 0,016; Фигура 4D). Производството на [13 С] бикарбонат е намалено с 25% при стрес на добутамин при диабетни плъхове, хранени с чау (P = 0,003 спрямо почивка), докато тя е била непроменена при диабетични плъхове, хранени с KD (P > 0,99 срещу почивка; Фигура 4Е). При стрес на добутамин [1-13 C] производството на лактат корелира с EDV (Фигура 4F), както и със SV (Фигура 4G). Производството на [13 C] бикарбонат също корелира със SV (Фигура 4Н).
Също така определихме експресията на протеини, участващи в транспорта на глюкоза (т.е. инсулинозависим GLUT4 и независим от инсулин GLUT1) и в гликолизата (т.е. PKM1 и PKM2). Интересното е, че докато KD се състои от ниско съдържание на въглехидрати, експресията на GLUT4 е по-регулирана в сърцата на диабетни плъхове, хранени с KD, отколкото в тези на диабетни плъхове, хранени с чау, въпреки че GLUT1 не е засегнат от KD (Таблица 1 и Фигура S3) . Експресията на PKM1 и PKM2 също беше по-регулирана в сърцата на диабетни плъхове, хранени с KD, отколкото в тези на диабетни плъхове, хранени с чау (Таблица 1 и Фигура S3).
3.6 KD засегнати маркери за окисляване на мастните киселини и липотоксичност на миокарда
Експресията на ацил-КоА дехидрогеназа (ACADL) и 3-хидроксиацил-КоА дехидрогеназа (HADH) е по-висока в диабетни сърца, хранени с KD, отколкото в диабетни плъхове, хранени с чау, докато експресията на карнитин палмитоилтрансфераза-1В (CPT1B) подобно между двете групи (Таблица 1). Съдържанието на триглицериди в миокарда и съдържанието на колаген обикновено са съответно 56% и 11% по-високи в сърцата на диабетни плъхове, хранени с KD, отколкото в тези на диабетни плъхове, хранени с чау (Таблица 1 и Фигура S4). Експресията на каталаза, антиоксидантен ензим, се удвоява в сърцата на диабетни плъхове, хранени с KD, в сравнение с тези на диабетни плъхове, хранени с чау (Таблица 1), което показва повишаване на оксидативния стрес.
4. ДИСКУСИЯ
В настоящото проучване ние предлагаме нова представа, че сърцето, изложено на среда с ниско съдържание на въглехидрати, може да компенсира ниската въглехидрати, като увеличи регулирането на гликолитичния резервен капацитет. Базалната експресия на протеини, участващи в медииран от инсулин транспорт на глюкоза в сърцето (т.е. GLUT4) и в последния етап на гликолиза (т.е. PKM1 и PKM2), е била по-висока в сърцата на диабетни плъхове, хранени с KD, отколкото в тези на диабетици, хранени с чау плъхове. Това може да се превърне в повишен капацитет за стимулиране на гликолизата при повишено натоварване. Всъщност, докато наблюдавахме, че производството на лактат в миокарда 13 С при хипополяризирано инжектиране на 13 С пируват се увеличава при стрес на добутамин, както беше обсъдено по-рано, то при диабетните плъхове, хранени с KD, беше значително по-високо, отколкото при диабетните плъхове, хранени с чау розово). Въпреки това, увеличаването на сърдечния гликолитичен капацитет при диабетни плъхове, хранени с KD, може да не е от полза, тъй като може допълнително да увеличи несъответствието между гликолизата и окисляването на глюкозата, последното от които наистина е доказано, че е по-ниско при диабетични плъхове, хранени с KD, отколкото при диабетни плъхове, хранени с чау.
20%). По този начин трябва да се вземат предвид разликите в състава на диетата при сравняване на проучвания или превод на резултатите в клинични условия.
В заключение, това е първото проучване за цялостно изследване на въздействието на KD върху сърдечния метаболизъм in vivo в сърцето с диабет, като се използват различни хиперполяризирани 13 С метаболитни сонди. При слаби диабетични GK плъхове дългосрочната KD изостря състоянието на диабетна кардиомиопатия, което може да бъде свързано с неадаптивна сърдечна метаболитна модулация и липотоксичност. По-нататъшните изследвания трябва да се съсредоточат върху сърдечно-съдовата безопасност на KD при хората.
ПРИЗНАВАНИЯ
Благодарим на д-р Tay Zhi Wei за съдействието при редактирането на фигури.
- Сърдечни аритмии, свързани с течна протеинова диета за лечение на затлъстяване; NEJM
- 8-седмичен, с ниско съдържание на въглехидрати, с високо съдържание на мазнини, с кетогенна диета, подобрен изчерпателен капацитет за упражнения при мишки
- 10 най-добри кето бисквитки Лесни рецепти за бисквитки с ниско съдържание на въглехидрати за кетогенната диета
- 7-дневен кетогенен хранителен план Вкусни и лесни кето рецепти за изгаряне на мазнини и печелене на енергия чрез
- 8 предимства на високо протеинова диета - EFM Health Clubs