J. Davoodi
отдел по човешко хранене, храни и упражнения, Virginia Tech, Blacksburg, VA 24061, САЩ
b Институт по биохимия и биофизика, Университет в Техеран, Иран
C.D. Маркерт
c Институт по регенеративна медицина Wake Forest, Уинстън-Салем, NC 27106, САЩ
К.А. Фолкер
отдел по човешко хранене, храни и упражнения, Virginia Tech, Blacksburg, VA 24061, САЩ
S.M. Хътсън
отдел по човешко хранене, храни и упражнения, Virginia Tech, Blacksburg, VA 24061, САЩ
Робърт У. Грейндж
отдел по човешко хранене, храни и упражнения, Virginia Tech, Blacksburg, VA 24061, САЩ
Мускулната дистрофия на Дюшен (DMD) е смъртоносна, свързана с Х рецесивна болест 1, причинена от мутации в гена на дистрофин, разположен в хромозома Xp21. Мутациите на гена на дистрофин водят до липсата на дистрофиновия протеин, което води до нарушена връзка между F-актиновия цитоскелет и извънклетъчния матричен протеин ламинин 2 чрез свързания с мембраната дистрофин-гликопротеинов комплекс (DGC). 2,3
При липса на дистрофин липсват механичните връзки от цитоскелета на мускулната клетка към мембраната и компонентите на DGC. 4 Предполага се, че прогресивните и в крайна сметка фатални кръгове на дегенерация и регенерация на скелетната мускулатура са резултат или от крехка или отслабена мембрана на скелетните мускули 5,6, или от променена клетъчна сигнализация.
Отвъд тези общи хипотези, специфичните клетъчни механизми и темпоралната прогресия на дистрофичния процес все още са неясни. Понастоящем няма лечение за DMD, а палиативните и профилактични интервенции за подобряване на качеството на живот на пациентите остават ограничени, с изключение на кортикостероидите. Кортикостероидите са ефективни при удължаване на амбулацията, но имат няколко нежелани странични ефекти, включително забавяне на растежа, затлъстяване, непоносимост към глюкоза и деминерализация на костите. 7 Независимо от това, въпреки тези странични ефекти, наскоро експертна група препоръча терапия с глюкокортикоиди за всички пациенти, които имат DMD. Тази препоръка предполага, че докато не е налице подходящ заместител на кортикостероидите, всички допълнителни палиативни и профилактични подходи за лечение вероятно ще бъдат във връзка с кортикостероиди. 8
Тази статия описва две потенциални хранителни интервенции за лечение на DMD, екстракт от зелен чай (GTE) и аминокиселина с разклонена верига (BCAA) левцин и техните положителни ефекти върху физическата активност. Както GTE, така и левцинът са подходящи за консумация от човека; лесно се понасят без странични ефекти; и, с подходящи предклинични данни, може бързо да се пренесе в клиничните изпитвания. При дистрофични мишки mdx, както GTE 9, така и левцин (Voelker KA, непубликувани данни, 2010 г.) подобряват издръжливостта на цялото животно и функцията на скелетните мускули. Механично и двете се медиират чрез сигнални пътища, за да предизвикат тези и други положителни адаптации, които отслабват ефектите от дистрофичната прогресия. Към днешна дата не са описани всички специфични пътища.
ХАРАКТЕРИСТИКИ НА DMD
Характеристиките на DMD са добре описани на генетично, молекулярно, клетъчно, тъканно, органно и клинично ниво (Таблица 1). Подробни описания са предоставени в няколко отлични отзива. 6,7,10-14
маса 1
Характеристики на DMD
| Генетична | Х-свързани, наследствени или спонтанни |
| Клетъчни | Липса на протеинов дистрофин, механично отслабване на сарколемата, неподходящ приток на калций, повтаряща се мускулна исхемия, аберантна клетъчна сигнализация, повишен оксидативен стрес, хистологично разрушаване на z-диска, централно зародиш, хетерогенност на размера на влакната, намалена експресия и неправилна локализация на дистрофин-свързани протеини |
| Тъкани | Мускулно натрупване на фиброзна съединителна и мастна тъкан, псевдохипертрофия |
| Органни системи | Мускулно-скелетна система, нервна система, храносмилателна система, имунна система, кардиореспираторна система |
| Клинична | Смъртоносни, прогресивни, 1: 3500 раждания на живо при мъже, загуба на мускулна маса и слабост, податливост на умора, мускулни болки, повишена серумна креатин киназа, миоглобинурия, знак на Хауер, лордоза, прогресираща трудност с амбулация, контрактури, нараняване, предизвикано от свиване, вторична атрофия, повишена мастна маса, странични ефекти на лекарства, кардиореспираторна недостатъчност |
Най-добри практики за грижи
DMD е сложно заболяване за лечение. Bushby и колеги 7,10 наскоро публикуваха подробен набор от препоръки за управлението на DMD. Сред многото препоръки са тези, свързани с храненето и упражненията (физическа активност). Тук не е намерението на авторите да обсъждат всички трудности, свързани с храненето (напр. Проблеми с преглъщането) или упражненията (напр. Гръбначни изкривявания), а да се съсредоточат върху прости хранителни възможности, които могат да смекчат тежестта и прогресията на заболяването.
Значение на мобилността
Целта за лечение на пациенти с DMD трябва да бъде подобряване на качеството на живот, 7,10 един от важните аспекти на които е мобилността. Подвижността зависи от достатъчна сила и издръжливост в скелетните мускули, за да се движат ставите през обхват на движение, за да се изпълни задача за движение. Някои задачи могат да бъдат случайни движения, важни в ежедневието, като например посегане към чаша. Други движения могат да бъдат повтарящи се и ритмични, като ходене. Тъй като амбулаторните мускули, диафрагмата и сърцето са неблагоприятно засегнати от дефицит на дистрофин, мобилността при лица с ДМД е сериозно нарушена. Може ли хранителните терапии да подобрят мобилността?
ЗАЩО ТЕРАПИИ ЗА ХРАНИТЕЛНА И ФИЗИЧЕСКА ДЕЙНОСТ?
Правителството на САЩ е установило насоки за балансирано хранене, за да отговори на енергийните нужди и изискванията за макронутриенти и микроелементи за здравето (http://health.gov/dietaryguidelines/2010.asp), което включва балансиране на калориите с физическа активност за управление на теглото. По същия начин са установени насоки от Центровете за контрол и профилактика на заболяванията за минимално ежедневно участие във физическа активност (http://www.cdc.gov/physicalactivity/everyone/guidelines/index.html). На най-основното ниво храненето представлява енергиен прием и адекватни витамини и минерали; физическата активност представлява енергията. Тези изисквания са не по-малко и вероятно по-важни за хората с DMD.
КАКВО В момента се знае
Има малко публикувани изследвания за ефективно хранене 7,8,10 или физическа активност 15,16 за лица с DMD. Въпреки че се признава, че генетичните и молекулярно-биологичните подходи в крайна сметка ще разкрият лек за DMD, разумно ли е да се пренебрегват потенциалните прости подходи, като диета и физическа активност, като палиативно и профилактично лечение, докато не бъде намерено лечението? За съжаление, тези лечения просто не се разследват стриктно. Най-просто казано, малко се знае за хранителните нужди на пациенти с DMD и малко се знае за потенциалните положителни (или отрицателни) адаптивни реакции на дистрофичните мускули към физическа активност.
Хранене
Дейвидсън и Труби 8 съобщават в своя преглед, че от приблизително 1500 препратки, които са намерили за DMD, само 6 директно са изследвали хранителните нужди на момчетата с DMD. Бушби и колеги 10 цитират подобен малък брой препратки, въпреки че някои се различават от цитираните от Дейвидсън и Труби. Общият брой на хранителните изследвания изглежда е само около 10 до 12. Въз основа на тези проучвания препоръките за хранителни насоки могат да бъдат значително подобрени. 8
Физическа дейност
Ефектите от физическата активност за лечение на DMD са изследвани в продължение на няколко десетилетия (напр. Референции 17,18), но все още няма дефинирани предписания за упражнения, които включват интензивност, продължителност и честота. 15,16 Неотдавнашен преглед от Markert и колеги 16 предполага, че подходящо предписаната физическа активност може да противодейства на ключовите дистрофични патогенни механизми, включително (1) механично отслабване на сарколемата, (2) неподходящ приток на калций, (3) анормална клетъчна сигнализация, (4 ) повишен оксидативен стрес и (5) повтаряща се мускулна исхемия.
Енергиен баланс
Въпреки че тази статия се фокусира върху две специфични хранителни интервенции, наблюдението на енергийното съдържание на диетата също е крайъгълен камък за здравето и е особено важно да се вземе предвид при болестни състояния като DMD, които засягат множество органи. 10 Прекомерният прием на калории води до състояния с наднормено тегло или затлъстяване, докато неадекватният прием на калории предшества загубата на тегло. Момчетата, лекувани със стероиди, получават нефункционална маса (напр. Мазнини, а не мускули), тъй като апетитът се стимулира. 8 При момчетата с ДМД, чиято мобилност е нарушена, този проблем се изостря, тъй като те поемат повече енергия, но изразходват по-малко.
Energy IN се определя от консумираното количество и съдържанието на диетата в килокалории. Energy OUT включва сумата от метаболизма в покой, термичния ефект на храната, енергийните разходи без упражнения и разходите за енергия при упражнения, също измерени в килокалории. В допълнение, болестта и лекарствата могат да допринесат за енергийния статус при пациенти с DMD. 8 Когато енергията IN надвишава енергията OUT, се получава увеличаване на теглото. Предлагат се систематични проучвания на енергийните разходи при пациенти с DMD, като се използват метаболитни еквиваленти 20 (MET = 3,5 ml кислород/kg телесна маса/мин) 16, за да се предписват по-добре указанията за физическа активност и упражнения. Тези проучвания също биха помогнали за информирането на хранителните насоки за енергиен прием.
Фармацевтични и хранителни интервенции
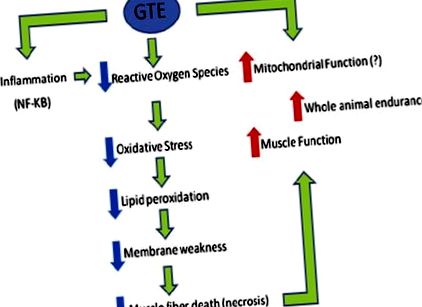
Съобщава се, че GTE подобрява дистрофичната патология при mdx мишки. Първоначалните проучвания показват, че оксидативният стрес може да допринесе за симптомите на мускулна дистрофия, 27-32 и ранното прилагане на диетичен GTE на млади mdx мишки (и техните язовири преди отбиване), защитени срещу мускулна некроза в мускула на екстензорния дигиторум (EDL). 33 Признат за своите антиоксидантни свойства, GTE е изследван допълнително като възможна защита срещу прогресия на мускулната дистрофия. Прилагането в началото на заболяването се повтаря в проучване, което сравнява GTE с неговия основен компонент, епигалокатехин галат (ECGC), 34 полифенол. Това проучване също така показва намалена некроза в мускулите на мишки, лекувани с GTE и третирани с ECGC, и освен това съобщава за подобрена мускулна сила и устойчивост на умора при функционални анализи.
В друго проучване са изследвани 9 доброволни упражнения (бягане с колело) и GTE при 21-дневни мишки mdx. И двете състояния независимо показаха благоприятни ефекти при анализи на контрактилни свойства, метаболитна активност, липидна пероксидация и антиоксидантна способност. Съобщава се също така, че синергичните ефекти на комбинираните лечения са в полза на издръжливостта, въпреки че някои други полезни ефекти на GTE са смекчени чрез бягане. Механистичните данни и данните за хода на времето 35 показват, че GTE потенциално подобрява патологията, като действа върху пътя на ядрения фактор κB. Хистологичните анализи на лекуван с GTE mdx мускул показват намалена площ на регенериращи влакна, показващи защитен ефект, и морфология на влакната, по-подобна на тази на неразболените мускули. В обобщение, GTE и неговите полифенолни съставки заслужават по-нататъшно проучване като възможни регулатори на оксидативен стрес и възпаление. Точно както леките упражнения за плуване могат да се възползват от аеробни и кардиореспираторни способности, особено при млади амбулаторни пациенти с DMD, 10 нутрицевтици като BCAA и GTE могат да осигурят полза при допълнителни мерки за биохимични и функционални резултати (Фиг. 1).
Преглед на положителните физиологични ефекти на екстракта от зелен чай (GTE) при мишки mdx. Потенциалните благоприятни ефекти на GTE върху митохондриалната функция все още не са определени механично. NF, ядрен фактор.
Левцин
Левцинът е основен BCAA с уникални характеристики. Освен че е градивен елемент на протеините, той е анаболен сигнал, който индуцира протеинов синтез. 36 В допълнение, той играе роля в хомеостазата на глюкозата. 37 Левцинът действа и като донор на азот за синтеза на аланин и глутамин в мускула. 38 Глутаматът, който сам по себе си е предшественик на у-аминомаслената киселина (GABA), се получава от реакцията на трансаминиране на левцин и други BCAA и е основен възбуждащ невротрансмитер. 39
Левцинът също подобрява задържането на азот, като увеличава синтеза на мускулни протеини и намалява разграждането на миофибриларите при нормални прасета. 40-43 Въпреки че и двата ефекта, свързани с левцин, биха били от значение за обръщане на процесите на разграждане в дистрофичните мускули, не е известно дали дистрофичните мускули ще реагират по подобен начин. Има само едно контролирано клинично изпитване (проведено през 1984 г.), което е изследвало терапевтичния потенциал на левцина. 44 Това проучване демонстрира преходно увеличение на мускулната сила, отчетено след първия месец на 12-месечно проучване, но по-късно резултатите са объркани от необичайната скорост на функционален спад в плацебо групата. Съвсем наскоро D’Antona и колеги 45 съобщават, че добавките с BCAA насърчават дълголетието, както и биогенезата на скелета и сърдечния мускул при мишки на средна възраст, включително повишена физическа издръжливост. По същия начин, последните предварителни данни на авторите, демонстриращи подобряване на контрактилната и издръжливост при мишката mdx, показват, че левцинът може да бъде ефективна хранителна терапия за DMD.
Цел на рапамицин при бозайници
Въпреки че е добре установено, че левцинът може да стимулира протеиновия синтез чрез сигнальния път на рапамицин (mTOR) при бозайници, 36,46-51 идентичността на сензора (ите) за левцин не е известна. 52 Най-силната връзка между аминокиселините и mTOR комплекс 1 (mTORC1) е Rag гуанозин трифосфатазите, които в отговор на аминокиселини се свързват с раптор (фиг. 2). 53,54 Това взаимодействие променя вътреклетъчното местоположение на mTORC1 до отделение, където е неговият активатор Rheb. Активираните mTORC1 фосфорилират субстрати, от които са добре известни рибозомна S6 протеин киназа (S6K) и 4Е-свързващ протеин-1 (4EBP-1).
Регулиране на целевата мрежа на бозайници от сигналните мрежи на рапамицин комплекс (mTORC). Растежните фактори/митогени (инсулин, епидермален растежен фактор) и хранителни вещества (напр. Аминокиселини, енергия) насърчават mTORC1 сигнализирането чрез фосфорилиращи каскади, които се сближават в туберкулозния склерозен комплекс (TSC) и самите mTORCs. Инсулинът сигнализира чрез своя рецептор (Insulin-R) за активиране на фосфатидилинозитол 3-киназата (PI3K)/Akt/TSC/Rheb; аминокиселинни сигнали за достатъчност чрез hVps34 и Rag и RalA гуанозин трифосфатази; и енергийната достатъчност потиска AMP-активирана протеинкиназа (AMPK). Сигнализирането на инсулин/PI3K вероятно насърчава mTORC2 сигнализиране по неизвестен път. MTORC1/S6 протеин киназа (S6K) медиирана отрицателна обратна връзка сигнализира чрез 2 пътя за потискане на PI3K/mTORC2/Akt сигнализиране. АА, аминокиселини; AMP, аденозин монофосфат; АТФ, аденозин трифосфат; 4EBP-1, 4E-свързващ протеин-1; eIF4E, еукариотен иницииращ фактор 4Е; ERK, киназа, регулирана от извънклетъчен сигнал; IRS1, Инсулинов рецепторен субстрат 1; PDK1, зависима от фосфоинозитид протеин киназа 1; S6, S6 Рибозомен протеин.
Фосфорилираният S6K фосфорилира много субстрати, включително S6 рибозомния протеин, който е съществен компонент на механизма за иницииране на транслация на протеин. От друга страна, 4EBP-1 фосфорилиране, причиняващо освобождаването му от еукариотния иницииращ фактор 4Е (eIF4E), позволяващ инициирането на CAP-зависим протеинов синтез. 55,56 В допълнение към хранителните вещества, mTORC1 се активира от растежни фактори, особено инсулин. 57 Свързването с инсулин активира Ras-Erk1/2 и фосфатидилинозитол-3-киназа (PI3K) -AKT пътища, които се сливат в туберкулозен склерозен комплекс 2 (TSC2). 52 Комплексът TSC1-TSC2 инактивира mTORC1 комплекса чрез хидролиза на гуанозин трифосфат, който е необходим на Rheb за активиране на mTORC1. Фосфорилирането на TSC2 инхибира активността на TSC1-TSC2 комплекса, позволявайки активирането на Rheb и съответно mTORC1. 52 Активирането на PI3K пътя активира друг TOR комплекс, известен като mTORC2. Смята се, че mTORC2 участва в клетъчния растеж и цитоскелетната организация. 58
Подобряване на mdx патологията от левцин
Накратко, ако сарколемалното отслабване и увреждане е механизмът на заболяването и се предполага хипотеза за упражнение или хранене, за да се подобри увреждането, тогава изходните мерки се основават на методи като инжектиране на синьо багрило Evans, инжекция Procion портокал, анализ на креатин киназата, текущ показани са клема, напрежение, хистология, имунохистохимия, мерки за производство на сила и вътреклетъчни индикатори Ca 2+. 16 Интервенционални проучвания при мишки mdx предоставят примери за експериментални проекти за оценка на храненето при мускулна дистрофия, 35,75, както е показано в таблица 2 .
Таблица 2
Примери за експериментални проекти за тестване на хранителни интервенции
- Физическа активност и хранене Две перспективни стратегии за поддържане на теломер
- Хранителен статус и риск от допускане при мускулна дистрофия на Дюшен (DMD) Европейски респираторен
- Хранене и физическа активност при пациенти с мозъчно-съдова болест - изглед в пълен текст
- Хранене и физическа активност Мичиганска медицина
- Хранене за мъжка потентност Как да подобрим потентността естествено; Pharmacy Mall има общи цели с