Алена Кристина Хайме-Рамирес
1 Катедра по неврологична хирургия, Университетският всеобхватен център за борба с рака, Болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Нина Дмитриева
1 Катедра по неврологична хирургия, Университетският всеобхватен център за борба с рака, Болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Джи Йънг Йо
1 Катедра по неврологична хирургия, Университетският всеобхватен център за борба с рака, Болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Йешавант Банасавади-Сидеговда
1 Катедра по неврологична хирургия, Университетският всеобхватен център за борба с рака, Болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Jianying Zhang
2 Център за биостатистика Отдел по биомедицинска информатика, Комплексен център за борба с рака на Университета на Охайо, Болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Тереза Връзка
3 магистърска програма по неврология, Комплексен център за борба с рака на Университета на Охайо, болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Челси Болярд-Благословия
1 Катедра по неврологична хирургия, Комплексен център за борба с рака на Университета на Охайо, Болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Джефри Войтън
1 Катедра по неврологична хирургия, Комплексен център за борба с рака на Университета на Охайо, Болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Балвин Каур
1 Катедра по неврологична хирургия, Университетският всеобхватен център за борба с рака, Болница за рак на Джеймс и Изследователски институт Solove, Колумб, Охайо 43210, САЩ
Свързани данни
Допълнителна фигура 2. Валидиране на вмъкване на Chase N/M във вирусен скелет на HSV. PCR амплификация на Chase ABC с два изолата на OV-Control (OVc1, 2), OV-ChaseN (OVChN1, 2) или OV-ChaseM (OVChM1, 2).
Резюме
Въведение
Злокачествените глиоми (GBM) са изключително агресивни и имат средна преживяемост приблизително 15 месеца. Настоящите методи на лечение, които включват хирургична резекция, лъчева и химиотерапия, не са направили много за удължаване на живота на пациентите с GBM. Хондроитин сулфат протеогликани (CSPG) са от решаващо значение за взаимодействията между клетъчни клетки и клетки с допълнителна клетъчна матрица (ECM) и са замесени в растежа и инвазията на глиома. Хондроитиназа (Chase) ABC е бактериален ензим, който разцепва хондроитин сулфат дизахаридни вериги от CSPGs в ECM на тумора. Chase ABC от див тип има ограничена стабилност и/или активност в клетките на бозайници, поради което създадохме мутантна хуманизирана версия (Chase M) с подобрена функция в клетките на бозайници.
Ние предполагаме, че нарушаването на взаимодействията между клетките и клетките-ECM от ChaseM и темозоломид ще повиши химиотерапевтичната наличност и чувствителността на глиомните клетки.
Резултати
Използвайки първични невросфери, получени от пациент, открихме, че ChaseM намалява агрегацията на глиома невросфера in vitro. Освен това онколитичен HSV-1 вирус, експресиращ секретиран ChaseM (OV-ChaseM), засилва разпространението на вируса и убиването на глиомни клетки в сравнение с OV-Control, in vitro. Комбинаторното лечение с OV-ChaseM плюс TMZ доведе до значително синергично подобрение на убиването на глиомни клетки, придружено от увеличаване на апоптотичната клетъчна смърт. Вътреклетъчният цитометричен анализ разкрива значително намаляване на фосфорилирането на про-оцеляващия AKT протеин след лечение с OV-ChaseM плюс TMZ. И накрая, при голи мишки, носещи интракраниални GBM30 глиомни ксенотрансплантати, интратуморалната OV-ChaseM плюс TMZ (10 mg/kg чрез орален сондаж) комбинирана терапия доведе до значителна (p Ключови думи: Животински модел, рак на мозъка, химиотерапия, доставка на ген, HSV, онколитични вируси, туморна биология
Въведение
Злокачественият глиом, глиобластом (GBM), е много агресивна и често срещана форма на първичен мозъчен рак при възрастни със средна преживяемост по-малка от 15 месеца (1). Хондроитин сулфат протеогликани (CSPG), като асоциирани с мембраната CSPG4/NG2, PTPRZ1 и CD44, и членовете на лектиканското семейство версикан, агрекан и бревикан често са свръхекспресирани в глиома и са замесени в растежа на глиома, васкуларизация и инвазия (2, 3). Докато няколко проучвания демонстрират функционална роля на CS сегментите на CSPG при прогресия на глиома in vitro (4, 5), тяхното значение за блокиране на проникването на химиотерапевтици, като темозоломид (TMZ), и/или ролята за насърчаване на резистентността не е са проучени.
Chase ABC I (Chase) е бактериален ензим, който деполимеризира различни CS вериги глюкозаминогликан (GAG), които са ковалентно свързани към основния протеин на CSPG, без да променят структурата на основния протеин (6). Предишна работа от нашата лаборатория показва, че разграждането на глиома ECM с онколитичен вирус (OV), изразяващ Chase бактериалния ензим, повишава разпространението на OV и антитуморната ефикасност както in vitro, така и in vivo (7, 8). Неотдавнашната молекулярна характеристика на Chase разкри няколко потенциални места на гликозилиране в ензима, които могат да ограничат ензимната функция и/или/секрецията в клетките на бозайници (9). Тук, използвайки насочена към сайта мутагенеза на няколко потенциални места на гликозилиране, генерирахме хуманизиран мутантен ензим Chase (ChaseM), който води до оптимална ензимна експресия и функция в клетките на бозайници. Също така генерирахме OV, експресиращ ензима ChaseM, и определихме неговите ефекти върху глиомните клетки в комбинация с TMZ. С неотдавнашното одобрение от FDA на онколитичния HSV на T-Vec за нерезектабилен меланом, има нова надежда за такива нови методи за лечение на пациенти с GBM (10, 11).
Предполагаме, че нарушаването на взаимодействията между клетките или клетките-ECM с хуманизиран ензим Хондроитиназа ABC (ChaseM) ще повиши химиотерапевтичната наличност и чувствителност на глиомните клетки. Използвайки невросфери, получени от пациент, открихме, че ChaseM намалява агрегацията на глиома невросфера in vitro, подобно на фенотипа, наблюдаван при фармакологична блокада на CSPG. Онколитичен вирус секретира ChaseM (OV-ChaseM) подобрено разпространение на вируса и убиване на глиомни клетки в сравнение с OV-Control, in vitro. Нещо повече, тази ензимна активност се поддържа in vivo. В комбинация с TMZ, OV-ChaseM доведе до значително и синергично подобрение на убиването на глиомни клетки в сравнение с OV-Control плюс TMZ и предизвика значително намаляване на фосфорилирането на про-оцеляващия AKT протеин. In vivo OV-ChaseM плюс TMZ води до значително увеличение на преживяемостта спрямо мишки, лекувани само с TMZ или OV-ChaseM. Взети заедно, тези данни разкриват, че OV-ChaseM повишава чувствителността и чувствителността на глиомните клетки към TMZ и предоставя обосновката за нови лечебни режими, които ще се прилагат в клиниката.
Материали и методи
Клетъчни линии и реактиви
Клетки от човешки глиом (U87ΔEGFR, LN229, Gli36ΔEGFR-H2B-RFP, U251) и Vero клетки се култивират, както е описано по-горе (7). Първични клетки, получени от глиобластом (GB9, GB9-GFP и GBM30) са генерирани в държавния университет в Охайо или любезно предоставени от клиниката Mayo (X12) и поддържани в невросферни култури, както е описано (7, 12). Клетки Cos-7 бяха закупени от ATCC (Манасас, Вирджиния) и съответно култивирани. Клетките бяха рутинно наблюдавани за морфология и промени в растежа. Хондроитиназа ABC (Chase ABC), метил β-D-ксилопиранозид и темозоломид (TMZ) са получени от Sigma-Aldrich (Сейнт Луис, Мисури). Хондроитин сулфат А (CS A) е получен от Seikagaku Biobusiness Corp (Япония). Мишка моноклонално анти CS-4 антитяло (клон BE-123, Millipore, Temecula, CA) беше използвано за сондиране на функционалността на Chase. Трипаново синьо изключване с помощта на Cell Countess (Life Technologies, Inc. Carlsbad, CA) беше използвано за определяне на пролиферацията на глиомни клетки.
ChaseM поколение и вируси
Клонирането и изграждането на див тип Chase ABC е описано по-рано (7). Праймери G1, G2, G3 и G5, описани в (9), бяха използвани за мутиране на избраните N-гликозилиращи места на хондроитиназа ABC I cDNA с помощта на QuickChange Lightning Multi-Directed Mutagenesis Kit (Agilent Technologies, La Jolla, CA. Mutant Chase ABC cDNA се използва за генериране на OV-ChaseM вируси, както е описано по-горе (7). OV-Control е генериран без вмъкване на Chase.
Тестове за секреция на активен Chase ABCI in vitro и in vivo
За да се определи активността на Chase ABC in vitro, Cos-7 клетките се трансфектират с pcDNA3.1 ChaseN или ChaseM плазмиди, използвайки реагента за трансфекция FuGENE 6 (Roche Applied Science Inc, Indianapolis, IN). След 24 часа към трансфектираните Cos-7 клетки се добавя концентрирана среда U87ΔEGFR (източник на CSPG). Четиридесет и осем часа по-късно средата от клетките Cos-7 беше събрана, концентрирана, анализирана чрез анализ на Western Blot, използвайки антитялото BE-123, което разпознава остатъците от CS, оставени след разграждането на CSPG от ензима Chase ABC (7). За да се оцени активността на Chase ABC in vivo, GB9-GFP позитивните глиомни клетки се електропорират с 5 ug pcDNA3.1 LacZ или ChaseM, като се използва Amaxa Mouse Neural Stem Cell Nucleofector Kit (Lonza, Walkersville, MD). След това тези клетки се инжектират в стриатума на атимни голи мишки, както е описано по-рано (300 000 клетки/мишка и 3 мишки за всяко състояние) (7). Седем дни след имплантацията се събират тумори, фиксират се в 4% PFA и се анализира за реактивност BE-123 (7).
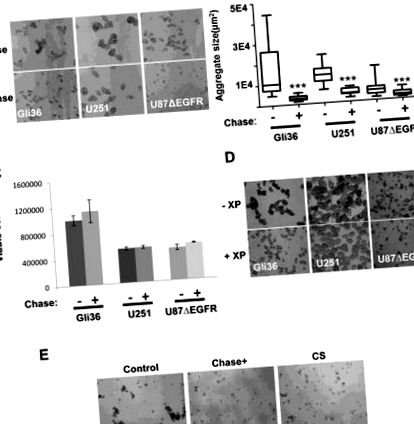
Агрегация и анализи
Клетките U87ΔEGFR, Gli36 ΔEGFR, U251 се посяват като единични клетки в 6-ямкови или 24-гнездови ултра ниско прикрепени плочи (Corning, NY) с DMEM среда, допълнена с 2% FBS или невросферна среда. След това клетките се инкубират в инкубатор за разклащане при 37 ° С в продължение на 48 часа в присъствието на 0,015 U/ml Chase ABC или 5 uM метил Р-D-ксилопиранозид, който се попълва на всеки 24 часа. CS A (0.2 μg/μl) бяха добавени към клетки U87ΔEGFR в продължение на 48 часа и клетъчната агрегация беше проследена с помощта на флуоресцентен микроскоп Nikon Eclipse TE2000-U. Изображенията са направени от 4-10 представителни полета на изглед и диаметрите на агрегатите/невросферата са измерени с помощта на софтуера Image J за изчисляване на площта. GBM30 или X12 глиомни клетки бяха трансфектирани с ChaseN, ChaseM или контролен плазмид (5 μg) с помощта на комплекта за нуклеофектор на нервни стволови клетки Amaxa Mouse (Lonza, Walkersville, MD), както е указано или заразено с OV-Control, OV-ChaseN или OV- ChaseM при MOI от 0,005 и засята в 96-ямкови плаки в три екземпляра за оценка на ефектите на Chase ABC върху невросферната култура след 72 часа култура чрез светлинна микроскопия.
Поточен цитометричен анализ
Всички поточни цитометрични анализи бяха проведени с помощта на активиран от флуоресценция клетъчен сортер на Becton Dickinson (FACS) LSRII (Becton-Dickinson, Сан Хосе, Калифорния) и анализирани с помощта на софтуера FlowJo (Ashland, OR), както е описано по-горе (13). Онколитичният вирусен GFP се оценява, като се използват глиомни клетки X12, които се третират при различна множественост на инфекцията (MOI) и се събират пет дни след инфекцията. След това клетките се фиксират в 1% формалин и се определя процентът на GFP положителни клетки. Двадесет и четири часа след OV инфекция глиомните клетки бяха третирани с TMZ и събрани пет дни по-късно. След това процентът на мъртвите клетки се определя количествено, като се използва комплект за оцветяване на живи/мъртви фиксирани мъртви клетки (Invitrogen, Carlsbad, CA) съгласно инструкциите на производителя. Клетъчната апоптоза се определя с помощта на анексин V-V450 и 7AAD (BD Biosciences Pharmingen, Сан Диего, Калифорния) в съответствие с производителя. Вътреклетъчното оцветяване на pAKTSer473-BV421 (BD Biosciences Pharmingen, Сан Диего, Калифорния) се извършва, както е посочено от производителя. Средната интензивност на флуоресценция (MFI) беше изчислена чрез вземане на площта под кривата за проби, оцветени с pAKT след изваждане на площта под кривата за съответния оцветен изотип контрол за всяка обработена група.
Изследвания върху животни
Всички проучвания на мишки са настанени и обработени в съответствие с указанията на Подкомитета за изследване на грижите за животните в Държавния университет в Охайо и са одобрени от Институционалния съвет за преглед. За всички вътречерепни туморни проучвания, 6-8 седмични атимни мишки nu/nu (Target Validation Shared Resource, The Ohio State University) бяха анестезирани и фиксирани в стереотаксичен апарат. След това се пробива отвор за пробиване на 2 mm странично до брегма до дълбочина 3 mm, както беше описано по-рано (7). За експерименти с GBM30, n = 5 атимични голи мишки бяха имплантирани със 100 000 туморни клетки и след това третирани с 3 × 10 5 pfu OV-ChaseM седем дни след имплантацията. Мишките бяха лекувани с 10 mg/kg TMZ в дните 8-12 чрез орален сонда след туморен имплант. Животните са наблюдавани ежедневно и са евтаназирани, когато проявяват симптоми на туморно бреме, като загуба на тегло и/или прегърбена стойка. Експериментите с животни се извършват в два екземпляра.
Статистически анализ
За статистически анализ бяха използвани GraphPad Prism 6 (GraphPad Software, Inc, La Jolla, CA), R3.3.1 (R Foundation for Statistics Computing, Виена, Австрия) и SAS 9.3 (SAS Institute, Cary, NC). За непрекъснато измерване след нормално разпределение, като клетъчна пролиферация и агрегация, беше използван t тест с две проби за сравняване на две независими условия. За сравнение на три или повече условия е използван еднопосочен ANOVA модел. Двупосочен ANOVA модел беше използван за тестове за контраст на взаимодействие или синергичен ефект. За данните за оцеляване функциите за оцеляване се оценяват по метода на Kaplan-Meier и се сравняват между групите чрез log-rank тест. Стойността р е коригирана за множество сравнения по процедурата на Holm. Стойността на р 0,05 или по-малко се счита за статистически значима.
Резултати
Хондроитиназата ABCI намалява образуването на невросфера в клетъчните линии на глиома и невросферите, получени от пациента
Представителни изображения на посочените глиомни клетки, трансфектирани с плазмид, кодиращ бета галактозидаза (контрол), див тип нормален Chase (Chase N) или хуманизиран мутант Chase (Chase M). Б. Клетките на бозайници Cos-7 бяха трансфектирани с плазмиди, кодиращи ChaseN (немодифицирана Chase DNA) или ChaseM (Mutant Chase), след което се култивира с концентрирана среда от U87ΔEGFR глиомни клетки (източникът на CSPG) в продължение на 48 часа. След това средата за клетъчна култура Cos-7 беше концентрирана и подложена на анализ на Western Blot с мъничко CS, използвайки клонинг на антитяло BE123. Имунореактивността е показателна за активността на ензимно разцепване на Chase. ° С. Имунофлуоресцентни изображения на мозъчни разрези на тумори от мишки, имплантирани с положителни GB9 туморни клетки със зелен флуоресцентен протеин (GFP) (обозначени в зелено), временно трансфектирани с плазмиди pcDNA3.1 LacZ или pcDNA3.1 ChaseM и оцветени с антитялото за разпознаване на мъниче BE123 CS (Оцветяване на разцепване от CSPG, обозначено в червено). Мащабна лента = 100μm. Всички експерименти in vitro и in vivo се провеждат, като се използва n> 3 трикратно в поне три независими повторения.
маса 1
Списък на мутирали аминокиселини, създадени в мутант Chase ABC относително див тип Chase ABC. Мутационните места в ензима Chase създадоха мутантна ДНК, за да генерират хуманизирана форма на ензима Chase (ChaseM). Последователността ChaseM е предшествана от човешка IgG κ-верига лидерна последователност за усилване на секрецията и пет потенциални места на N-гликозилиране са мутирали (N282Q, N338Q, N345Q, S517Q и N675Q).
| Няма лидерска последователност | Сигнал за секреция на IgGκ |
| 282N | 282Q |
| 338N | 338Q |
| 345N | 345Q |
| 517N | 517Q |
| 675N | 675Q |
Онколитичният вирус (OV) с функционален ензим ChaseM подобрява разпространението на вируса и убиването на глиомни клетки
OV-ChaseM усилва индуцираното от темозоломид (TMZ) апоптотично клетъчно убиване на глиомни невросфери
Благодарности
Бихме искали да признаем Аналитичния цитометричен споделен ресурс, Центъра за биостатистика и общите ресурси за валидиране на целите в Центъра за ракови заболявания на Джеймс, всички в Държавния университет в Охайо.
Предоставяне на подкрепа: Тази работа беше подкрепена от Националните здравни институти R01 NS064607, P01 CA163205, R01 CA150153 и P30 CA016058 (BK), F32 (F32CA186542) (ACJR) и T32> CA009338 (CBB). Постдокторантска стипендия за пелотония (ACJR) и грант ACS IRG-67-003-50 (JYY).
Бележки под линия
Разкриване на потенциален конфликт на интереси
Не са разкрити потенциални конфликти на интереси.
- Домакинство на метаболизма за вашите клетки Кедри-Синай
- Как яденето на мазна риба може да ви помогне да отслабнете чрез трансформиране на мастните клетки - Mirror Online
- Как вниманието организира групи нервни клетки, за да обогати симфонията на мозъка - ScienceDaily
- Йордания Брутна трансформация От 305 паунда на 235 за 7 месеца Шарлот Наблюдател
- Начало за отслабване Отслабнете Стойка за коремна преса Спомага за корема Треньор Фитнес Екви