Катедра по фармакология и терапия, Университет на Флорида, Гейнсвил, Флорида
Катедра по фармакология и терапия, Университет на Флорида, Гейнсвил, Флорида
Катедра по фармакология и терапия, Университет на Флорида, Гейнсвил, Флорида
Катедра по психиатрия, Университет на Флорида, Гейнсвил, Флорида
Департамент по стареене и гериатрични изследвания, Университет на Флорида, Гейнсвил, Флорида
Катедра по фармакология и терапия, Университет на Флорида, Гейнсвил, Флорида
Катедра по фармакология и терапия, Университет на Флорида, Гейнсвил, Флорида
Адрес за заявки за препечатка и друга кореспонденция: P. J. Scarpace, Катедра по фармакология и терапия, Унив. на Флорида, 1200 Нюел д-р, Гейнсвил, Флорида 32610 (имейл: [имейл защитен]).
Резюме
Оценихме приноса на симпатиковата инервация на кафява мастна тъкан (BAT) върху централната загуба на тегло, медиирана от лептин. В краткосрочно и дългосрочно проучване, плъховете F344BN са били подложени или на денервация на интерскапуларна НДНТ (Денервирана), или на фалшива операция (Шам). Животните от всяка група получиха Об (Leptin) или зелен флуоресцентен протеин (GFP; Control) ген чрез еднократна инжекция на рекомбинантен адено-свързан вирус, доставен централно. Промените в телесното тегло са регистрирани за 14 или 35 дни, след което се претеглят мастните тъкани и скелетните мускули. И в двете проучвания хипоталамусният фосфорилиран STAT3 (P-STAT3) е значително по-висок в групите Sham-Leptin и Denervated-Leptin в сравнение със съответните им контролни групи (P -/- мишките са устойчиви на индуцирано от диетата затлъстяване (20) и могат да се адаптират към студената среда (32).
За да определим дали симпатиковата инервация на iBAT е необходима за централната загуба на телесно тегло, индуцирана от лептин, проведохме краткосрочно и дългосрочно проучване, използващо рекомбинантна адено-свързана вирусна конструкция (rAAV), кодираща или Об (Лептин) или зелен флуоресцентен протеин (GFP; Контрол) ген в iBAT денервирани (денервирани) или фалшиви плъхове (Sham). Промените в телесното тегло, телесния състав и приема на храна са регистрирани в продължение на 14 дни (краткосрочно проучване) или 35 дни (дългосрочно проучване), след което се претеглят мастните тъкани и скелетните мускули.
Животни.
Шестмесечни мъжки плъхове Fisher 344 × Brown Norway (F344BN) са получени от Националния институт за стареене на колонии в лабораториите на Charles River (Wilmington, MA). Възрастни плъхове F344BN бяха избрани поради относително стабилното им телесно тегло при свободен достъп до храна в сравнение с други щамове на плъхове. При пристигане животните бяха настанени индивидуално на 12: 12-часов цикъл светлина-тъмнина и околната температура се поддържаше на 20-23 ° C. На всички плъхове беше разрешено поне 1 седмица да се приспособят към новата си среда, преди да започнат какъвто и да е експеримент. Плъховете са били хранени със стандартна храна за гризачи (18% kcal от мазнини, без захароза, 3,1 kcal/g, Diet 2018; Harlan Teklad, Madison, WI). Здравословното състояние, телесното тегло и приема на храна се наблюдават ежедневно по време на проучването. Всички експериментални протоколи са одобрени от Комитета по грижа и употреба на животните от Университета на Флорида и в съответствие с Ръководство за грижа и употреба на лабораторни животни.
Операции и групи.
Определяне на телесния състав с помощта на ядрено-магнитен резонанс с времева област.
Съставът на тялото се определя седмично, започвайки от ден 0 използване на ядрено-магнитен резонанс с времева област (TD-NMR; Minispec; Bruker Optics, The Woodlands, TX). MiniSpec определя количествено три компонента на телесния състав (мастна маса, свободна телесна течност и чиста телесна маса). TD-NMR получава и анализира сигнали от всички протони в областта на пробата. Сканиранията бяха получени, докато плъховете бяха задържани в цилиндрично устройство, поставено в анализатора. Крайните стойности съставляват средно две сканирания за всяко животно.
Събиране, събиране и подготовка на тъкани.
Плъховете бяха евтаназирани в седмица 2 (краткосрочно проучване) или седмица 5 (дългосрочно проучване) под анестезия (5% изофлуран) 3–6 часа след края на техния лек цикъл чрез торакотомия и обезкървяване. Няколко органа и тъкани бяха отстранени и претеглени (Mettler AE 163): хипоталамус, мастни депа (мезентериални, периренални, епидидимни, ретроперитонеални и iBAT) и мускули (gastrocnemius, soleus, plantaris, tibialis anterior и extensor digitorum longus). Хипоталамусът се дисектира от мозъка чрез медиален разрез на пириформените лобове, каудален на оптичния хиазъм и отпред на церебралната смазка на дълбочина 2,5 mm. Хипоталамусът и iBAT се обработват с ултразвук в 270 μl хомогенизационен буфер (10 mM Tris · HCl рН 6,9 и 2% SDS в присъствието на фосфатаза/протеазни инхибитори; Thermo Scientific, Rockford, IL). Хомогенатите, тъканите и плазмените проби се съхраняват при -80 ° C, докато се извършат анализи.
Западни анализи.
Протеиновите лизати се разделят върху SDS-PAGE гел и се прехвърлят в нитроцелулозни мембрани. Имунореактивността беше открита с ECL prime (GE Healthcare, Piscataway NJ), сканирана с ChemiDoc XRS + (Bio-Rad, Hercules, CA) и количествено определена с помощта на ImageJ софтуер. Всички стойности, включително контролите, бяха нормализирани към средното за групата Sham-Control и бяха отчетени като процент. За капацитета на iBAT за термогенеза, имунореактивността се оценява с антитела срещу UCP1 (Abcam, Cambridge, MA) и се нормализира до β-тубулин като контрола на натоварването. Фосфо-STAT3 (P-STAT3; Cell Signaling, Danvers, MA) беше определен чрез сравняване на получените сигнали, използващи антитела, специфични за фосфорилирания протеин, спрямо сигналите, записани с използване на GAPDH антитяло.
Определяне на съдържанието на триглицериди в тъканите.
Концентрациите на триацилглицерол в черния дроб и мускулите са изчислени от глицерол, отделен след етанолна KOH хидролиза, като се използва търговски комплект (Sigma, Сейнт Луис, МО). Frayn и Maycock (12) показват, че пропускането на отстраняването на фосфолипидите води до само ± 2% грешка при определяне на съдържанието на триацилглицерол в тъканите.
Серумен лептин.
Нивата на серумен лептин се определят чрез ензимни имуноанализи (комплект за лептин за плъх ELISA, EZRL-83K; Milipore, Waltham, MA). Лептинът е измерен в кръвта, събрана по време на евтаназия (хранено състояние).
RT-PCR.
Общата РНК се изолира от хипоталамуса с TRI реагент (Sigma-Aldrich). Две микрограма РНК бяха транскрибирани обратно в комплементарна ДНК, използвайки комплекти за комплементарна ДНК с обратна транскрипция с голям капацитет (Applied Biosystems, Waltham, MA). Генната експресия на лептин се определя със SYBR Green Supermix, като се използват праймерни комплекти, предназначени да усилят мутантния лептин, генериран от вектора (напред: 5′-GGCAACGTGCTGGTTATTGT-3 ′ и обратен: 5′-ATATCCATCACACTGGCGGC-3 ′), но не и от естествената последователност. Gapdh (напред: 5′-TCTCTGCTCCTCCCTGTTCT-3 ′ и назад: 5′-TACGGCCAAATCCGTTCACA-3 ′) е използван като домакински ген. IQ (Bio-Rad) беше използван за откриване на нивото на усилване и програмиран с начален етап от 3 минути при 95 ° C, последван от 40 цикъла за 5 s при 95 ° C и 15 s при 60 ° C. Всички реакции се провеждат в два екземпляра и за количествено определяне се използва средната стойност на праговия цикъл (CT). Относителното количествено определяне на целевите гени беше определено с помощта на ΔΔCT метода. Накратко, стойностите на CT на целевите гени бяха нормализирани (ΔCT = CTTarget - CTGapdh) и сравнени с калибратор (ΔΔCT = ΔCTS проба - ΔCTC калибратор). Относителният израз (RQ) беше изчислен с помощта на софтуера IQ (Bio-Rad).
статистически анализи.
Резултатите са изразени като средни стойности ± SE. Разликите между средните стойности бяха тествани за статистическа значимост (P + клетките бяха разпределени в структурите на средната линия по мястото на инжектиране в третата камера, простираща се от предната комисура до задния хипоталамус (9). Активирането на централния лептинов рецептор се определя чрез измерване на фосфорилирането на STAT3 (P-STAT3), сигнално събитие след активирането на лептинов рецептор b (Ob-Rb). P-STAT3 е от съществено значение за регулирането на лептина при хранене и разход на енергия (35). И двете групи Sham-Leptin и Denervated-Leptin показват значително по-високо съдържание на P-STAT3 в хипоталамуса (Фиг. 3, A и Б.; P 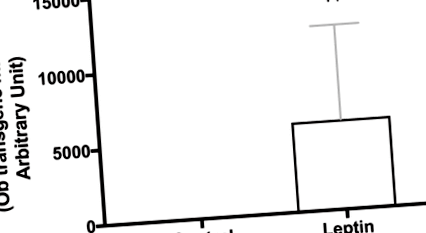
Фиг. 1.Потвърждение на експресията на лептинов трансген в мозъка. Хипоталамусът от отделни плъхове (на същата възраст и щам), които са били подложени на същото лечение като в дългосрочното проучване, са използвани за потвърждаване на експресията на лептинов трансген. Стойностите се отчитат като нива на експресия на пъти въз основа на нива, записани при животни, инжектирани с контролния вектор (н = 10/група). ††P
Фиг. 2.Нива на серумен лептин. A и Б.: серумни нива на лептин, измерени съответно в края на краткосрочното и дългосрочното проучване. †††P
Фиг. 3.Валидиране на използвания експериментален модел. A и Б.: за оценка на сигналната активност на лептин, фосфорилирането на STAT3 е оценено в хипоталамуса на плъхове, съответно в края на краткосрочното и дългосрочното проучване. ° С и д: като мярка за термогенна активност на интерскапуларната кафява мастна тъкан (iBAT), в края на краткосрочното и дългосрочното проучване беше измерено съдържанието на разединяващ протеин 1 (UCP1). Стойностите се изразяват като средни стойности ± SE. ††P
Индуцирана от лептин съпоставима телесна маса и загуба на мастна маса както при фалшиви, така и при денервирани животни.
В съответствие с предишните ни проучвания, доставката на централен ген на лептин води до стабилна и продължителна загуба на тегло (Фиг. 4, A и Б.) (9, 30). В краткосрочния експеримент бяха открити значителни разлики между контролната и лептиновата групи, започвайки от ден 7 (Фиг. 4A; P
Фиг. 4.Седмични промени в телесното тегло и приема на храна. A и Б.: телесното тегло се записва ежедневно и седмичните промени в [делта (Δ)] телесно тегло се изчисляват чрез изваждане на телесното тегло, записано при ден 0 от телесното тегло, записано при дни 0, 7, 14., 21., 28, и 35. В краткосрочното проучване Δ теглото на тялото при Sham-Leptin и Denervated-Leptin се различава значително от съответната им контролна група, като се започне ден 7, и разликите между тези групи остават статистически значими до ден 14 (P
Доставката на ген за лептин бързо предизвиква загуба на мастна маса (Фиг. 5, A и Б.; P
Фиг. 5.Седмични промени в мастната и постната маса. A и Б.: масата на мазнините се оценява ежеседмично по времеви домейн (TD) -NMR и седмичните промени в Δмазнината се изчисляват чрез изваждане на абсолютната маса на мазнините, записана при ден 0 от абсолютната маса на мазнините, записана при дни 0, 7, 14., 21., 28, и 35. В краткосрочното проучване Δмаслената маса в Sham-Leptin (н = 8) и денервиран лептин (н = 8) е различен от съответната им контролна група (н = 7 за Sham и н = 8 за денервиран контрол) при дни 7 и 14. (P
Дългосрочната централна лептинова генна терапия доведе до атрофия на мастна маса както при фалшиви, така и при денервирани животни.
Както беше съобщено по-рано, администрирането на лептинов ген води до атрофия на мастната тъкан. Всъщност коремната кухина на плъховете Sham-Leptin и Denervated-Leptin съдържа само следи от мазнини (Таблица 1). Лечението с лептин и денервация предизвиква загуба на iBAT маса (Фиг. 5Б.; P
Таблица 1. Тежести на тъканите
ТА, тибиалис отпред; EDL, extensor digitorum longus; iBAT, междускапуларна кафява мастна тъкан.
*** P ‡ P ‡‡‡ P
Фиг. 6.Съдържание на тъканни триглицериди (TG). A и Б.: съдържанието на TG в черния дроб е измерено съответно в крайната точка на краткосрочното и дългосрочното проучване. И в двете проучвания, съдържанието на TG в черния дроб е значително по-ниско в групите на лептин в сравнение с техните контролни групи. ° С и д: съдържанието на TG в мускулите е измерено съответно в крайната точка на краткосрочното и дългосрочното проучване. Значителен ефект на лептин се наблюдава в дългосрочното проучване, но не и в краткосрочното проучване. В краткосрочното проучване денервираните животни показват значително по-ниски нива на мускулен TG в сравнение със съответните фалшиви животни. †††P
Разбирането на приноса на iBAT симпатичната инервация за индуцирана от лептин загуба на тегло е важно за пълното разбиране на ендогенните механизми, регулиращи енергийната хомеостаза. Към днешна дата индукцията на UCP1 все още се счита за основен механизъм за индуцирана от лептин загуба на телесно тегло (8, 26). Показано е, че лептинът стимулира използването на енергия през ob/ob мишки чрез увеличаване на термогенния капацитет и се предполага, че намалява Ucp1 експресията в НДНТ на тези мишки е отчасти отговорна за тяхната повишена метаболитна ефективност и склонност към затлъстяване (8, 21). Хроничното лечение с лептин увеличава консумацията на кислород и намалява мастната маса при мишки от див тип, но не и при Ucp1-KO мишки, в сравнение със съответните контролни мишки, хранени с двойки (8, 26). Значението на iBAT термогенезата за цялостния катаболен ефект на лептина никога не е установено.
Термогенният потенциал на НДНТ се дължи на високото съдържание на митохондрии и несвързаното окисляване на субстрата от електронен транспорт. Важно е, че НДНТ може да окислява до 50% от приетите триглицериди и 75% от приетата глюкоза (24), като по този начин демонстрира способността на НДНТ да регулира системната енергийна хомеостаза. Въпреки че UCP1 играе важна роля за iBAT термогенезата, животни, които не изразяват Ucp1 генът може да оцелее в студена среда (23) и дори може да бъде устойчив на индуцирано затлъстяване (10), което предполага, че UCP1 не е необходим за поддържане на енергийната хомеостаза.
Това настоящо проучване използва рекомбинантни адено-свързани вирусни техники за подобряване на централната лептинова сигнализация и проверка дали iBAT симпатиковата инервация е от съществено значение за индуцираната от лептин загуба на телесно тегло. Централният лептин свръхекспресия индуцира UCP1 само в iBAT на фалшив, а не в iBAT на денервирани плъхове. Въпреки разликите в нивата на UCP1, подобно телесно тегло и загуба на мастна маса между животни с денервиран лептин и фалшиво лептин се наблюдават както в краткосрочните, така и в дългосрочните проучвания. Анализите на телесния състав показват, че животните губят значително количество мастна маса през първите 14 дни, които след това остават стабилни. Изглежда, че запасите от мазнини са почти ако не напълно изчерпани след 2 седмици доставка на лептинов ген както при непокътнати, така и при денервирани плъхове. Тази бърза загуба на мастна маса потвърждава по-рано наблюдавания катаболен отговор на лептина (22). Като се има предвид много ограниченото количество бяла мастна тъкан (WAT), което остава в края на нашите проучвания, бъдещите експерименти трябва да се фокусират върху анализиране на WAT липолиза и ремоделиране в по-ранни часови точки, преди изчерпването на запасите от WAT.
Настоящите проучвания показват, че iBAT симпатиковата инервация не е необходима за медиирана от централния лептин сигнализирана загуба на тегло. Този хирургичен модел е по-добър от използването на глобален Ucp1 нокаут, тъй като тези животни показват силно хетерогенни компенсаторни адаптации към метаболитно предизвикателство (33). Освен това, Ucp1 се изразява в WAT; следователно, нокаут моделът не разграничава приноса на термогенезата на НДНТ от кафявото на WAT. Важно ограничение на нашия модел обаче е, че iBAT беше единственото денервирано депо за НДНТ. Следователно не можем да изключим приноса на други непокътнати складове за НДНТ. Възможно е медиастиналната, аксиларната, периреналната и цервикалната НДНТ да допринесат за отговора на лептина при денервирани от iBAT животни. Необходим е нов модел, инхибиращ активността на симпатиковата нервна система във всички складове за НДНТ, за да се определи общият принос на симпатиковия отток на НДНТ при лекувани с лептин животни. Значението на междулопаточната кафява мастна тъкан за цялостната термогенеза на НДНТ не е ясно описано в литературата. Някои проучвания с мишки съобщават, че iBAT представлява 60–70% от общата НДНТ (1, 2), докато други доклади показват, че iBAT представлява само
25% от всички кафяви мазнини (33). Новите техники, използващи многопараметрична базирана на магнитен резонанс автосегментация на невронни мрежи, могат да помогнат да се осигури по-точно количествено определяне на всяко депо за НДНТ (3). Беше показано, че телесната температура е под разпределен контрол и има потенциал да позволи компенсация за събитие, нарушаващо функцията на НДНТ (25). Следователно е възможно денервацията на iBAT да е задействала периферни компенсации като покафеняване на WAT и/или увеличаване на NST на базата на мускули и бъдещите проучвания трябва да имат за цел да идентифицират тези механизми. Също така е добре документирано, че механизми като повишена липолиза и/или намалена липогенеза в WAT имат важен принос за централната загуба на тегло, медиирана от лептин (4). Освен това, въпреки че симпатиковият отток към НДНТ не е критичен, възможно е в естествено състояние (без денервация) симпатиковият отток към iBAT все още да участва в медиирана от лептин загуба на телесно тегло. Независимо от това, като се има предвид цялото внимание, обърнато на ролята на лептина върху биологията на кафявата мастна тъкан, определянето, че iBAT симпатиковата инервация не е необходима за медиирана от лептин загуба на тегло, подчертава сложността на механизмите, залегнали в ролята на регулирането на телесното тегло на лептина.
В обобщение установихме, че индуцирането на UCP1 чрез iBAT симпатикови изтичания не е необходимо за медиирана от лептин загуба на тегло. Животните Sham-Leptin и Denervated-Leptin реагират в еднаква степен както в краткосрочното, така и в дългосрочното проучване. TD-NMR анализите показват, че тези животни губят подобна пропорция на мазнини и чиста телесна маса. Бъдещите проучвания трябва да изследват възможния принос на други термогенни пътища като покафеняване на WAT или термогенеза на мускулна основа.
Тази работа беше подкрепена от Националния институт по диабет и храносмилателни и бъбречни заболявания грант DK-091710.
Не се декларират конфликти на интереси, финансови или други, от авторите.
- Как лимфният дренаж може да ускори отслабването и детоксикацията на тялото Blys
- Magic Отслабване за отслабване и подпомага процесите на отделяне на мазнини на тялото SlimFit Keto - Storm
- Как можете да постигнете тялото на мечтите си - Програма за бързо отслабване на Orion
- Как отслабването може да повлияе на мускулната маса, метаболизма и телесните мазнини
- Как закуските шам-фъстъци ви помагат по-добре да управлявате отслабването от Уолтър Адамсън Body Age Buster Medium
