Резюме
Въведение
Херпес симплекс вирусният енцефалит (HSE) 3 е най-често срещаният фатален спорадичен енцефалит при хората (1–3). Деветдесет процента от всички случаи на HSE са причинени от херпес симплекс вирус (HSV) -1 (4). Нелекуван, HSE има 70% смъртност. Лечението с антивирусни лекарства, като ацикловир, намалява смъртността, свързана с HSE, до 20%; обаче само 38% от пациентите с HSE се възстановяват до нормална функция (4,5). HSE е съществен проблем за имуносупресираните, включително хората с ХИВ и тези, подложени на химиотерапия.
Когато се прилага интраназално (i.n.), HSV-1 навлиза в централната нервна система (ЦНС) по невронални пътища на обонятелните и тригеминалните нерви (6). Този път на инфекция води до остър некротизиращ енцефалит, включващ обонятелната и лимбичната системи, включително обонятелната луковица, хипоталамуса, таламуса, амигдалата, хипокампуса и обонятелните и енторхиналните кори. В този модел HSV-1 инфектира предимно неврони и глиални клетки (7,8). Инфекцията на неврони и глия индуцира производството на провъзпалителни цитокини, произведени от микроглии и инфилтриращи макрофаги, както и производството на хемокини и антивирусни цитокини (9,10). Тъй като репликацията на вируса продължава, както CD4 +, така и CD8 + Т лимфоцитите проникват в мозъка (11–13). Интраназалният път на инфекция имитира хипотезирания път на човешки HSE, където се смята, че вирусът навлиза в ЦНС чрез обонятелния път или чрез тригеминалния ганглий (1,14,15). Интраназалният модел на HSV-1 инфекция е добре характеризиран при мишки (8,13,16–19).
Витамин Е (VE) е семейство токофероли и токотриеноли, от които α-токоферолът (α-TOC) е най-биологично активен и втори по разпространение в храната (20). Тези разтворими в липиди антиоксидантни витамини се намират в клетъчните мембрани и предотвратяват липидната пероксидация чрез изчистване на свободните радикали (21). Дефицитът на VE е свързан с повишен оксидативен стрес, централна и периферна невропатия и нарушена имунна функция (22–24). Дефицитът на VE увеличава паразитното натоварване и патологията при мишки, които са експериментално заразени с Heligmosomoides polygyrus (23). Дефицитът на VE също намалява броя на Т- и В-клетките при плъхове, заразени с Trypanosoma cruzi (24).
Доказано е, че добавките с VE намаляват имуносесценцията, подобряват имунната функция и могат да бъдат невропротективни. Добавката на VE е способна да модулира Т-клетъчните цитокини, включително интерферон (IFN) -γ (25,26). Краткосрочните добавки с висока доза VE при пациенти с колоректален рак увеличават производството както на IFNγ, така и на интерлевкин (IL) -2 (25). Високата диетична VE увеличава производството на IFNγ и IL-2 при възрастни мишки след грипна инфекция (26). В скорошно проучване Han et al. (27) установи, че VE засяга широк спектър от имунни гени при стари, но не и млади мишки. Освен това е доказано, че VE спира възрастовия спад в образуването на CD4 Т-клетъчни синапси (28). Доказано е, че при млади мишки, стресирани от сдържаност, VE увеличава производството на IFNγ и IL-2 в стимулирани от конканавалин А спленоцити (29).
Изследвания от нашата лаборатория сочат ключова роля на антиоксидантните микроелементи, включително VE, в патогенезата на инфекциозните заболявания (30–34). По-конкретно, ние показахме, че добавките с VE могат да намалят индуцирания от коксакивирус миокардит при мишки с дефицит на селен. В отсъствието на VE, натоварените с желязо мишки значително увеличават индуцирания от коксакивирус миокардит в сравнение с натоварените с желязо, VE-адекватни (VE-A) мишки. Заедно изследвания от нашата лаборатория и други показват, че VE има потенциала да модулира имунния отговор към вирусен патоген.
Тъй като мозъкът е богат на липиди, ние предположихме, че дефицитът на VE би увеличил HSE патологията при мишки, и освен това добавянето на VE ще намали симптомите на HSV-1 енцефалит.
Материали и методи
Мишки, диети и инфекции
Weanling BALB/cByJ мъжки мишки (Jackson Labs) се хранят ad libitum 1 от 3 диети: 1) VE-дефицитна (VE-D) диета (TD 88163), 2) VE-A (dl-α-токоферилацетат) диета (38,4 mg/kg) или 3) VE-допълнена (VE-S) диета (384 mg/kg) (Harlan Teklad) (Таблица 1). След 4 седмици на диетите, мишките бяха леко упоени с разтвор на кетамин (0,6 mg/kg) и ксилазин (0,35 mg/kg) и инфектирани i.n. с единица за образуване на плака 1,5 × 10 6 (PFU) от HSV-1 в общ обем от 10 μL. Всички мишки бяха настанени по 4 на клетка в Института за животни на Университета на Северна Каролина, който е напълно акредитиран от Американската асоциация за акредитация на лабораторни грижи за животните. Животните се отглеждат съгласно протоколи, одобрени от Институционалния комитет за употреба и грижи за животните.
МАСА 1
Състав на експериментални диети 1
| g/kg | |||
| Казеин, без витамин | 200,0 | 200,0 | 200,0 |
| DL-метионин | 3.0 | 3.0 | 3.0 |
| Декстроза, монохидрат | 674.3 | 674.3 | 674.3 |
| Царевично масло, без токоферол | 50,0 | 50,0 | 50,0 |
| Целулоза | 30,0 | 30,0 | 30,0 |
| Минерален микс, AIN-76 | 35,0 | 35,0 | 35,0 |
| DL-α-токоферилацетат (500 IU/g) | 0 | 0,077 | 0,77 |
Запаси от вируси на HSV-1 и инактивиране на вируси
Запасите от HSV-1 McIntyre (ATCC) се размножават във Vero клетки (ATCC), събират се, центрофугират се (750 × g; 5 минути) и се съхраняват при -80 ° C. Vero клетките се поддържат в DMEM, допълнени с 2 mmol/L глутамин и се коригират с 1.5 g/L натриев бикарбонат, 0.1 mmol/L несъществени аминокиселини, 1.0 mmol/L натриев пируват и 10% фетален говежди серум.
HSV-1 се инактивира чрез поставяне на 1 ml аликвотни части в 30 mm съдове за тъканна култура (Becton-Dickinson) на 2,5 cm от бактерициден източник на UV светлина за 6 минути. Инактивирането се потвърждава чрез добавяне на инактивиран вирус към клетките Vero, за да се провери липсата на вирусна репликация.
Патология и събиране на тъкани
След инфекцията мишките се претеглят, изследват се ежедневно и се оценяват по следната скала: 0, без симптоми; 1, разрошена козина, атаксия; 2, парализа на задните крайници/прилепване на предните крайници; 3, парализа на задните крайници със слабост на предните крайници; 4, умиращ; 5, мъртъв. За експерименти с PCR и вирусен титър, незаразени (UNI, d0), d 3 и 7 постинфекционни (p.i.) мишки бяха убити чрез бърза дислокация на шийката на матката и мозъкът беше отстранен и бързо дисектиран върху лед и замразена светкавица.
Измервания на α-TOC на черния дроб и мозъка
нивата на α-TOC бяха измерени чрез HPLC, следвайки стандартни методи (35).
Мерки за мозъчен цитокин
Нивата на тРНК се определят чрез изолиране на обща РНК от предния мозък (таламус и хипоталамус), използвайки метода TRIzol (Invitrogen). Обратната транскрипция се извършва, като се използва Superscript II First Strand Synthesis kit (Invitrogen) с олиго (dT) праймери. Експресията на иРНК на цитокини и хемокини се определя чрез количествена RT-PCR (34). Нивата на иРНК за глицералдехид-3-фосфат дехидрогеназа бяха определени за всички проби и използвани за нормализиране на генната експресия.
Мозъчните стъбла (BS) се събират в 0,5 ml ледено студен DMEM и се хомогенизират, избистря се чрез центрофугиране (2500 × g; 3 минути) и се съхраняват при -80 ° C, докато се анализира за регулиране при активиране, нормална Т-клетка експресирана и секретира (RANTES) и IFNγ индуцируем протеин-10 с Luminex-базиран мултиплекс ELISA комплект (Biosource) и IL-1β и тумор некротизиращ фактор (TNF) -α ELISA (BD Pharmingen) следвайки инструкциите на производителя.
HSV-1 титри в мозъка
Вирусните титри на HSV-1 от целия мозък се определят от хомогенизирана мозъчна тъкан чрез стандартен анализ на плака върху Vero клетки. За вирусни титри от обонятелната луковица и геномна ДНК на мозъчния ствол се извършва PCR, както е описано по-рано (36). ДНК от UNI тъкан се извлича паралелно и служи като отрицателна контрола.
Статистика
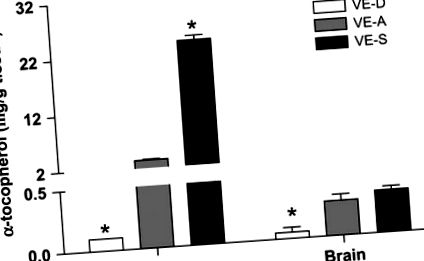
Концентрации на α-TOC в черния дроб и мозъка на мишки, хранени с диети VE-D, VE-A и VE-S в продължение на 4 седмици. Данните са средната стойност ± SEM, n = 4. * Различна от VE-A по това време, P 6 PFU на HSV-1 и последвана за симптоми на HSE. Мишките VE-D са имали повишени симптоми на HSE, както и 28,6% смъртност с d 7 p.i., докато нито една мишка VE-A не е умряла до d 7 p.i. (Р = 0,03). Мишките VE-A са имали по-малко симптоми на енцефалит (и няма смъртност) в сравнение с мишките VE-D (Таблица 2).
ТАБЛИЦА 2
Повишена смъртност и HSE симптоми при VE-D мишки 1
| % | ||
| VE-D | 28.60 | 2,00 ± 0,44 |
| VE-A | 0,00 | 1,00 ± 0,26 |
| VE-S | 0,00 | 1,58 ± 0,45 |
Дискусия
VE е предложено като лечение на HSV инфекции (39). Въпреки това, има малко проучвания, които са изследвали ефекта на VE върху HSV инфекции (40–42). Докато добавянето с VE става противоречиво (43,44), 93% от мъжете и 96% от жените в САЩ не консумират препоръчителната дневна доза VE (45,46), а данните от NHANES III показват, че много ниски серумни нива на α-TOC (47).
В това проучване дефицитът на VE увеличава HSE патологията, но добавянето на VE не подобрява симптомите в сравнение с мишките с VE-A. Както беше демонстрирано по-рано, HSV-1 инфекцията при VE-A мишки увеличава експресията на про- и противовъзпалителни цитокини, антивирусни цитокини и хемокини в мозъка (37,38). Дефицитът на VE значително увеличава експресията на всички тези медиатори на d 7 p.i. в сравнение с VE-A мишки. Интересното е, че добавките с VE не успяха да намалят възпалението. Въпреки че добавките с VE ясно повишават нивата на α-TOC в черния дроб, добавките 10 пъти не успяват да повишат нивата на α-TOC на мозъка, което предполага, че мозъкът контролира строго състава на клетъчната мембрана. Фактът, че добавката с VE не успява да увеличи нивата на VE в мозъка вероятно е причината за липсата на ефект на добавките с VE върху нивата на мозъчните цитокини и хемокини.
Азотният оксид може да действа като имунен медиатор, който води до увреждане на невроните (48). iNOS, ензимът, който произвежда азотен оксид, се регулира по време на инфекция с HSV-1. Производството му играе двойна роля в отговора на HSV, тъй като iNOS е важен за изчистването на инфекцията (49), но твърде много е вредно. iNOS се регулира по време на инфекция с HSV-1 във времеви и пространствен модел, който следва вирусна репликация (50). iNOS инхибитори, прилагани на мишки, заразени i.n. с HSV-1 са показали, че значително намаляват парализата и смъртността (50). Това предполага, че iNOS играе критична роля в патогенезата на HSV-1 и че повишените нива при VE-D мишки може да са фактор, допринасящ за смъртността при тези мишки.
Микроглиалните клетки са идентифицирани като източник на производство на възпалителни цитокини по време на инфекция с HSV-1 както при хора, така и при мишки (37,51,52). По време на инфекция с HSV-1 микроглията от мишки BALB/c предизвиква енергичен, но не защитен отговор на HSV-1 (37). При VE-D мишките, противовъзпалителният отговор е дори по-силен, отколкото при VE-A мишките. В светлината на невротоксичната природа на тези цитокини (53,54) е вероятно повишената патогенеза при VE-D мишки да е свързана с този прекалено силен отговор.
Глутаматът се освобождава от микроглията след активиране от провъзпалителни стимули, включително цитокини (55). Прекомерното освобождаване на глутамат е невротоксично, което води до увреждане на невроните и невровъзпаление. In vitro заразените с HSV-1 микроглиални клетки освобождават невротоксични фактори, които водят до невронална смърт, когато супернатантите се прехвърлят в невронални култури. Невротоксичните ефекти на тези вещества са частично блокирани от iNOS инхибитори и антагонисти на N-метил-D-аспартат (NMDA) (54). Следователно, iNOS и индуцираната от глутамат невротоксичност чрез NMDA рецептори могат да бъдат частично отговорни за HSV-1-свързани невронни увреждания. In vivo, прилагането на NMDA-рецепторен антагонист на HSV-1 мишки със стресиращо ограничение намалява HSE патологията и смъртността (19). В мозъка дефицитът на VE води до повишено производство на глутамат (56). Заедно с увеличаването на глутамата, високите нива на възпалителни цитокини, произведени при VE-D мишки, вероятно са довели до невротоксичност, която може да е била усилена от увеличаване на активираната микроглия.
Хемокините и адхезионните молекули се регулират при VE-A мишки след инфекция с HSV-1 (10,37,57,58). Този отговор беше още по-изразен при VE-D мишки. Хемокините и експресията на адхезионната молекула са необходими, за да преминат Т клетките през кръвно-мозъчната бариера и да влязат в мозъка по време на инфекция с HSV-1 (57,59). Бъдещите проучвания ще изследват въздействието на повишените молекули на хемокин и адхезия върху трафика на Т-клетки при VE-D мишки. Освен това, високата концентрация на α-TOC в периферията може да промени функцията на Т-клетките или трафика на VE-S мишки.
Инфекцията на ЦНС с HSV-1 води до оксидативен стрес и липидна пероксидация (60,61). Тъй като само VE-D увеличава оксидативния стрес и липидната пероксидация (22,62), а VE-D мишките в това проучване са увеличили HSV-1 вирусна репликация, не е изненадващо, че са увеличили производството на цитокини/хемокини p.i. Предишни проучвания показват, че VE е ефективен за контролиране както на периферното, така и на централното възпаление, както и за намаляване на поведението при болест при мишки, лекувани с LPS (63–65). VE се счита за много добър кандидат за намаляване на симптомите на HSE. Въпреки това, добавка 10 × VE не успя да увеличи нивата на α-TOC в мозъка спрямо нивата на VE-A. Следователно липсата на ефект върху нивата на цитокини и хемокини в мозъка на VE-S мишки не беше неочаквана. Възможно е по-продължителната добавка с 10 × VE да увеличи нивата на α-TOC в мозъка достатъчно, за да бъде защитна, това ще изисква допълнително проучване.
В допълнение към производството на цитокини и хемокини, симптомите на HSE са резултат от вирусното натоварване в различните мозъчни региони. Малко проучвания изследват въздействието на антиоксидантния дефицит върху вирусната репликация. От проведените проучвания дефицитът на селен води до повишена репликация на коксакивирус; това обаче не оказва въздействие върху възпроизвеждането на грип A/PR8 (66,67). Както ресвератролът, антиоксидант, така и локално приложената VE показват, че намаляват репликацията на HSV-1 (40,68). В това проучване VE-D мишките имат значително по-висок вирусен товар в предния мозък и мозъчния ствол в сравнение с VE-A или VE-S мишки. Това е важно, тъй като тези региони са жизненоважни за поддържане на хомеостазата на цялото тяло. Хипоталамусът (част от предния мозък) е отговорен за поддържането на хомеостазата чрез регулиране на жаждата, глада, циркадните ритми и контрола върху автономната нервна система. Мозъчният ствол контролира дишането, сърдечната честота и кръвното налягане. Високите вирусни титри и възпалителни цитокини в тези региони, причиняващи невронално увреждане, биха могли да доведат до повишена смъртност, наблюдавана при VE-D мишки. Констатацията, че VE-A и VE-S мишките имат сходни титри, не е изненада, като се има предвид, че 10-кратното добавяне не е ефективно за промяна на мозъчните нива на α-TOC.
Взети заедно, тези данни показват глобален неуспех на VE-D мишки да създадат подходящ имунен отговор на централна инфекция с HSV-1 и неуспех на 10 × VE-S да намали симптомите на HSE. Тези открития са важни, тъй като по-голямата част от хората в Съединените щати не консумират достатъчно VE в диетата си, което предполага, че имунната защита срещу HSV енцефалит, а може би и други вирусни инфекции, може да е неоптимална.
Благодарности
Авторите благодарят на д-р Алън Смит, USDA, за извършването на VE анализ и на д-р Орвил Левандер и Алексия Смит за проницателна дискусия.
Бележки под линия
1 Подкрепено отчасти чрез безвъзмездна помощ от Националния институт по екологични науки за здравето (P30ES10126) и от безвъзмездни средства от NIH за Отдел за клинично хранене (DK56350) в Университета на Северна Каролина.
2 Разкриване на авторите: П. А. Шеридан и М. А. Бек, без конфликт на интереси.
- ВИТАМИН А, ИНФЕКЦИЯ И ИМУННА ФУНКЦИЯ Годишен преглед на храненето
- Недостигът на витамин D насърчава хиперплазия на простатата при мишки на средна възраст чрез обостряне на местните
- Ролята на диетичното разнообразие в отговора на лечението на неусложнен тежък остър
- Ефектът на витамин С върху съотношението на колаген тип I и III в областта на перипротезата при мишки
- Чревният протеин, свързващ мастните киселини, не е от съществено значение за усвояването на мазнините в храната при мишки -