Свързани данни
Резюме
Острата манипулация на генната и протеиновата функция в мозъка е от съществено значение за разбирането на механизмите на развитие на нервната система, пластичност и обработка на информация. Тук ние описваме техника, базирана на дестабилизирана Cre рекомбиназа (DD-Cre), чиято активност се контролира от антибиотика, TMP. Ние показваме, че DD-Cre предизвиква бърза TMP-зависима рекомбинация на „флоксирани“ алели в миши неврони in vivo, и потвърждаваме използването на тази система за невроповеденчески изследвания.
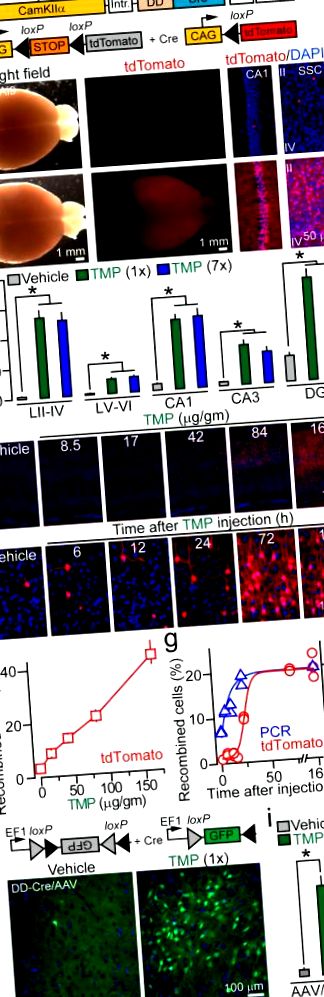
а, Схематично представяне на CamKIIα: алели на репортери DD-Cre и R26 Ai9 Cre.
б, Изображения на цели мозъци и DAPI оцветени участъци, изолирани от инжектирани с носител и TMP инжектирани DD-Cre/Ai9 мутанти. SSC = соматосензорна кора (слоеве II – IV).
24 и 48 часа след прилагане на лекарството, съответно (Фиг. 1д, g). Това забавяне в индукцията на tdTomato не е изненадващо, като се има предвид, че изисква синтез на протеин.
Локусът Rosa26 има спокойна хроматинова структура, която улеснява достъпа на Cre (това също вероятно допринася за наблюдавания фон), затова попитахме дали DD-Cre е способен да рекомбинира други ДНК субстрати. За тази цел инжектирахме аденоасоциирани вируси, кодиращи „флоксиран“ GFP репортер (AAV2.5 DIO-GFP) в корите на DD-Cre мишки. TMP силно задейства рекомбинация и в този случай, без видимо увеличение на плътността на GFP-позитивните неврони след повтарящи се медикаментозни лечения (Фиг. 1h, i и Допълнителна таблица 1). Също така открихме, че медикаментозната рекомбинация с минимален фон може да бъде постигната чрез коригиране на вирусните титри (допълнителна фигура 8).
За да се оцени приложимостта на DD-Cre за поведенчески изследвания, генерирахме щам на мишка, носещ DD-Cre и Cre-индуцируема форма на тетаничен токсин (TeNT), който инхибира освобождаването на невротрансмитер чрез разцепване на везикулярния SNARE протеин VAMP/Syb2 (R26 floxstop -TeNT, фиг. 2а) 18. Ние лекувахме DD-Cre/TeNT и техните контролни отпадъци с TMP и изследвахме мозъците им чрез имунооцветяване за TeNT, Syb2 и Zif268/Egr1, продукт на непосредствен ранен ген, чиято транскрипция се индуцира от синаптично възбуждане. Животните, инжектирани с наркотици, са намалили имунореактивността на Zif268/Egr1 и Syb2 (Фиг. 2b – e). Имуноблотирането разкрива, че започва разцепване на Syb2
6 часа след приложението на лекарството, отразяващо острата индукция на TeNT, медиирана от DD-Cre (Фиг. 2е, g). Електрофизиологичните записи от мозъчни срезове потвърждават TMP-зависима загуба на възбуждаща синаптична сила при DD-Cre/TeNT мишки (фиг. 2h и допълнителна таблица 2).
а, Схематично представяне на CamKIIα: алели DD-Cre и R26 floxstop-TeNT.
бъда, P30 мишки с посочени генотипове се инжектират или с носител, или с TMP (170 μg/gm) и се анализират 7 дни след третиране чрез имунооцветяване за Zif268/Egr1, TeNT и Syb2. б, Типичните изображения на коронални мозъчни сечения показват глобалния модел на експресия на Zif268/Egr1. c – e, Анализи на Zif268/Egr1 и Syb2 имунореактивност в SSC. Графиките представят усреднени интензитети на Zif268/Egr1 оцветяване на неврон (Vehicle срещу TMP, P Фиг. 3а и Допълнителна Фиг. 9 и Допълнителна Таблица 3). Въпреки това, администрирането на TMP върху мишки DD-Cre/TeNT премахна разпознаването и пространствената памет, което се доказва от липсата на интерес към нови обекти, загуба на предпочитание към целевите квадранти в теста на лабиринта Barnes и повишена честота на грешките, направени по време на обръщане тест. За разлика от тях, тези форми на памет са непокътнати в инжектирани с превозно средство DD-Cre/TeNT и TeNT, както и при лекувани с TMP щамове TeNT. (Фиг. 3b, c и Допълнителна Фиг. 9 и Допълнителна Таблица 3). Интересното е, че и четирите групи животни са имали нормална асоциативна памет (данните не са показани). Следователно нито TMP самостоятелно, нито конститутивната активност на DD-Cre в мозъка на DD-Cre/TeNT мишки влияе върху поведението в открито поле и придобиването/извличането на паметта, докато индуцируемата блокада на невротрансмисията пречи на специфични задачи на кората и хипокампа.
Мишките с посочени генотипове бяха тествани за двигателна активност и придобиване/извличане на памет. Животните са били третирани веднъж или с носител, или с TMP (170 μg/gm) 48 часа преди започване на поведенчески опити.
а, Общата хоризонтална локомоторна киселинност се оценява с фотоклеточни лъчи за 2 часа през интервали от 5 минути.
б и ° С, Тестове за разпознаване на нови обекти и тестове за пространствена памет. б, Среден брой контакти, инициирани от всяка група мишки със стари (O) и нови (N) обекти (O срещу N: TeNT + Vehicle, P = 0,035; TeNT + TMP, P = 0,038; DD-Cre/TeNT + Vehicle, P = 0,007; DD-Cre/TeNT + TMP, P = 0,94). ° С, Средни проценти от времето, прекарано в правилната цел (T) и други (O) квадранти в теста на лабиринта Barnes (DD-Cre/TeNT + TMP спрямо DD-Cre/TeNT + Vehicle, P = 0,026; DD-Cre/TeNT + TMP срещу TeNT + TMP, P = 0,019; DD-Cre/TeNT + TMP срещу TeNT + Vehicle, P = 0,024; DD-Cre/TeNT + Vehicle срещу TeNT + TMP, P = 0,9; DD-Cre/TeNT + Vehicle срещу TeNT + превозно средство, P = 0,98; TeNT + TMP спрямо TeNT + превозно средство, P = 0,92). Всички измервания са извършени с P60 животни (п = 7–9 мишки на група) и са представени като Средно ± S.E.M. Вижте също допълнителна фигура 9 и таблица 3 за допълнителни поведенчески данни.
Бързата кинетика, широкият динамичен обхват и липсата на откриваеми странични ефекти на TMP правят системата DD-Cre привлекателен инструмент за широк спектър от неврогенетични приложения. Временният контрол на DD-Cre in vivo е по-бърз от Cre-ERT2 и tTA/rtTA, които обикновено изискват повтаряща се експозиция на индуциращите лекарства 3,7,8,19,20. Силната дозова зависимост на DD-Cre от TMP също го прави идеален инструмент за едновременно смущение и маркиране на малки популации от клетки за изследване на клетъчно-автономни механизми. Подобно на други химико-генетични методи, DD-Cre може да проявява конститутивен произход. Въпреки че нашите анализи не показват поведенчески последици от такъв фон при възрастни DD-Cre/TeNT мишки и предполагат, че може да се постигне строга регулация на клетъчно ниво in vitro и in vivo, сила на промотора, профил на развитие на експресията на DD-Cre и чувствителност на неговите целите надолу по веригата трябва да се вземат предвид при проектирането на нови щамове на мишки.
Разгледани в по-широк обхват, нашите резултати предоставят рамка за бъдещо развитие на животински модели, носещи дестабилизирани протеини в специфични тъкани и клетъчни типове. Например, прикрепването на DD тагове към транскрипционни фактори, мембранни рецептори и сигнални молекули може да даде възможност за широк контрол върху различни протеинови функции и да улесни изследването на клетъчната диференциация и метаболизма. Освен това тези етикети могат потенциално да се използват в комбинация с други често срещани елементи като FLP и tTA/rtTA (за двоен фармакологичен контрол). Изпълненията на DD-P.O.I.s., Могат да бъдат повлияни от скоростта на разпадане, набирането на стабилизирани сливания, свързани с лиганд, до подходящи субклетъчни домейни и интерференция на DD маркерите с белтъчната функция. По този начин новите DD системи винаги трябва да бъдат валидирани в култивирани клетки, преди да се ангажират с експерименти in vivo.
ОНЛАЙН МЕТОДИ
Лентивирусни совалкови вектори и изследвания in vitro
Последователности, кодиращи DD-YFP, DD-Cre, Cre-ERT2, Cherry-H2B, GFP и floxstop-GFP, бяха субклонирани в лентивирусни совалкови вектори, съдържащи синтетичен невронален синапсинов промотор. KD + DD-Syb2 векторът се състои от H1 промотор, задвижващ фиби, специфични за мишки Syb2 (GTGCAGCCAAGCTCAAGCG), последвани от промотора Synapsin и DD-Syb2 спасителна cDNA последователност, съдържаща некодиращи мутации, които деактивират РНК интерференцията. Методи за приготвяне на невронални култури, производство на лентивирус и инфекция, имунооцветяване, имуноблотинг и електрофизиология са описани по-рано 17,21 .
Основен CamKIIα: Cre драйвер линия, R26 Ai9 Cre репортер и R26 floxstop-TeNT алел преди това са били характеризирани 18,22,23. За генериране на трансгенни щамове CamKIIα: DD-Cre, последователност, кодираща DD-Cre (допълнителна фигура 2), беше вмъкната надолу по веригата на 8 kb CamKIIα промотора в насочващ вектор, който също включваше 5 'и 3' интрони, фланкиращи cDNA и 3 „SV40 polyA сигнал. Насочената конструкция беше линеаризирана и използвана за пронуклеарно микроинжектиране в TSRI Mouse Genetics Core. Положителните основатели бяха идентифицирани чрез PCR със следните двойки праймери: GGCAATTGAGATCTACCATGATCTCTCTGATTGCCG CGCCGCTAGCTAATCGCCATCTTCCAGCAG; (1,3 kb продукт, специфичен за DHFR-Cre) и CTCCGTTTGCACTCAGGAGCAC/GCGCGGCGCGCCTCTCCTTTCCAGGATCTCAAAG (0,9 kb продукт, специфичен за CamKIIα промотор и ecDHFR). След това основателите се чифтосват с мишки, носещи алели Ai9 или R26 floxstop-TeNT (смесен фон C57/Bl6 и 129/sv) и тяхното потомство е генотипирано и използвано за експерименти.
Ин виво инжектиране на наркотици
Trimethoprim (Sigma, T7883) се разтваря в DMSO при концентрация на насищане от 100 mg/ml. Този разтвор се приготвя прясно за всеки експеримент и се разрежда в 0,9% физиологичен разтвор непосредствено преди инжектирането. Интра-перитонеалните (i.p.) инжекции се извършват с помощта на 29g игла за доставяне на дози TMP, вариращи между 8 и 170 μg/gm телесно тегло. Разтворът на носителя, съдържащ физиологичен разтвор и DMSO, се използва като контрола. Фармакокинетиката на TMP беше изследвана при мишки от див тип C57/BL6, използвайки in vitro биоанализ, основан на инхибиране на бактериалния растеж. TMP достига пикови концентрации в мозъчни екстракти от 1 μg/ml за 10 минути след еднократна инжекция (50 μg/gm). Максималните дневни дози TMP не надвишават 170 μg/gm, за да се избегне потенциален дистрес и утаяване на лекарството. Мутантните животни са анализирани в различни моменти от време след лечение с наркотици, както е посочено в легендите на фигурите. Тамоксифенът се разтваря в царевично масло (10 mg/ml) и се инжектира при 100 μg/gm телесно тегло.
Ин виво инжектиране на вирус
Концентрираните лентивируси се произвеждат в домашни условия. AAV2.5 DIO-GFP се генерира в векторното ядро на Salk, използвайки вектор на совалката, съставен от 1.26 kb EF1α промотор и обърната GFP последователност, фланкирана от две двойки loxP места. Вирусните титри се определят чрез PCR. Новородените малки се анестезират върху лед и се инжектират с 0,5 μl вирусен материал с помощта на стъклена микропипета (10 μm диаметър на върха). След това малките се затоплят за 1-2 минути под лампа с нажежаема жичка и се връщат в домашните клетки до експерименти.
Имунохистохимия
Мишките бяха анестезирани с изофлуоран и перфузирани с 4% PFA. Мозъците се инкубират за една нощ в 0,5% PFA и се нарязват в PBS с помощта на вибратом. Мозъчните срезове с дебелина 90 μm се сваряват за кратко в 0,1 М разтвор на цитрат за извличане на антиген и след това се поставят за 5 минути в цитратен буфер (40,5 ml 0,1 M натриев цитрат, 9,5 ml 0,1 M лимонена киселина, рН 6,0). След това секциите се измиват в PBS, блокират се за 3 часа в 4% BSA, 2% конски серум, 0,5% Triton и се инкубират цяла нощ с първични антитела, разредени в блокиращ разтвор, последвани от измивания в PBS и инкубация с DAPI и/или съответно флуоресцентно белязани вторични антитела.
Антитела
Моноклоналните анти-Syb2 (Cl69.1) и поликлоналните анти-Syt1 антитела са един вид подарък на д-р Томас Сюдхоф. Антитела срещу βTubulin, anti-Zif268/Egr1 и anti-SPO са закупени съответно от Sigma (Cat # T2200), Cell Signaling Technologies (Cat # 4153S) и Synaptic Systems (Cat # 102-002). Всички антитела се използват при разреждане 1: 1000 за имуноблотинг и имунохистохимия.
In situ хибридизация
Сонди за DD-Cre и tdTomato транскрипти бяха синтезирани с помощта на Roche RNA етикетиращ комплект, валидиран чрез електрофореза и секвениране и маркирани с FITC или DIG. Мозъчните срезове бяха приготвени, както е описано по-горе, и ацетилирани в буфера, съдържащ триетаноламин и оцетен анхидрид. След това срезовете бяха предварително хибридизирани при 65 ° С в буфера, съставен от 50% формамид, 5Х физиологичен разтвор-натриев цитрат, 5Х Денхардс, 250 μg/ml дрожди tRNA, 500 μg/ml херинга ДНК сперма, 50 μg/ml хепарин, 2.5mM EDTA, 0,1% Tween-20, 0,25% CHAPS, последвано от инкубация през нощта с денатурирани с топлина сонди, разредени в същия буфер. Маркираните секции се измиват в 0.2X SSC, уравновесяват се в 100mM Tris-HCl рН 7.5, 150mM NaCl и се блокират в 0.5% Perkin-Elmer блокиращ реагент в TN буфер. След това секциите се измиват с 0,05% Tween20, последвано от усилване на Tyramide (система Perkin-Elmer TSA Plus), и последователни обработки с анти-FITC-POD и FITC-Tyramide. След охлаждане на пероксидазната активност с 3% водороден пероксид, срезовете бяха обработени с анти-DIG-POD (1: 500), измити и монтирани за анализ.
Придобиване на изображения и анализ на данни
Изображенията бяха събрани под конфокален микроскоп Nikon C2, използвайки 10 ×, 20 × и 60 × маслени обективни потопяеми обективи. Цифровите изображения първоначално се обработват със софтуерния пакет Nikon Elements. Цифровите манипулации бяха приложени еднакво към всички пиксели. Плътността на репортер-положителните неврони се изчислява автоматично с помощта на софтуера Metamorph. Извършени са триизмерни реконструкции на GC, показани на допълнителна фигура 7 с пакета Neurolucida.
Геномна ДНК беше изолирана от корите на DD-Cre/TeNT мишки в различни времеви точки след инжектиране на TMP и анализирана чрез PCR със следните двойки праймери, специфични за рекомбинирания алел: CGTGCTGGTTATTGTGCTGTCTCATC/CCTCGGCGCGGTCTTGTAGTTGCC.
Електрофизиология
Анестезираните мишки бяха обезглавени в безкислороден Ca2+ разтвор на aCSF, съставен от 124mM NaCl, 2mM KCl, 1.25mM KH2PO4, 2mM MgSO4, 26mM NaHCO3, 10mM декстроза, pH7.4. 400 μm мозъчни секции бяха приготвени с помощта на вибратом. Резените бяха прехвърлени в aCSF, съдържащ 2mM Са 2+ и оставени да се възстановят за 1 час при 30 ° С преди записите. Възбуждащите потенциали на полето се наблюдават от гранулирани клетки DG, като се използва стъклен електрод, напълнен с 2M NaCl (
3MΩ). Синаптичните отговори се предизвикват от извънклетъчен електрод (концентричен биполярен електрод, FHC), поставен в близост до перфорантен път и записан в присъствието на 20 μm габазин. Данните бяха извадени с усилвател Multiclamp700B и анализирани офлайн, използвайки софтуерни пакети Clampfit10 и Origin8.
- Осъществяване на контрола на теглото на втората природа, която живее тънка естествено
- Lelinta - Компресионен потник за жени с контрол на корема
- Генна терапия с лептин; може да е по-добре от диета; за отслабване
- Осигуряване на място за палачинки във вашата диета - Съвет за контрол на калориите
- Хляб за контрол на теглото от Лайпурин - шрифтове в употреба