Лидия Линч
1 Хематология/онкология, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
2 Образователен изследователски център, Университетска болница „Сейнт Винсент“, Дъблин, Ирландия
6 Училище по биохимия и имунология и училище по здравни науки, Тринити Колидж, Дъблин, Ирландия
Майкъл Новак
1 Хематология/онкология, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Бинду варгезе
1 Хематология/онкология, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Джъстис Кларк
1 Хематология/онкология, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Андрю Е. Хоган
2 Образователен изследователски център, Университетска болница „Сейнт Винсент“, Дъблин, Ирландия
Василис Токсавидис
1 Хематология/онкология, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Стивън П. Балк
1 Хематология/онкология, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Донал О’Шей
3 Катедра по ендокринология, Университетска болница „Сейнт Винсент“, Дъблин, Ирландия
4 Институт Конуей, Университетски колеж Дъблин, Ирландия
Клиона О’Фаррели
6 Училище по биохимия и имунология и училище по здравни науки, Тринити Колидж, Дъблин, Ирландия
Марк А. Ексли
1 Хематология/онкология, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Свързани данни
Обобщение
Неизменните клетки на Natural Killer T (iNKT) са еволюционно запазени вродени Т клетки, които влияят на възпалителните реакции. Ние показахме, че iNKT клетките, за които по-рано се смяташе, че са рядкост при хуман, са силно обогатени в човешка и миша мастна тъкан и че с увеличаване на мастната тъкан при затлъстяване, iNKT клетките са изчерпани, корелирайки с провъзпалителната инфилтрация на макрофаги. iNKT клетъчните номера бяха възстановени при мишки и хора след загуба на тегло. Мишките, които нямат iNKT клетки, са имали повишено наддаване на тегло, по-големи адипоцити, мастен черен дроб и инсулинова резистентност при диета с високо съдържание на мазнини. Адоптивен трансфер на iNKT клетки в затлъстели мишки или in vivo активиране на iNKT клетки с техния липиден лиганд алфа-галактоцилцерамид намалява телесните мазнини, триглицеридите, лептина, мастния черен дроб и подобрява инсулиновата чувствителност чрез Th2 клетъчен тип производство на цитокини от iNKT клетки, получени от мастна тъкан . Това откритие подчертава потенциала на iNKT терапиите, насочени към клетките, за които преди е доказано, че са безопасни при хората, при лечението на затлъстяването и неговите последици.
Въведение
Откритието, че TNFα е повишен при затлъстяване и корелира с инсулиновата резистентност, е основна находка, която стартира полето на възпалението и имунометаболизма през 1993 г. (Hotamisligil et al., 1993). Понастоящем се приема, че възпалението, особено в самата мастна тъкан (Hotamisligil, 2006; Hotamisligil et al., 1993; Nishimura et al., 2008; Shoelson et al., 2006), е критично свързано със затлъстяването и съпътстващите го метаболитни нарушения, включително нарушен глюкозен толеранс, инсулинова резистентност, чернодробна стеатоза, дислипидемия и в крайна сметка диабет тип 2 (Reaven, 1988). Мастната тъкан е имунологично динамична, с резидентни CD4 + (Winer et al., 2009) и CD8 + Т клетки (Nishimura et al., 2009), Т регулаторни (Treg) клетки (Feuerer et al., 2009), В клетки ( Winer et al., 2011) и макрофаги (Lumeng et al., 2007; Weisberg et al., 2003; Wentworth et al., 2010), за които е доказано, че играят положителни или отрицателни роли в метаболитната дисрегулация и развитието на затлъстяването (Feuerer et al., 2009; Lumeng et al., 2007; Nishimura et al., 2009; Wentworth et al., 2010; Winer et al., 2011; Winer et al., 2009).
Резултати
iNKT клетките се изчерпват в мазнините и черния дроб по време на развитието на затлъстяване
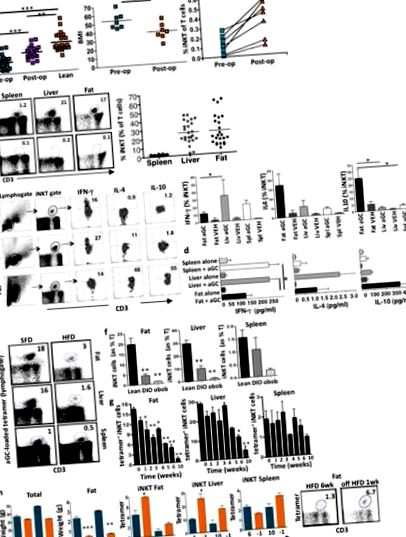
По-рано показахме, че iNKT клетките са обогатени с човешки мазнини, но са изчерпани при затлъстяване (Lynch et al., 2009). Тъй като не беше възможно да се получи мастна тъкан от пациенти в множество времеви точки след бариатрична хирургия, ние разгледахме човешката периферна кръв и установихме, че iNKT клетките също са намалени в циркулацията на пациентите със затлъстяване в сравнение със слабите здрави контроли, съобразени с възрастта (Фиг. 1а). Анализът на напречното сечение установи, че броят на циркулиращите iNKT клетки е увеличен при пациенти със затлъстяване, които са загубили тегло след операция на стомашен байпас на Roux-en-Y (RYGB), в сравнение с пациенти със затлъстяване преди операция RYGB, въпреки че iNKT клетките все още са намалени в сравнение с постните контроли (фиг. 1а). След това проследихме група пациенти (n = 7) надлъжно преди и след RYGB операция, чийто индекс на телесна маса (ИТМ) намаля от затлъстяване степен III (среден ИТМ> 50 kg/m 2) до затлъстяване степен II (среден ИТМ 35–40 kg/m 2) 18 месеца след операцията (фиг. 1а). Броят на периферните iNKT клетки се увеличава при всеки пациент след загуба на тегло. (Фиг. 1а).
HFD е заменен със стандартна мастна диета (SFD) за една седмица след 6 седмици или 10 седмици, което е причинило само лек спад в общото тегло, но драстично намаляване на теглото на мастната тъкан (фиг. 1h). След преминаване към SFD след 6 седмици HFD, се наблюдава значително увеличение на iNKT клетките в мазнините и черния дроб; Нивата на iNKT също започнаха да се увеличават след преминаване към SFD след 10 седмици HFD (фиг. 1h). Тези открития показват, че мишият и човешкият iNKT отговор на затлъстяване и загуба на тегло е сходен.
Принос на iNKT клетки за развитието на затлъстяване
След това изследвахме хипотезата, че iNKT клетките могат да предпазват от затлъстяване и свързаните с това метаболитни последици. Мишки с дефицит на Jα18, които нямат iNKT клетки, но имат иначе нормална имунна система, се хранят с HFD заедно с тегловни мишки, съответстващи на възрастта, върху HFD или SFD. Мишките с дефицит на Jα18 бяха значително по-големи преди HFD предизвикателство. Те също така наддават значително повече тегло от теглото на мишките с HFD и имат значително по-големи мазнини, докато чистата маса е непроменена (фиг. 2а) Приемът на храна е подобен между мишки с дефицит на Jα18 и тегло с мишки (фиг. 2б). Адипоцитите са по-големи при Jα18-дефицитни мишки в сравнение с теглото на HFD (Фиг. 2в, d). Освен това, мишките с дефицит на Jα18 върху HFD са имали по-високо отлагане на мазнини в черния дроб (фиг. 2д), повишена кръвна глюкоза на гладно, нарушен GTT и повишена инсулинова резистентност в сравнение с теглото при HFD (фиг. 2е). Концентрациите на серумен лептин са еквивалентни при wt и Jα18-дефицитни мишки на HFD в сравнение със SFD (фиг. 2g).
iNKT броя на клетките корелират обратно с инфилтрацията на макрофаги в мастната тъкан
iNKT клетките могат да набират и регулират други имунни клетки (Cerundolo et al., 2009). Изследвахме влиянието на получените от мастна среда iNKT клетки върху инфилтрацията и активирането на макрофагите. Както се очаква, провъзпалителните макрофаги (F4/80 + CD11c +) се увеличават в мастната тъкан по време на развитието на затлъстяване, като значително увеличение се забелязва още 1 седмица в HFD. След прекратяване на HFD в продължение на 1 седмица, провъзпалителните макрофаги значително намаляват в мазнините (Фиг. 3а). Открихме силна обратна корелация между нивата на iNKT клетки в мазнини и провоспалителни макрофаги (Фиг. 3а).
Мишки, които нямат iNKT клетки, показват метаболитно разстройство на SFD
Както Jα18-дефицитните, така и Cd1d1 -/- мишките имат напълно нормална имунна система без патологична чувствителност, освен ако не са предизвикани с определени патогени или тумори. Проучихме дали има доказателства за метаболитен синдром при Jα18-дефицитни и Cd1d1 -/- мишки, хранени ad lib в продължение на 4-5 месеца на SFD. Както мишките с дефицит на Jα18, така и мишките Cd1d1 -/- постоянно претеглят повече (фиг. 4а) и имат по-големи адипоцити върху SFD в сравнение с мишки с тегло на възраст (фиг. 4b). Макрофагите на мастната тъкан са значително увеличени както при iNKT-дефицитни, но имат сходни проинфламаторни (не са показани) и противовъзпалителни фенотипове във всяка група на SFD (фиг. 4в). В съответствие с тези открития, мишките с дефицит на Jα18 и Cd1d1 -/- имат значително повишени серумни триглицериди, концентрации на TNFα и донякъде повишени концентрации на IL-6 (фиг. 4d). Мишки с дефицит на Jα18 и мишки Cd1d1 -/- на SFD са имали повишена глюкоза на гладно и GTT е леко нарушена при мишки Cd1d1 -/-, въпреки че тези разлики не са значителни (Фиг. 4д).
При хората, клетъчните нива на iNKT корелират отрицателно с наддаването на тегло (Lynch et al., 2009). След връщане към SFD при мишки или загуба на тегло при хора, нивата на iNKT се повишават, демонстрирайки обратимост на iNKT клетъчни дефекти. По същия начин, въпреки тежките числени дефекти, намаленият клетъчен фонд на iNKT при затлъстяване при мишки все още е способен на значително разширяване и производство на противовъзпалителни цитокини, което води до драматично положителни ефекти върху адипоцитите и метаболизма. Предстои да се определи дали лечението, което увеличава или активира iNKT клетките, ще има благоприятни ефекти при хора с метаболитен синдром. Използването на αGC за активиране на iNKT клетки при хора се използва в множество ракови условия. Доказано е, че е безопасно, без съобщения за хепатотоксичност, за разлика от мишки, при които повтарящите се по-високи дози при по-възрастни животни могат да причинят хепатотоксичност (Exley et al., 2011). Наблюдението, че насочването на клетъчната система iNKT с αGC при мишки не е причинило хипогликемия в диабетичния или евгликемичния модел, предполага възстановяване на физиологичния баланс. Това е потенциално много привлекателно от терапевтична гледна точка.
Понастоящем имуно-метаболитното взаимодействие при затлъстяване се утвърждава като ключов фактор за възпаление на мастната тъкан и последващо развитие на диабет тип 2. Той също така съдържа вълнуващи възможности при разработването на нова терапевтична парадигма за това разстройство, което в момента е с епидемични размери. Нашето проучване подкрепя нововъзникващото мнение, че Т клетките и макрофагите играят важна роля във функцията на мастната тъкан и идентифицира iNKT клетките като основна регулаторна популация на Т клетки в мазнините. Допълнителни проучвания, изследващи терапевтичния потенциал на iNKT клетките при затлъстяване и метаболитен синдром, са оправдани.
Експериментални процедури
Мъжки (и където е посочено, женски) с тегло C57BL/6 и ob/ob мишки са закупени от Jackson Laboratories (Bar Harbor, ME). Описани са мишки с дефицит на Jα18 и мишки C57BL/6J CD1d1 -/- (Exley et al., 2003). Jα18-дефицитни (F9) и CD1d1 -/- (F12) бяха обратно кръстосани на фона на C57BL/6. Мишките бяха приютени в съседство от раждането и хранени със същата чау (SFD или HFD). Като цяло експериментите започнаха с мъжки мишки на шест седмици. За метаболитни проучвания мишките са получавали или SFD, или HFD (изследователски диети, 60 kcal% мазнини за HFD), на възраст от 6 седмици в продължение на 6 седмици или 12 седмици, когато е посочено. Мишките бяха настанени при специфични условия, свободни от патогени. Експериментите с животни бяха извършени в съответствие с протоколи, одобрени от Институционалния комитет за грижа и употреба на животните.
Субекти
10 ml периферна кръв са получени от 26 последователни пациенти със затлъстяване, които са били насочени към нашата клиника за управление на теглото в средата на болницата (средна възраст 47, диапазон 24–60 години; среден ИТМ 48), и 18 пациенти, посещаващи клиниката за контрол на теглото 18 месеца след бариатрична хирургия (средна възраст 46, диапазон 36-54 години; среден ИТМ 38) и 22 постно здрави контроли (средна възраст 39, диапазон 23-54 години; среден ИТМ 24). Всички кръвни проби са получени с писмено информирано съгласие. Комитетът по етика в Университетската болница Сейнт Винсент, Дъблин, одобри това проучване.
Реактиви
αGC аналогови PBS-57 заредени или празни CD1d тетрамери са предоставени от NIH тетрамерното съоръжение (Emory Vaccine Center, Atlanta, GA). αGC (7000 KRN) беше любезно предоставен от Kirin Ltd, Япония. Имунните клетки се култивират в RPMI-1640, получени от мастна тъкан клетки в модифицираната орел среда на Dulbecco (DMEM), допълнени с пеницилин, стрептомицин (Mediatech, Manassas, VA) и 5% FBS (Hyclone, Logan, UT).
Диета и метаболитни изследвания
Wt, Jα18-дефицитни и CD1d1 -/- се претеглят ежеседмично и приемът на храна се проследява с HFD. Съдържанието на телесни мазнини се измерва чрез рентгеново излъчване на DEXA сканиране, извършено след умъртвяване на мишки. Цели коремни мастни мастни накладки бяха претеглени след дисекция на тестисите и лимфните възли. След 6 седмици на HFD бяха измервани кръвната глюкоза на гладно (OneTouch Ultra) и концентрациите на инсулин (Crystal Chem ELISA). За тестове за толерантност към глюкоза, гладни (10 часа) мишки получават 1 g глюкоза на kg телесно тегло интраперитонеално (i.p) и нивата на глюкоза се измерват на всеки 15 минути в продължение на 90 минути. За инсулинова резистентност е използван хомеостазен модел за оценка на инсулиновата резистентност (HOMA-IR) (Matthews et al., 1985): кръвна захар на гладно х инсулин на гладно/22,5. Две проби от 5 mm черен дроб бяха събрани и фиксирани във формалин за една нощ, преди монтиране на парафин и приготвяне на H&E или OIL Red O оцветени предметни стъкла за измерване на мастен черен дроб. За H&E и Oil Red O оцветяване, биопсиите бяха разгледани с помощта на 20-кратна цел. Степента на затлъстяване на черния дроб се измерва чрез интензивност на оцветяване с Oil Red O около 5 области на порталния тракт на предмет.
Размер на адипоцитите
Размерът и броят на адипоцитите се измерват чрез осмий и имунохистохимия. Две проби от 20–30 mg мастна тъкан на мишка веднага се фиксират в осмиев тетроксид (3% разтвор в колидин 0,05 М), смилат се на парчета от 1 mm и се инкубират на тъмно при стайна температура в продължение на 48 часа. Размерът и броят на мастните клетки се определят от Beckman Coulter Multisizer III с апертура 400 μm. Мастната тъкан също беше фиксирана във формалин за една нощ, преди монтирането на парафин и подготовката на H&E диапозитиви. Броят на адипоцитите се отчита на всяко зрително поле, в десет полета на проба и се връща към първоначалното тегло на всяка мастна подложка.
Далак, черен дроб и мастна тъкан и препарати от човешка кръв
Проточна цитометрия
Едноклетъчни суспензии на спленоцити, LMNCs и мастни SVF бяха блокирани с anti-CD16/32 mAb и оцветени в продължение на 30 минути при 4 ° C на тъмно с PBS-57 натоварен или празен CD1d тетрамер-PE (NIH тетрамерно съоръжение) и CD3 (1: 150 разтвор, eBiosciences). Макрофагите са белязани с конюгирано с фикоеритрин антитяло към F4/80 (1 на 100) и CD11c (1 в 200) и CD206 (1 на 200), за да се разграничат М1 от М2 макрофаги в SVF, както е описано по-рано (Fujisaka et al., 2009) . За човешка периферна кръв бяха използвани миши анти-човешки CD3, комбинирани с iNKT TCR (6B11) и контролирани от изотип контроли (BD Biosciences). iNKT клетките също бяха оцветени с Vα24 и Vβ11 TCR вериги от Coulter Immunotech (Марсилия, Франция). Клетките се измиват и фиксират в 1% PFA и се придобиват на поточен цитометър LSR II (BD Bioscience) и със софтуер FlowJo и Kaluza.
iNKT клетъчна изолация и осиновителен трансфер
Чернодробните мононуклеарни клетки се оцветяват с CD1d тетрамер-РЕ и се сортират до> 95% чистота, използвайки FacsAriaII (Becton Dickinson, СА). Пречистени iNKT клетки (5 × 105) се инжектират i.p. в мишки с дефицит на Jα18, които са били на HFD в продължение на 8 седмици. Метаболитните параметри се анализират след 4 дни, мишките се умъртвяват, мастната тъкан се претегля и адипоцитите се измерват чрез осмий и имунохистохимия.
In vivo стимулация на iNKT клетки и вътреклетъчно оцветяване на цитокини
Мишките се инжектират i.p. с 2 μg αGG или само носител и мишките се умъртвяват след 5 часа или 4 дни, по време на метаболитния анализ. Едноклетъчна суспензия на спленоцити, чернодробни мононуклеарни клетки и стромоваскуларни фракции на мастната тъкан (SVF) бяха получени както преди, но с включването на Brefeldin A във всички среди. Първо, едноклетъчни суспензии на спленоцити или чернодробни мононуклеарни клетки бяха оцветени с клетъчна повърхност, маркираща анти-CD3 mAb и αGC-натоварен CD1d тетрамер. След това клетките бяха фиксирани, пермеабилизирани и оцветени вътреклетъчно за IL-4, IL-10 и IFN-γ бяха проведени с помощта на Cytofix/cytoperm (BD Biosciences), съгласно инструкциите на производителя. За неутрализиране на цитокини преди лечение с αGC, се инжектират анти-IL-4 (11B11) или анти-IL-10 (JES5-2A5) i.p. преди инжектиране на αGC.
статистически анализи
Лентите за грешки представляват стандартната грешка на средната стойност. Статистическата значимост на разликите между две групи беше определена с помощта на t-тестове на Mann-Whitney или Student, където е подходящо, след определяне на разпределението на Гаус на данните. Различията между групите мишки (> 2) бяха оценени с помощта на еднопосочен или двупосочен ANOVA, последван от post hoc тестове на Tukey. Стойности на p (3.6M, pdf)
Благодарности
Благодарим на проф. Б. Кан, д-р Одил Перони и Метаболитната физиология, Бостън за съдействието при изобразяване на DEXA и измерване на адипоцити. Благодарим на проф. Гокхан Хотамисгигил от Харвардското училище за обществено здраве, проф. Улрих фон Андриан от Харвардското медицинско училище за ползотворни дискусии и проф. Майкъл Бренер за любезното съдействие и обсъждане на този манускрипт. Благодарим на д-р F. Scheuplein и г-жа S. Jordan за грижата за мишката. Също така благодарим на BIDMC Core Cytometry Core, особено на John Tigges, и BIDMC Histology Core, особено на г-жа S. White и д-р LH. Анг. Това проучване беше подкрепено от NIH R01 DK066917, U19> AI066313 (MAE), US DOD W81XWH-09-1-0156 (SPB), ЮНЕСКО-L'Oreal Fellowship (LL), Европейската комисия Мария Кюри стипендия (LL), Science Foundation Ирландия (CO'F) и Съветът за здравни изследвания, Ирландия (LL, AEH, DOS). Д-р. Балк и Ексли имат консултантски отношения с NKT Therapeutics Inc.
Бележки под линия
Останалите автори нямат противоречащи си финансови интереси.
Отказ от отговорност на издателя: Това е PDF файл на нередактиран ръкопис, който е приет за публикуване. Като услуга за нашите клиенти ние предоставяме тази ранна версия на ръкописа. Ръкописът ще бъде подложен на редактиране, набиране и преглед на полученото доказателство, преди да бъде публикуван в окончателния си вид. Моля, обърнете внимание, че по време на производствения процес могат да бъдат открити грешки, които биха могли да повлияят на съдържанието, и всички правни откази от отговорност, които се отнасят до списанието, се отнасят до.
- Берберис при лечение на затлъстяване и метаболитен синдром възможни механизми на действие
- Прекъсване на порочния кръг на затлъстяването чрез метаболитен синдром и нисък тестостерон
- Бета-адренергичните рецептори са критични за загуба на тегло, но не и за други метаболитни адаптации към
- Дали мастните клетки са завинаги The New York Times
- 10 най-добри хомеопатични лекарства за затлъстяване, наднормено тегло и отслабване