Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Институт по молекулярна физиология на растенията Макс Планк, Am Mühlenberg 1, Потсдам, 14476, Германия
Обобщение
Въведение
С тяхната видна роля в метаболитните пътища, анализът на мастните киселини представлява основен интерес в метаболомиката. В момента в растителната наука липидните молекули рутинно се измерват и количествено определят с помощта на течна хроматография мас спектрометрия (LC-MS; Welti и Wang, 2004; Markham и Jaworski, 2007; Giavalisco и др., 2011; Hummel и др., 2011), докато съдържанието на мастни киселини (FA) и дори съдържанието на отделните FA обикновено се извършват чрез масова спектрометрия с газова хроматография (GC-MS) или откриване на йонизация на пламък с газова хроматография (GC-FID; Li-Beisson и др., 2013 ). За да се превърнат FA в аналити, методите на GC изискват дериватизация (например метил естрификация или силилиране), за да се образуват летливи FA производни. От друга страна методите LC-MS не се нуждаят от дериватизация, което дава известно предимство на този подход за анализ.
Тук представяме метод за анализ на FA с помощта на LC-MS-базиран метод. Демонстрирахме, че FA могат да бъдат точно коментирани от автентични стандарти и базирани на маса анотации на пикове на FA. Анотацията е подкрепена с използване на 13 C напълно маркирани екстракти от листа на Arabidopsis. Второ, извършихме LC-MS и GC-FID-базирани FA профилиране на листа и семена на два мутанта на Arabidopsis desaturase, прищявка6 и прищявка7. Нашите GC ‐ FID резултати бяха сравними с тези, докладвани по-рано (Преглед и др., 1986, 1989). Подобните резултати, получени от LC-MS, показват, че предложеният от нас метод може да се използва за измерване на FA. Нещо повече, той подчерта разликите в профилите на FA, за които не се съобщаваше по-рано, и по този начин демонстрира високата чувствителност и широкото покритие на безпристрастното профилиране, основано на LC-MS. Методът е продължение на вече докладвана процедура за анализ на липиди (Giavalisco и др., 2011). Когато се комбинират, те позволяват FA и липидно профилиране на една и съща проба. Тази характеристика е илюстрирана с липидни профили на двата десатуразни мутанти и се обсъжда, като се вземат предвид съответните FA профили.
Едно от основните предимства на подходите, базирани на МС, е потенциалното откриване на нови или нетипични ФА поради нецелевия характер на откриването. Тук изследвахме разнообразието от диатомови киселини в FA. Профилирахме Thalassiosira pseudonana и Biddulphia biddulphiana, за които открихме изключителен набор от FA.
Резултати и дискусия
13 С изотопното маркиране дава възможност за анотиране на мастните киселини
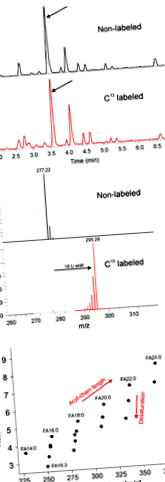
Преди това прилагахме метода на липидно профилиране, използвайки LC-MS-базиран подход към растения и водорасли (Giavalisco и др., 2011; Бром и др., 2013 ). Тук е описано разширение на метода, което позволява анализ на липиди и FAs от една проба, като се използва една LC-MS настройка, както и един стандартен протокол. За тази цел извлечените липиди се хидролизират (както е описано в раздел 4) и се подлагат на LC-MS анализ. За да се подпомогне анотирането, проби, получени от растения Arabidopsis, отглеждани в присъствието на атмосферни 12 CO2 се сравняват с проби, отглеждани в присъствието на 13 CO2. Това позволява директното извеждане на броя на въглеродните атоми в аналита (Фигура 1а). Както е показано на Фигура 1b, наблюдаваме положителна връзка между времето на задържане и дължината на FA, както и връзка между степента на насищане и времето на задържане. По-нататъшно валидиране на анотацията въз основа на трите критерия, споменати по-горе, беше извършено при използване на търговски налични стандарти FA (вж. Таблица S1). Общо 20 различни FA бяха отбелязани, някои от тях не са докладвани преди това в Arabidopsis (Фигура 3; Devaiah и др., 2007; Li ‐ Beisson и др., 2013 ).
Химическо валидиране на метода.
а) Примерни хроматограми и промяната в м/z за наблюдаваните йони в екстракти от 13 маркирани с С растения.
(б) Разпределението на наблюдаваното м/z стойности и времето на задържане на аналитите.
Сравнение на LC-MS и GC-FID с използване на екстракти от листа и семена на два дезатуразни мутантни мутанта
Два EMS десатуразни мутанти, прищявка6 и прищявка7, преди това са анализирани с помощта на GC-FID (Преглед и др., 1986, 1989). FAD6 ензимът е локализиран на хлоропласт ω ‐ 6 FA десатураза, който е отговорен за синтеза на FA16: 2 и FA18: 2 FAs, свързани в галактолипиди, сулфолипиди и фосфолипиди. FAD7 е хлоропластична ω-3 десатураза, която въвежда трета двойна връзка в ацилни вериги на свързвани с липиди FAs, като се получават FA16: 3 и FA18: 3. За да проверим валидността на аналитичната процедура, анализирахме прищявка6 (SALK_118972) и прищявка7 (SALK_049635) хомозиготни линии за вмъкване на Т-ДНК на Arabidopsis за техния FA състав. Използвахме както класическите GC-FID, така и LC-MS методите, както е описано по-долу.
Сравнение на FA състава на двете EMS линии (Преглед и др., 1986, 1989) и съответните мутанти на SALK показват, че нашите GC-FID-базирани резултати са в съгласие с публикуваните по-рано данни (Фигура 2а, б).
Сравнение на профилите на мастните киселини с помощта на GC-FID.
(а) График на нивата на мастните киселини на SALK прищявка6 мутантни листа в сравнение с профилите на мастните киселини на EMS прищявка6 мутант, описан от Преглед и др. (1989). Пръчките представляват средните стойности и стандартните отклонения.
(b) Графика на нивата на мастните киселини в SALK прищявка7 мутантни листа в сравнение с два профила на мастни киселини на EMS прищявка7 мутант, отглеждан при различни температури, както е описано от Browse и др. (1986). За целите на сравнението, литературни стойности за FA16: 1‐цис и FA16: 1‐транс бяха обединени.
Листни и семенни мастни киселини (FA) профили на SALK прищявка6 и прищявка7 мутанти, използващи GC-FID и LC-MS. Топлинните карти представляват log2-трансформирани съотношения на FA нива в мутанта в сравнение с дивия тип.
Екстракти от листа (а) и екстракти от семена (б) бяха измерени с LC-MS и с GC-FID. В резултатите на GC-FID FA16: 1 (общо) представлява обединените изомери на тази киселина. Сивите области представляват измервания под нивото на откриване. Аналитите, открити, но количествено определяне под нива, са маркирани като „следа“. Звездичките отбелязват резултатите от теста за честна значителна разлика на Tukey: *P
Както при прищявка6 мутант, GC-FID измерванията на SALK прищявка7 FA са съгласни с предишни измервания на EMS мутанта на този ген (Преглед и др., 1986). Чрез LC-MS анализ наблюдаваме натрупването на прекурсори (FA16: 2 и FA18: 2) и намаляването на FAs на продукта в прищявка7 листа. Освен това наблюдаваме увеличение с повече от 50% от нивото FA20: 2 в листата на прищявка7. Мутацията в този ген също оказва влияние върху FA профила на прищявка7 семена (Фигура 3Б). Както в листата, това води до натрупване на субстрата FA16: 2 (10-кратно увеличение) и до изчерпване на продукта FA16: 3 (седемкратно намаляване). Освен това наблюдаваме леко натрупване и на трите изомера FA16: 1 в екстракти от тези семена (Фигура S2). И накрая, прищявка7 мутация доведе до натрупване на FA18: 0, FA18: 1 и FA18: 2.
В листа от прищявка7 липсата на хлоропластичната ω ‐ 6 десатураза води до натрупване на MGDG34/36: 4 и MGDG34/36: 5 и до приблизително двукратно намаляване на MGDG34: 6, което става второто най-разпространено MGDG след MGDG34: 5. Подобни промени се наблюдават в класовете на липиди DGDG и SQDG в прищявка7. Това в съгласие с 20% намалено съдържание на общия лист FA18: 3 и натрупването на неговия субстрат, FA18: 2, в този мутант (Фигура 3). Сравними промени в общите количества на тези FA, както и FA, включени в пластидни липиди, са докладвани по-рано от Browse и др. (1986).
Нецелево профилиране на мастни киселини на два вида диатомови видове
Разпределение на откритите мастни киселини и сравнение на съдържанието на основни мастни киселини в диатомовите киселини Thalassiosira pseudonana и Biddulphia biddulphiana.
(а) Мастните киселини, открити в екстрактите от диатомови киселини, се нанасят в съответствие с техните м/z стойности и времена на задържане. Наслоените символи представляват мастни киселини, открити и в двата вида.
(б) График от четири основни мастни киселини и при двата вида. Баровете представляват среден процент от общите открити мастни киселини, а лентите за грешки означават стандартно отклонениен = 5).
Заключение
Експериментални процедури
Нокаутни мутантни линии: селекция, генотипизиране и условия на растеж
Екстракция на липиди и мастни киселини
LC-MS анализ
За липидно профилиране се извършва LC-MS анализ със същата настройка, както е описано по-горе за FA профилиране, като се използват както положителни, така и отрицателни режими на йонизация. Обработката на хроматограмите, откриването на върхове и интегрирането бяха извършени с помощта на рафинер ms 7.5. Обработката на данните за масова спектрометрия включва премахване на информацията за фрагментацията и изотопните пикове, както и химическия шум. Получените характеристики (м/z при определено време на задържане) са били запитвани срещу вътрешна база данни за липиди за допълнителни анотации. Останалите неизвестни функции бяха кръстосано проверени с друга онлайн база данни с помощта на инструмента за търсене на база данни GoBioSpace. Подробните процедури за липидно профилиране са описани в Giavalisco и др. (2011).
GC-FID анализ
За GC-FID анализ FA екстрактите се сушат в поток от N2 в стъклени епруветки с тефлонови винтови капачки. Изсушеният материал се суспендира отново в 1 ml 1 N разтвор на НС1/метанол (Sigma-Aldrich). Вътрешен стандарт (100 μl FA15: 0, пентадеканова киселина) се добавя към всяка проба преди инкубация при 80 ° С на водна баня за 30 минути. След охлаждане до стайна температура към всеки флакон се добавят 1 ml 0.9% NaCl и 1 ml 100% хексан. Флаконите се разклащат за 5 s и се центрофугират за 4 минути при 21000 ж. Горната FAME-съдържаща хексанова фаза се прехвърля в нов стъклен флакон, където се концентрира в поток от N2. Накрая, FAME се разтварят в хексан и се пълнят в GC стъклени флакони. Подробностите за метода GC-FID са както следва: температура на инжектора 250 ° C; газ хелий носител; налягане в главата 25 cm s -1 (11,8 psi); GC колона, J&W DB23 (Agilent, http://www.agilent.com), 30 m × 0,25 mm × 0,25 μm; температура на детектора 250 ° C; детектор газ H2 40 ml min -1, въздух 450 ml min -1, Той допълващ газ 30 ml min -1 .
Благодарности
Благодарим на Aenne Eckardt за помощта при измерванията на LC-MS и Ina Krahnert за помощта при измерванията на GC-FID. Обществото на Макс Планк е признато за финансова подкрепа. Авторите нямат конфликт на интереси за деклариране.
| tpj12739-sup-0001-FigS1.tifimage/tif, 884,3 KB | Фигура S1. Графика на съдържанието на мастни киселини в листата на Arabidopsis, измерена с LC-MS. |
| tpj12739-sup-0002-FigS2.tifimage/tif, 840,5 KB | Фигура S2. График на съдържанието на мастни киселини в семената на Arabidopsis, измерено с LC-MS. |
| tpj12739-sup-0003-FigS3.tifimage/tif, 2,3 MB | Фигура S3. Бар участък от липиди в листата на прищявка6 и Col-0, измерени с LC-MS. |
| tpj12739-sup-0004-FigS4.tifimage/tif, 2,3 MB | Фигура S4. Бар участък от липиди в листата на прищявка7 и Col-0, измерени с LC-MS. |
| tpj12739-sup-0005-TableS1.docДокументен документ, 50 KB | Таблица S1. Таблица с мастни киселини, открити в Arabidopsis с LC-MS. |
| tpj12739-sup-0006-TableS2.docWord документ, 92,5 KB | Таблица S2. Таблица на мастните киселини, открити при два вида диатомове с LC-MS. |
| tpj12739-sup-0007-legends.docx Документ на Word, 14,3 KB |
Моля, обърнете внимание: Издателят не носи отговорност за съдържанието или функционалността на която и да е поддържаща информация, предоставена от авторите. Всички заявки (различни от липсващо съдържание) трябва да бъдат насочени към съответния автор на статията.
- Течни калории - как пиенето въздейства върху наддаването на тегло Наука на живо
- Преглед на течен хлорофил (АКТУАЛИЗАЦИЯ 2020); 8 неща, които трябва да знаете
- Течен кестен за отслабване реални отзиви, инструкции за употреба, противопоказания, цена
- Течен кленбутерол - виден стимулант за отслабване; Информативни факти
- Течната сол може да намали усвояването на мазнините и теглото при плъхове; Харвардски вестник