Масару Сагай
1 Институт за здравословен живот Цукуба, Хигаши Хиратука 586-2, Цукуба, Ибараки, Япония
Велио Бочи
2 Катедра по физиология, Viale A. Moro 2, 53100, Университет в Сиена, Италия
Резюме
Потенциалните механизми на действие на озоновата терапия са разгледани в тази статия. Терапевтичната ефикасност на озоновата терапия може отчасти да се дължи на контролирания и умерен оксидативен стрес, предизвикан от реакциите на озона с няколко биологични компонента. Границата между ефективността и токсичността на озона може да зависи от силата на оксидативния стрес. Както при упражненията, добре е известно, че умерените упражнения са полезни за здравето, докато прекомерните упражнения не са.
Силният оксидативен стрес активира ядрения транскрипционен фактор каппа В (NFκB), което води до възпалителен отговор и увреждане на тъканите чрез производството на COX2, PGE2 и цитокини. Въпреки това, умереният оксидативен стрес активира друг ядрен транскрипционен фактор, ядрен фактор-свързан с еритроид 2 фактор 2 (Nrf2). След това Nrf2 индуцира транскрипцията на антиоксидантните елементи на отговор (ARE). Транскрипцията на ARE води до производството на множество антиоксидантни ензими, като SOD, GPx, глутатион-s-трансфераза (GSTr), каталаза (CAT), хем-оксигеназа-1 (HO-1), NADPH-хинон-оксидоредуктаза (NQO -1), ензими фаза II на лекарствения метаболизъм и протеини от топлинен шок (HSP). Както свободните антиоксиданти, така и антиоксидантните ензими не само предпазват клетките от окисляване и възпаление, но може да са в състояние да обърнат хроничния оксидативен стрес. Въз основа на тези наблюдения, озоновата терапия може също да активира Nrf2 чрез умерен оксидативен стрес и да потисне NFκB и възпалителните реакции. Освен това, активирането на Nrf2 води до защита срещу невродегенеративни заболявания, като болестта на Алцхаймер и Паркинсон. Лекият имунен отговор се индуцира чрез други ядрени транскрипционни фактори, като ядрен фактор на активирани Т-клетки (NFAT) и активиран протеин-1 (AP-1).
Освен това ефективността на озоновата терапия при съдови заболявания може да се обясни и с активирането на друг ядрен транскрипционен фактор, индуцируем хипоксия фактор-1α (HIF-1a), който също се индуцира чрез умерен оксидативен стрес. Напоследък тези понятия станаха широко приети. Подчертава се гъвкавостта на озона при лечението на съдови и дегенеративни заболявания, както и кожни лезии, херниални дискове и първични кариозни лезии при деца. По-нататъшни изследвания, способни да изяснят дали механизмите на действие на озоновата терапия включват ядрени транскрипционни фактори, като Nrf2, NFAT, AP-1 и HIF-1α, са оправдани.
Въведение
Озонотерапия, или по-конкретно, основната озонирана автохемотерапия (O3-AHT), се използва от почти 40 години. Първият доклад за озоновата терапия е публикуван от Wolff през 1974 г. [1]. Въпреки че озоновата терапия сега се използва по целия свят, тя все още не е приета като ортодоксална медицина във всички страни.
Преди около две десетилетия и азотният оксид (NO), и въглеродният оксид (CO) се считаха само за токсични замърсители на въздуха или газове, получени от цигарения дим. Днес обаче те се разглеждат като основни газове, тъй като NO и CO са отговорни за много важни физиологични действия в тялото [2-4]. По същия начин сероводородът, токсичен газ, сега се използва като лекарство за лечение на остеопороза [5,6]. Освен това се съобщава също така, че облъчването с ниски дози има благоприятни ефекти в облъчените клетки, по-специално чрез удължаване на продължителността на живота на клетките чрез механизма на хормезисата [7]. По този начин нашето разбиране за токсичните съединения и техните ефекти в тялото изглежда постоянно се променя, тъй като осъзнахме, че токсичността зависи изцяло от дозировката.
Както упражненията, така и ограничаването на калориите са отлични примери за хорметичния ефект [8]. Добре известно е, че умерените упражнения са полезни за здравето. Освен това калоричното ограничение също е добре известно, че забавя появата на заболяването и смъртността [9], укрепва здравето и увеличава дълголетието чрез индуциране на сиртуин 1 (SIRT1), ген, отговорен за дълголетието [10].
Една от целите на този преглед е да предложи хипотеза за механизмите на действие на озона от гледна точка на оксидативния стрес и факторите на ядрената транскрипция, тъй като оксидативният стрес действа като втори носител в различни вътреклетъчни сигнални пътища. Освен това клетките могат бързо да предизвикат биологични реакции срещу оксидативен стрес, за да поддържат биологичната хомеостаза и да се адаптират към такива стресове. И някои ядрени фактори предизвикват различни биологични реакции срещу оксидативен стрес.
Включени са резултатите от експерименти с животни и проучвания за клиничното приложение на озоновата терапия. Освен това изследваме възможността механизмите на действие на озоновата терапия да бъдат чрез активиране на антиоксидантни защитни системи, където умереният оксидативен стрес може да индуцира активирането на ядрени транскрипционни фактори, като фактор 2, свързан с ядрен фактор-еритроид 2 (Nrf2), индуцируем от хипоксия фактор-1α (HIF-1α), ядрен фактор на активирани Т-клетки (NFAT) и активиран протеин-1 (AT-1).
1. Парадоксът на озона: озонът винаги е токсичен?
1.1. Реакция с озон и биологични компоненти
Pryor et al [11] по-рано са описали механизмите, свързани с озоновата белодробна токсичност. Накратко, инхалаторният озон реагира с полиненаситени мастни киселини (PUFA), които се намират в липидите на алвеоларния покривен слой (ALL), за да произведат специфични за озона продукти, наричани продукти за липидно озониране (LOPs). Озонът също може да реагира с ненаситени мастни киселини, за да произведе крио озонид в отсъствието на H2O. Въпреки това, в присъствието на H2O се получават алдехиди и водороден прекис (H2O2) [11]. Тъй като H2O е в изобилие в белодробната система, основната реакция с озона ще бъде образуването на алдехид и H2O2 продукти. Нетната реакция е както следва:
Предполага се, че LOP са по-вероятните видове, които действат като молекули на сигнална трансдукция. Тези продукти могат да активират специфични липази, като фосфолипаза А2 или фосфолипаза С, за освобождаване на арахидонова киселина (АА). Всъщност нивата на АА се увеличават повече от 10 пъти при ендобронхиални измивания, получени от плъхове, изложени на 1,1 ppm озон за 5 дни [12]. След това освободеният АА може да се превърне в други химически медиатори, като различни простагландини (PG) и фактори за активиране на тромбоцитите (PAF), чрез циклооксигенази (COX) и липоксигенази (LOX), за да предизвика възпалителен отговор. Освен това се съобщава, че 4-хидроксиноненалът (4-HNE), най-токсичният тип алдехид [13,14] и H2O2 [15,16], имат способността да участват в предаването на сигнала.
1.2. Ефекти на озона върху дихателните пътища: Хиперреактивност и възпаление на дихателните пътища
Има добри експериментални [19,20] и клинични [21] проучвания, които показват, че излагането чрез вдишване на продължителен тропосферен озон уврежда дихателната система и допълнителните белодробни органи. Кожата, ако е широко изложена, също може да допринесе за увреждането [22,23]. Следователно силната реактивност на озона, който има електрохимична потенциална стойност, E ° = + 2.076V, допринесе за установяването на догмата, че озонът винаги е токсичен и неговото медицинско приложение трябва да бъде забранено. Ще се покаже обаче, че тази догма не се подкрепя чрез сравняване на действието на озона върху белодробната повърхност спрямо човешката кръв. Очевидно трябва да се каже, че озонът никога не трябва да се вдишва от никого в клиниката. Изглежда обаче, че в нашето тяло може да се произвежда озон, подобен на NO, CO и H2S: съобщава се, че катализираният от антитела воден път на окисляване води до допълнителни молекулярни видове с химичен подпис към този на озона [24]. Този вид също се генерира по време на оксидативен взрив на активирани човешки неутрофили и по време на възпаление [25].
Основните моменти, които трябва да се имат предвид, са: топографията, анатомичните и биохимичните характеристики на ежедневно изложените на озон органи в сравнение с мощния антиоксидантен капацитет на кръвта, изложена на малка и точно изчислена доза озон за няколко минути. Ясно е как дихателната система, подложена на хроничен оксидативен стрес, може бавно, но непрекъснато да освобождава огромно количество вече споменати токсични съединения, способни да действат локално и да проникнат в кръвообращението и да причинят сериозни щети.
1.3. Произход, разпространение и съдба на токсичните съединения, отделяни от белодробната система по време и след излагане на озон
2. Как действа подходяща доза озон върху човешката кръв?
маса 1
Озоновата терапия може да предизвика следните биологични реакции
| а) | Подобрява кръвообращението и доставката на кислород в исхемичната тъкан благодарение на NO, CO и повишава нивата на интраеритроцитни 2, 3-DPG. |
| б) | Подобрява общия метаболизъм, като подобрява доставката на кислород. |
| ° С) | Повишава регулирането на клетъчните антиоксидантни ензими и индуцирането на HO-1 и HSP70. |
| д) | Индуцира леко активиране на имунната система и засилва освобождаването на растежни фактори. |
| д) | Не набавя остри или късни странични ефекти. |
| е) | Осигурява изненадващо уелнес при повечето пациенти, вероятно чрез стимулиране на невроендокринната система. |
| ж) | Активира невропротективните системи. |
Следващата важна стъпка беше да се оцени разпространението, съдбата и биологичното значение на алкеналите. След 5 минути смесване на кръвта с газовата смес ex vivo, озонираната кръв е готова за вливане обратно в пациента донор. Както озонът, така и водородният пероксид са изчерпани, но алкеналите образуват адукти или с Cyst 34 на албумина, или/и GSH и ще се вливат в циркулацията на пациента. Те ще взаимодействат с ендотелните клетки и след това с милиарди клетки от различни органи [46]. Само в случай, че неопитен озонотерапевт използва прекомерна доза озон, той може да окисли Cys 34 до сулфенова киселина: RSOH, която обаче може да бъде редуцирана отново.
а) Разреждане, просто изчисление показва, че болусното инжектиране на доза от 500 μM 4-HNE в 10 ml плазма, веднъж разредено в плазмен извънклетъчен обем от 12 l, независимо от всеки друг процес, дава концентрация на само 0,04 μM.
б) Детоксикация, поради директното инактивиране на 4-HNE с GSH и аскорбат или взаимодействието с милиарди клетки, снабдени с детоксикиращи ензими [42]
в) Екскреция в жлъчка и урина след чернодробна детоксикация [67] и бъбречна екскреция [60] и
г) Клетъчната интернализация, това е решаващ и интересен момент, тъй като последващите биологични ефекти могат да бъдат или отрицателни, или положителни. Няколко месеца излагане на инхалационен озон или на продължителен оксидативен стрес поради хронично заболяване (атеросклероза, диабет, възпаление) може да повиши плазмените нива на 4-HNE до 5-20 μM и, въпреки непрекъснатата детоксикация, те могат да упражнят патологични ефекти. Интересното е, че поносимостта към озон или 4-HNE се постига много по-лесно чрез малки и повтарящи се окислителни напрежения, отколкото след продължително и тежко окисление [42.43]. От друга страна, нормалното ендогенно ниво на 4-HNE (0.1 - 0.7 μM) изглежда действа като защитен агент срещу себе си и други токсични съединения. На този етап алкеналите придобиват голяма стойност, за да хипотетично задействат молекулярните механизми, водещи до медицинска ефикасност без токсичност. Този аспект е разгледан в следващия раздел.
3. Оксидативен стрес и ядрени транскрипционни фактори в канцерогенезата
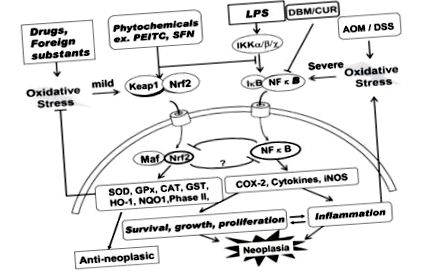
Хроничното възпаление играе критична роля при неопластичния растеж (трансформация), както и при много други заболявания. Възпалението се предизвиква чрез активиране на NFκB от различни възпалителни фактори, като LPS и тежък оксидативен стрес, получен от лекарства, които индуцират iNOS, COX-2 и възпалителни цитокини. Тези фактори индуцират оцеляването, растежа и пролиферацията на туморни клетки и водят до неоплазия [68]. Следователно инхибирането на NFκB е важна цел за профилактика и лечение на рак. Например, известно е, че инхибиторите на NFκB, като витамин Е, ресвератрол, куркумин, катехин и аспирин могат да забавят или потиснат растежа на тумора.
3.1. Антинеопластични механизми на Nrf2
Хроничното възпаление играе критична роля за неопластичния растеж, както и за много други възпалителни заболявания. Следователно инхибирането на NFkB е важна цел за профилактика и евентуално лечение на рак. Има ли роля Nrf2 в озоновата терапия? Li et al [69] демонстрират, че Nrf2, важен цитопротективен ядрен транскрипционен фактор, потиска NFκB-активирането. Както е показано на фиг. Фиг. 1 (вляво 1 (вляво), Nrf2 обикновено присъства в цитозола като комплекс с протеин Keap-1. Въпросът е: могат ли алкеналите да дисоциират този комплекс? Протеинът Keap-1 има две SH-групи и образуването на адукти може да доведе до конформационна промяна, благоприятстваща дисоциацията й. Освен други пътища, които трябва да се експериментират и лек оксидативен стрес, Nrf2 се освобождава от този комплекс и се транспортира в ядрото. Транспортираният Nrf2 образува нов комплекс с Maf протеин и индуцира транскрипцията на различни антиоксидантни и фази II детоксикационни ензими чрез свързване към антиоксидантния елемент на отговор (ARE) върху ДНК. Специфичните антиоксидантни ензими, които се активират, включват SOD, каталаза (CAT), GSH, GSH-редуктаза, GPx, GSH-S-трансфераза (GSTr), HO-1, NADPH хинин-оксидоредуктаза 1 (NQO1), протеин на топлинен шок 70 (HSP70) и фази II ензими. Тези ензими могат да предизвикат анти-неопластични ефекти.
Сулфорафанът (SFN), компонент в броколите, е най-често срещаният фитохимикал, който индуцира транскрипцията на различни антиоксидантни ензими чрез активирането на Nrf2. Всъщност SFN сам по себе си може също да действа като оксидативен стрес в клетките.
3.2. Анти-неопластичните фитохимикали не са ефективни при нокаутиращи мишки Nrf2
В предишния раздел анти-неопластичните ефекти на фитохимикалите, като SFN, са обяснени по отношение на тяхното активиране на Nrf2. Добре известно е, че SFN притежава мощни химиопрофилактични ефекти чрез индуциране на клетъчни детоксикиращи/антиоксидантни ензими чрез Nrf2 [70]. Ако тези ефекти наистина се медиират чрез Nrf2, тогава действията на SFN трябва да бъдат неактивни при Nrf2 нокаутиращи мишки и активни при мишки от див тип. Всъщност това наблюдение е направено от Xu et al [68], когато те са изследвали химиопрофилактичната ефикасност на SFN при Nrf2 див тип (+/+) и Nrf2 нокаут мишки (-/-). Локалното приложение на 100 nmol SFN веднъж дневно в продължение на 14 дни преди лечение с 7,12-диметил-бенз (а) антрацен/12-О-тетрадеканоил-форбол-13-ацетат намалява честотата на кожни тумори в Nrf2 ( +/+) мишки в сравнение с третираната с носител група. По-важното е, че няма химиопрофилактични ефекти, предизвикани от предварителната обработка на SFN при мишки Nrf2 (-/-). Взети заедно, тези резултати демонстрират за първи път, че Nrf2 (-/-) мишките са по-податливи на кожната туморогенеза и че химиопрофилактичните ефекти на SFN се медиират чрез активиране на Nrf2.
3.3. Оксидативният стрес, предизвикан от умерено упражнение, индуцира Nrf2-активиране
Умереното и тежко упражнение води до производството на ROS както в мускулите, така и във вътрешните органи. ROS са не само токсични, но също така играят важна роля в клетъчната сигнализация и регулирането на генната експресия. Известно е, че умерените упражнения са полезни за здравето, за разлика от тежките упражнения. Въпреки това, механизмите на действие на ROS, произведени по време на тренировка, не са напълно разбрани.
Производството на ROS по време на тренировка се дължи главно на нарушения на митохондриалната електронно-транспортна система, предизвикани от увеличаване на консумацията на кислород, повишаване на активността на NADPH-оксидаза в резултат на исхемия и реперфузия на вътрешните органи и възпаление, предизвикано от инфилтрацията на възпалителни клетки като макрофаги и неутрофили. Производствените нива на ROS също могат да зависят от интензивността на упражненията.
Gomez-Cabrera et al [71] съобщават, че умереното упражнение води до активиране на MAP кинази и NFκB пътя и следователно експресията на eNOS, iNOS и MnSOD. Интересното е, че всички тези промени бяха премахнати, когато производството на ROS беше инхибирано с алопуринол, инхибитор на NADPH-оксидаза. Тези открития предполагат, че индуцираното от упражнения производство на ROS води до експресия и активиране на антиоксидантни ензими, като MnSOD и GPx, главно чрез активирането на NFκB пътя. Въпреки това, все още липсват доказателства за индуцирането на антиоксидантни ензими по пътя на NFκB. По този начин не можем да отхвърлим възможността Nrf2 също да бъде активиран. По този начин да се предположи, че умерените упражнения предизвикват експресията на антиоксидантни ензими и че производството на ROS индуцира активирането на NFκB и Nrf2 може да бъде разумно, но остава да се изясни.
3.4. Биологични реакции, индуцирани чрез активиране на Nrf2/Keap1/ARE
Nrf2 се активира от лек оксидативен стрес и увеличава транскрипцията на ARE [72,73]. Това може да е възможен механизъм зад анти-неопластичните ефекти на този път. Други потенциални биологични отговори, предизвикани чрез активиране на пътя Nrf2/Keap1/ARE, са обобщени в таблица Таблица2. 2. Точки от 1 до 7 вече бяха обсъдени от Динкова-Костова [74], докато точки 8 и 9 ще бъдат разгледани в следващите раздели.
Таблица 2
Биологични реакции, предизвикани чрез активиране на Nrf2/ARE с лек оксидативен стрес
- Медицинската озонотерапия намалява оксидативния стрес и увреждането на червата в експериментален модел на
- Лимфом Действие Имуноглобулинова заместителна терапия
- Дългосрочната кетогенна диета предизвиква метаболитна ацидоза, анемия и оксидативен стрес в здравословен Wistar
- Седмица на натуропатичната медицина и проблемът с ендемичните шарлатанства, като озоновата терапия
- Медицинска озонотерапия