Резюме
наскоро съобщихме, че диета, съставена от 30% протеини, 50% мазнини и само 20% въглехидрати, драстично намалява процента на общия гликохемоглобин (% tGHb; от 9,8 на 7,6%, Δ = 2,2%), без да предизвиква кетоза при хора с диабет тип 2 (4). Това е резултат от намаляване както на гладно през нощта, така и на концентрациите на глюкоза след хранене. Използван е 5-седмичен кросоувър дизайн и обектите са били стабилни в теглото. Посочихме тази диета като ниско биологично достъпна глюкоза-20 (LoBAG20) диета. Измервани са и редица други хормони, ефектори, метаболитни субстрати и продукти (15).
Съвсем наскоро осем пациенти с нелекуван диабет тип 2 бяха проучени в 5-седмичен рандомизиран протокол за кръстосано преминаване, в който те погълнаха диета, състояща се от 30% протеини, 40% мазнини и 30% въглехидрати. Тази диета се нарича диета LoBAG30. Диетата води до намаляване на% tGHb, което е подобно на наблюдаваното при диетата LoBAG20 (от 10,8 на 9,1%, Δ = 1,7%), въпреки че съдържанието на въглехидрати е повишено (непубликувани наблюдения). Теглото остава стабилно през цялото проучване.
В настоящата публикация бяха определени същите хормони, ефектори, метаболитни субстрати и продукти като тези, определени в проучването за диета LoBAG20. Резултатите се обсъждат във връзка с получените по-рано.
Въпреки че изследването е с контролиран кросоувър дизайн, тук са представени само краткости резултатите, получени в началото и в края на диетата LoBAG30. Данните, получени, когато субектите са консумирали контролната диета, са достъпни при поискване. Като цяло резултатите останаха стабилни.
Изследваната диета е проектирана да се състои от 30% въглехидрати, 30% протеини и 40% мазнини. Съдържанието на наситени мастни киселини в диетата е ~ 10% от общата хранителна енергия; по този начин по-голямата част от мазнините са моно- и полиненаситени. Диетичният състав ще бъде публикуван отделно. Всеки пациент беше на 6-дневна ротация на менюто за общо 5 седмици.
Участниците бяха приети в SDTU вечерта преди проучването. На следващия ден бяха дадени стандартизирани ястия, съдържащи 55% въглехидрати, 30% мазнини и 15% протеини за закуска, обяд и вечеря в 0800, 1200 и 1800. Участниците бяха помолени да останат в SDTU през периода на изследването с минимално дейност.
На втория ден в SDTU отново бяха дадени стандартизирани ястия. В допълнение към храненията в 0800, 1200 и 1800, лека закуска беше дадена в 2000 г. Кръв на гладно беше получена в 0730, 0745 и 0800. Пробите бяха взети на всеки 15 минути през първия час след хранене, на всеки 30 минути за следващите 2 часа и след това на час до следващото хранене. Кръвта беше взета в общо 46 времеви точки. След този 24-часов период на натрупване на данни, участниците бяха изпратени вкъщи с цялата необходима храна за следващите 2-3 дни.
Участниците се връщаха в SDTU на всеки 2-3 дни, за да вземат храна и да се срещнат с диетолога и координатора на изследването. По това време те предоставят образец на урина за анализ на креатинин и урея, за да се определи спазването на диетата. Те също бяха претеглени и им беше измерено кръвно налягане, tGHb и кръвна глюкоза. Ако телесното им тегло намалява или се увеличава два последователни случая, общата хранителна енергия на храненията се увеличава или намалява според случая, за да се опита да поддържа стабилно тегло през цялото проучване. В допълнение, участниците бяха интервюирани относно спазването на диетата по време на всяко посещение. В края на 5-седмичния период участниците отново бяха приети в SDTU и беше взета кръв, както е описано по-горе. По това време храненията (закуска, обяд, вечеря и леки закуски) се даваха според нуждите за деня в ротацията на менюто.
Креатининът в плазмата и урината, азотът на уреята в плазмата и пикочната киселина бяха измервани с автоматизиран метод на анализатор Ortho-Clinical Diagnostics Vitros 950 (Raritan, NJ). NEFA са измервани ензимно, като се използва комплект, произведен от Wako Chemicals (Richmond, VA); обща концентрация на а-амино азот по метода на Goodwin, който е мярка за общите аминокиселини; плазмен TSH (Abbott Architect, Abbott Park, IL), растежен хормон (GH; Quest, New Brighton, MN), B12 и фолат (Diagnostic Products, Los Angeles, CA) чрез хемилуминесценция; общ трийодтиронин (Т3) и свободен тироксин (Т4) от Chemiflex (Abbott Architect); IGF-I от RIA (Quest); хомоцистеин чрез HPLC (Hewlett-Packard, Palo Alto, CA); микроалбумин с помощта на анализатор Beckman-Coulter array 360 (Fullerton, CA); свободен кортизол в урината в лабораторията на д-р Б. Пиърсън-Мърфи (McGill University, QC, Канада), като се използва HPLC етап на пречистване, последван от анализ на свързване на кортизол; пикочен алдостерон от RIA (диагностични продукти); колориметрично калций и магнезий в урината на J&J Vitros Instrument (J&J Engineering, Poulsbo, WA); и качествени уринарни кетони с кетостикс (Bayer, Elkhart, IN).
Общото количество окислен протеин беше определено чрез количествено определяне на урината урея азот, екскретиран в продължение на 24 часа от изследването, коригирано за промяна в количеството урея азот, задържан ендогенно. Последното се изчислява чрез определяне на промяната в концентрацията на азот в уреята в плазмата между изходното ниво на гладно и в края на 24-часовия период на изследване и чрез коригиране на плазмената вода чрез разделяне на 0,94. При това изчисление се приема, че има относително бързо и пълно уравновесяване на карбамида в общата телесна вода. Общата телесна вода като процент от телесното тегло се изчислява, като се използва уравнението на Watson et al. (Watson et al. 1980). Общото предположение е, че промяната в плазмената концентрация на карбамид е показател за съответната промяна в общата концентрация на карбамид в тялото. В това 24-часово проучване началната и крайната концентрация на азот в уреята са по същество идентични, което показва липса на задържане на урея. Сумата от общия уреен азот в урината и телесната вода е разделена на 0,86, за да се отчетат 14% загуби от метаболизма в червата (Hamberg and Vilstrup 1994).
Нетната интегрирана 24-часова реакция на площ беше изчислена, като се използва стойността на гладно като базова линия. Общата интегрирана 24-часова реакция на площ беше изчислена като се използва нула като базова линия. И двете изчисления на площ са направени с помощта на компютърна програма, базирана на правилото за трапец. Статистическите данни бяха определени с помощта на Student's т-тест за сдвоени променливи, с програмата StatView 512+ (Brain Power, Calabasas, CA) за компютъра Macintosh (Apple Computer, Cupertino, CA). Значимостта беше представена от a P стойност 0,05). Нетните и общите 24-часови отговори на зоната на NEFA по същество са непроменени.
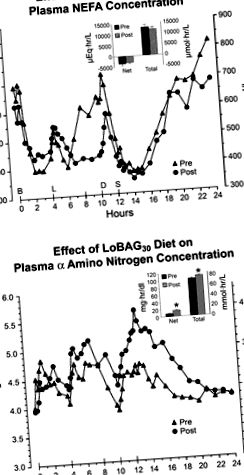
Фиг. 1.Горна част: средна плазмена нестерифицирана мастна киселина (NEFA) концентрация преди (▴) и след (•) 5 седмици при ниско биологично достъпна диета глюкоза-30 (LoBAG30). Предварително резултати, получени през първите 24 часа, докато субектите поглъщат контролните ястия (15% протеин); пост, резултати, получени през последните 24 часа след 5 седмици на диетата LoBAG30. Вмъкване: нетна и обща 24-часова интегрирана реакция на зоната на NEFA преди и след 5 седмици при диетата LoBAG30. Отдолу: средна плазмена концентрация на а-амино азот (AAN) преди и след 5 седмици при диетата LoBAG30. Вмъкване: нетна и обща 24-часова интегрирана AAN областна реакция преди и след 5 седмици при диетата LoBAG30. B, L, D и S, време, в което са били погълнати съответно закуска, обяд, вечеря и лека закуска. * Статистически значително различен от „pre“ (P ≤ 0,05).
Средната концентрация на азо-аминокиселинен азот на гладно е била 4,01 ± 0,1 mg/dl преди диетата и остава непроменена след 5 седмици на диетата. Нетните и общите 24-часови отговори в областта са значително увеличени след 5 седмици на диетата LoBAG30 (P = 0,009 и 0,049, съответно; Фиг. 1, долна вложка).
Средната концентрация на пикочна киселина на гладно се е увеличила от 4,7 ± 0,4 mg/dl преди диетата до 5,5 ± 0,4 mg/dl след 5 седмици на диетата (P = 0,002; Фиг. 2, Горна част). Нетната 24-часова зона не се променя след 5 седмици на диетата (P = 0,9; Фиг. 2горна вложка). Въпреки това, общата 24-часова зона значително се е увеличила от 106 ± 9,6 на 124 ± 8,2 mg · h · dl -1 (P = 0,0013; Фиг. 2, горна вложка).
Фиг. 2.Горна част: средна плазмена концентрация на пикочна киселина преди (▴) и след (•) 5 седмици при диетата LoBAG30. Вмъкване: нетен и общ 24-часов интегриран отговор на областта на пикочната киселина преди и след 5 седмици при диетата LoBAG30. Отдолу: средна плазмена концентрация на урея в азот преди и след 5 седмици при диетата LoBAG30. Вмъкване: нетен и общ 24-часов интегриран отговор на зоната на урея азот преди и след 5 седмици при диетата LoBAG30.
Средната концентрация на азот в урема в плазмата на гладно се е увеличила от 15 ± 1 mg/dl преди диетата до 19 ± 1,8 mg/dl след 5 седмици на диетата (P -1; това обаче не беше значително (P = 0,09; Фиг. 2, долна вложка). Общата 24-часова площ се е увеличила от 346 ± 22 на 479 ± 42 mg · h · dl -1 (P = 0,004; Фиг. 2, долна вложка).
Изчисленото общо количество протеин, погълнато през 24-часовите периоди на изследване в началото и в края на 5-те седмици, беше сравнено с общия протеин, метаболизиран.
В началото на проучването, през първите 24 часа, докато субектите поглъщат контролната (15% протеинова) храна, 105 g протеин се изчислява като погълнат и 88 g се изчислява, че се метаболизира (84%; Фиг. 3). През последните 24 часа в края на диетата LoBAG30 се изчислява, че са погълнати 214 g протеин, а 144 g са метаболизирани (68%). Разликата в процентите метаболизирани се приближава до статистическа значимостP = 0,064).
Фиг. 3.Протеин, погълнат и метаболизиран.
Концентрациите на GH в серума в началото и в края на проучването не се различават значително (Таблица 1). Въпреки това, серумната концентрация на IGF-I се е увеличила значително от средна стойност от 118 ± 23 на 158 ± 51 ng/ml (P = 0,006).
маса 1. Данни за хормони и метаболити
Стойностите са средни стойности ± SE. Общи, общи единици; SI, Système International; s, систоличен; г, диастолично.
* Статистически значително се различава от ниско биологично достъпна глюкоза (LoBAG)/предварителни данни.
Средните плазмени нива на креатинин на гладно са идентични (0,9 mg/dl) преди и в края на диетичния период, съответно (Таблица 1). Както нетната (0,3 ± 0,3 срещу 1,7 ± 0,5 mg · h · dl -1), така и общите 24-часови отговори на креатинина (22,2 ± 1,5 срещу 23,9 ± 1,9 mg · h · dl -1) се увеличават след 5 седмици на диета, но само общият брой е статистически значим (P = 0,04, данните не са показани).
Активността на плазмения ренин в края на 5 седмици при диетата LoBAG30 е непроменена (Таблица 1), както и средната 24-часова екскреция на алдостерон в урината (Таблица 2). Средният свободен кортизол в урината се е увеличил с 57% (P = 0,045).
Таблица 2. Данни за урина от двадесет и четири часа
Стойностите са средни стойности ± SE.
* Статистически значително се различава от LoBAG/предварителни данни.
Нито серумният TSH, нито свободният T4 са били значително повлияни от поглъщането на диетата LoBAG30. Общият T3 е значително намален (P = 0,041; Маса 1).
Кръвното налягане, серумният хомоцистеин, фолат и В12 не се променят в края на 5 седмици при диетата LoBAG30 (Таблица 1). РН на урината, креатининов клирънс и екскреция на натрий също не се променят (Таблица 2). Средната екскреция на микроалбумин намалява с 50%; това обаче не достига статистическа значимост (P = 0,089).
24-часовият уреен азот в урината се е увеличил, както се очаква, когато субектите са приели диетата LoBAG30 (P = 0,006). Средното увеличение е само ∼54%, а не двукратно, както би се очаквало с удвояване на съдържанието на протеини в диетата.
В първото проучване от тази поредица (непубликувани наблюдения) ще докладваме, че диетата LoBAG30 е довела до значително намаляване на концентрацията на глюкоза на гладно и след хранене и на% tGHb без промяна в серумния инсулин. По този начин диетата с високо съдържание на протеини и ниско съдържание на въглехидрати води до значително значително намаляване на глюкозата в плазмата и в% tGHb, както е ясно показано в това (30% въглехидрати) и в предишното ни проучване (4), в което съдържанието на въглехидрати е 20% (LoBAG20). Диетата не е кетогенна. Плазмените липиди са непроменени, с изключение на малко, но значително намаляване на общия холестерол и приблизително 40% намаляване на триглицеридите.
Тъй като относителната промяна във въглехидратите и мазнините в диетата може да има други метаболитни последици, ние определихме редица други фактори в настоящото проучване, използвайки същия протокол и сравнихме резултатите с тези, получени при 20% въглехидратна диета (LoBAG20) ( 15). Бяха направени сравнения между резултатите, получени в началото и в края на 5-седмичния интервенционен период за диетите LoBAG20 и LoBAG30.
Повишената концентрация на хомоцистеин се счита за независим рисков фактор за сърдечно-съдови заболявания (Smulders et al. 1999). Той, както и детерминантите на концентрацията на хомоцистеин, фолат и В12, са непроменени. Това беше вярно и когато субектите поглъщаха диетата LoBAG20.
Средното отделяне на микроалбумин е намалено с 50%, както беше посочено по-рано. Двама от участниците отговарят на критериите за микроалбуминурия в началото на проучването. При един субект микроалбуминът е намалял от 185 на 61 mg; при другия субект първоначалният микроалбумин е 41 mg и това остава непроменено. Интересното е, че този последен субект продължи на диетата общо 10 седмици. В края на 10 седмици, екскрецията на микроалбумин е 14 mg. По този начин има поне предположение, че диетата LoBAG30 може да доведе до подобряване на микроалбуминурията.
Получихме доказателства в предишни проучвания (14, 15), че увеличаването на съдържанието на протеини в диетата води до увеличаване на концентрацията на IGF-I. Настоящите данни предоставят допълнителна поддръжка. Увеличаването на съдържанието на протеини в диетата от 15 на 30% води до ∼35% увеличение на IGF-I, независимо дали съдържанието на въглехидрати е 40% (14), 20% (Nuttall and Gannon 2005) или 30%, както в настоящото изследване. По този начин индуцираното от протеините увеличение на IGF-I е независимо от количеството на въглехидратите и мазнините в храната. Известно е, че GH стимулира производството на IGF-I. Концентрацията на GH на гладно не се повишава значително в нито едно от проучванията. Въпреки това, фактът, че концентрацията на GH на гладно не се е увеличила, не означава непременно, че повишаването на хранителните протеини не е стимулирало секрецията на GH в даден момент от 24-часов период. Повечето от GH се секретират по време на сън (5). Този въпрос се разглежда в настоящите изследвания в нашата лаборатория.
- Бременност при IgA нефропатия Ефект върху бъбречните резултати FullText - Американски вестник по нефрология
- Доказателства за НИПЧ - Диабет тип 2 може да се обърне с нискокалорична диета - Информативна и
- Метаболитни механизми при затлъстяване и диабетици тип 2 от BariatricMetabolic Surgery
- Проучване на много нискокалорична диета, бързо обръща диабет тип 2 чрез медицина с множество механизми
- Консумация на подсладена захар и диетична сода и 7-годишен риск от захарен диабет тип 2