Резюме
Заден план
Гестационният захарен диабет (GDM) е най-честото медицинско усложнение, свързано с бременността, което може да наложи рискове както за майката, така и за плода. Микро РНК (miRNAs) и дълги некодиращи РНК (lncRNAs) се подразбират като жизненоважни регулатори в GDM. Неотдавнашна статия разкрива дисрегулация на miR-33a-5p в плацентарните тъкани на пациенти с GDM. Въпреки това, биологичната функция на miR-33a-5p в GDM остава неуловима. Това проучване се фокусира върху изследването на функцията и основните механизми на miR-33a-5p в GDM.
Методи
В проучването са включени 12 бременности с GDM и 12 здравословни бременности. INS-1 клетъчна линия се прилага при in vitro експерименти. Експресионните нива на miR-33a-5p, lnc-DANCR (Differentiation Antagonizing Non-Protein Coding RNA) и ABCA1 (ATP-свързващ касетен транспортер 1) mRNA се определят чрез RT-qPCR анализ. Нивата на глюкоза и инсулин са измерени чрез ELISA анализ. За потвърждаване на целта на miR-33a-5p са приложени луциферазен репортерен анализ и Western blot анализ.
Резултати
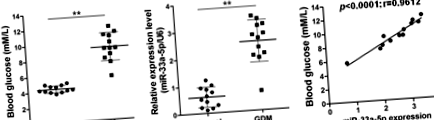
miR-33a-5p беше регулиран в кръвните проби от GDM и беше положително корелиран с кръвната глюкоза (стр
Заден план
Гестационният захарен диабет (GDM) е заболяване, при което жените без диабет имат високо ниво на кръвна захар по време на бременност [1]. GDM обикновено се появява през последните 3 месеца от бременността и може да засегне бременни жени по целия свят [2]. Жените с GDM са изложени на повишен риск от развитие на диабет тип 2, сърдечно-съдови заболявания и затлъстяване [3, 4]. GDM се свързва с повишена честота на фетална макрозомия, фетална заболеваемост и смъртност [5, 6]. По този начин, по-доброто разбиране на патогенезата на GDM е от решаващо значение за разработването на терапевтични стратегии за управление на GDM.
МикроРНК (miRNAs) са малки некодиращи РНК, съставени от 20–24 нуклеотида, които могат да се свържат към мястото на последователността на целевата иРНК в 3′-нетранслационния (UTR) регион, причинявайки разграждане на иРНК или инхибиране на транслацията на протеини [7]. MiRNAs са признати като жизненоважни регулатори в патогенезата и прогресията на различни човешки заболявания [8], включително GDM [9, 10]. MiRNAs участват в регулирането на GDM, като влияят на производството на инсулин или развитието на ендокринната панкреаса. Например, miR-9, обилно експресирана miRNA в панкреатичните островчета, намалява бета-клетъчно секретирания инсулин при стимулиране на глюкозата. MiR-9 регулира производството на инсулин чрез регулиране надолу на Onecut2 (еднорезов домейн, член на семейството) и/или регулиране нагоре на Rab (свързан с ras GTP-свързващ протеин) [11]. MiR-7, силно експресирана miRNA в островчета и панкреас, е насочена към сдвоена кутия 6 (Pax 6), за да регулира отрицателно диференциацията на бета клетки [12, 13].
В настоящото проучване ние се съсредоточихме върху изследването на биологичното значение на miR-33a-5p в регулацията на GDM и неговия потенциален механизъм за регулиране, използвайки клетъчна линия на инсулиномен плъх, INS-1 клетка, която е утвърден клетъчен модел за остров изследване на бета-клетъчната функция. Целяхме да отговорим на следните въпроси: 1. дали miR-33a-5p не е регулиран в GDM; 2. Каква е потенциалната цел на miR-33a-5p, която може да бъде свързана с неговата функция; 3. Коя lnc РНК е отговорна за регулирането на miR-33a-5p; 4. Какъв е ефектът на miR-33a-5p върху клетъчната пролиферация и производството на инсулин на INS-1 клетки?
Материали и методи
Образци на пациенти
В това проучване бяха избрани 12 бременности с GDM и 12 здрави бременности (контрол). Всички участници са били подложени на 75 g перорален глюкозен толеранс (OGTT) между 24 и 28 седмици от бременността си. Използвани са критериите на китайското общество за захарен диабет (капилярна цяла кръв; глюкоза на гладно> 90 mg/dL, 1 h> 180 mg/dL и 2 h> 155 mg/dL) и диагнозата GDM е поставена, когато две измерванията бяха над границите. А средното тегло при раждане в GDM е 3787,4 g, а в контролната група е 3320,8 g. Във всяка група полът на плода е балансиран. Феталният пол е балансиран между две групи. Пробите бяха събрани от болница Yuhuangding, свързана с университета в Кингдао, и щракнати замразени при - 80 ° C за допълнителен анализ. Писмено информирано съгласие е получено от всеки участник преди събирането на проби. Протоколът за изследване е одобрен от Комитета по етика на болница Yuhuangding, свързана с университета в Кингдао.
Клетъчна култура
Клетъчна линия HEK293, постоянна клетъчна линия, установена от първичен ембрионален човешки бъбрек, е получена от American Type Culture Collection (ATCC, Manassas, USA), а INS-1 клетъчна линия е закупена от ThermoFisher Scientific (MD, USA). Културите се поддържат в модифицираната среда на Dulbecco на Eagle (Thermo Fisher Scientific, Waltham, MA, USA), допълнена с 10% фетален говежди серум (Thermo Fisher Scientific), пеницилин (100 U/ml) и стрептомицин (100 U/ml) (Sigma -Aldrich, Сейнт Луис, Мисури, САЩ) при 37 ° C в овлажнен инкубатор с 5% CO2.
Количествена обратна транскрипция-PCR (RT-qPCR)
Общата РНК се екстрахира с използване на TRIzol реагент (Invitrogen, Carlsbad, CA, USA), а концентрацията и чистотата на РНК се определят от спектрофотометър NanoDro2000c (Thermo Scientific, Waltham, USA). Обратната транскрипция беше извършена с помощта на TaqMan MicroRNA комплект за обратна транскрипция (Applied Biosystems, Carlsbad, CA). Процесът RT-qPCR се извършва на PCI система в реално време ABI7500.
Уестърн петно
Клетките се лизират в RIPA буфер (PI89901, Thermo Scientific Pierce, MD, САЩ), снабден с протеазен инхибиторен коктейл (A32963, Thermo Scientific Pierce, MD, USA). Общо 20 μg протеини бяха заредени в 10% SDS-полиакриламиден гел и разделени чрез електрофореза. Протеините се прехвърлят върху мембрани от поливинилиден дифлуорид (PVDF, Bio-Rad, Hercules, CA, USA), последвано от блокиране с 5% обезмаслено мляко и инкубиране с първични антитела срещу ABCA1 или GAPDH (Cell Signaling Technology, Danvers, MA, USA ). След това мембраните се инкубират с конюгирани с HRP вторични антитела. Сигналите са визуализирани с помощта на ECL (Millipore, Burlington, MA, USA).
Ензимно-свързан имуносорбентен анализ (ELISA)
Нивата на кръвната глюкоза бяха измерени с помощта на комплект за анализ на глюкоза (ab65333) от Abcam (Cambridge, MA, USA), а нивата на секреция на инсулин бяха определени с помощта на инсулинов ELISA комплект от RayBiotech (Norcross, GA, USA) съгласно инструкциите на фабриката.
Анализ на репортер на луцифераза
3'-UTR ДНК фрагмент от див тип или мутант ABCA1 беше клониран в репортера на psiCHECK2 (Promega, WI, САЩ) като psiCHECK2-ABCA1-WT или psiCHECK2-ABCA1-Mut. Lnc-DANCR див тип или мутантна ДНК фрагмент също беше клониран в репортера psiCHECK2 като psiCHECK2-DANCR-WT или psiCHECK2-DANCR-Mut.
Клетките HEK293 бяха ко-трансфектирани с имитация на miR-33a-5p и psiCHECK2-ABCA1-WT, psiCHECK2-ABCA1-Mut, psiCHECK2-DANCR-WT или psiCHECK2-DANCR-Mut, както и pRT-TK Renilla плазмид. Активността на луциферазата се измерва с двойна луциферазна система за репортер (Promega, WI, САЩ) след 48 часа ко-трансфекция.
Комплект за броене на клетки-8 (CCK-8)
Клетъчната жизнеспособност се определя чрез анализ CCK8, съгласно инструкциите на фабриката (Abcam, Cambridge, MA, USA). INS-1 клетки се посяват в 96-ямкови плаки и се инкубират за желаните точки при 37 ° С след трансфекция. Разтворът CCK-8 се добавя към всяка ямка на плаката, последвано от инкубация при 37 ° С. Абсорбцията се измерва при 450 nm с помощта на четец за микроплаки.
Статистически анализ
Статистическият анализ беше извършен със софтуер SPSS 13.0 (IBM, Armonk, Ню Йорк, САЩ). Резултатите бяха оценени чрез χ 2 тест, тест на Student или t еднократен ANOVA с post hoc тест на Tukey и изразени като средно ± SD. Независимите експерименти бяха повторени поне в три екземпляра. Корелациите бяха анализирани с помощта на теста на коефициента на корелация на Spearman. Разликите бяха счетени за значителни при стр
Резултати
miR-33a-5p и нивата на кръвната глюкоза са положително корелирани при GDM
В настоящото проучване бяха приложени 12 кръвни проби от нормална здравословна бременност и 12 кръвни проби от GDM бременности. Първо измерихме нивата на кръвната глюкоза в тези проби и потвърдихме, че нивата на кръвната захар при бременности с GDM са значително по-високи от тези при здрави донори (стр Фиг. 1
Свръхекспресията на miR-33a-5p инхибира клетъчната пролиферация и производството на инсулин на INS-1
За да изследваме функционалната значимост на miR-33a-5p в GDM, ние имаме за цел да проучим ефекта на свръхекспресията на miR-33a-5p върху клетъчната пролиферация и производството на инсулин на INS-1 клетки. INS-1 клетките бяха трансфектирани с имитация на miR-33a-5p-mimic и miR-отрицателен контрол (NC). Подобрените miR-33a-5p нива в INS-1 клетки след miR-33a-5p-имитираща трансфекция бяха потвърдени чрез RT-qPCR анализ (Фиг. 2а). Резултатите от клетъчната пролиферация показват, че повишеното регулиране на miR-33a-5p намалява скоростта на клетъчен растеж на INS-1 клетки (Фиг. 2b). Също така забелязахме, че свръхекспресията на miR-33a-5p води до намалена концентрация на инсулин, както и до понижена секреция на инсулин както при ниски (3.3 mM), така и при високи (16.7 mM) глюкозни условия (фиг. 2в и d).
Потискането на miR-33a-5p насърчава клетъчната пролиферация и производството на инсулин на INS-1
За по-нататъшно проучване на функцията на miR-33a-5p върху GDM, ние унищожаваме miR-33a-5p в INS-1 клетки, използвайки miR-33a-5p инхибитор. Нокдаунът на miR-33a-5p след трансфекция на miR-33a-5p инхибитор беше потвърден чрез RT-qPCR анализ (Фиг. 3а). За разлика от ефекта на свръхекспресията на miR-33a-5p върху INS-1 клетки, потискането на miR-33a-5p насърчава клетъчната пролиферация на INS-1 клетки (Фиг. 3b и c). Интересното е, че инхибирането на miR-33a-5p също повишава концентрацията на инсулин и секрецията на инсулин както при ниско, така и при високо ниво на глюкоза (Фиг. 3d).
miR-33a-5p цели ABCA1
За да идентифицираме функционална цел на miR-33a-5p, ние приложихме добре установен алгоритъм за търсене на miRNA-target (http://www.microrna.org). Установихме, че 3′-UTR регионите на ABCA1 ген, съдържащ потенциалното свързващо място на miR-33a-5p (фиг. 4а). За да потвърдим, че ABCA1 е цел на miR-33a-5p, ние приложихме луциферазния доклад, RT-qPCR и Western blot тестове. Установихме, че свръхекспресията на miR-33a-5p специфично намалява луциферазния сигнал, произведен от плазмида, съдържащ дивия тип, но не и мутантните, 3′-UTR области на ABCA1 в клетки HEK293 (Фиг. 4b). Освен това, принудителната експресия на miR-33a-5p намалява експресията както на нивата на mRNA, така и на протеините на ABCA1 в INS-1 клетки (фиг. 4в и d). И накрая, за разлика от miR-33a-5p, нивата на експресия на ABCA1 бяха значително понижени в GDM в сравнение с нормалните донори (стр Фиг. 4
Lnc-DANCR е насочен към miR-33a-5p
Доказахме, че miR-33a-5p е насочен към ABCA1. Въпреки това, как е бил регулиран miR-33a-5p, остава неизвестно. Търсейки потенциалната таргетна lncRNA на miR-33a-5p с помощта на добре познат инструмент за прогнозиране на lncRNA-miRNA (starBase v2.0), установихме, че lnc-DANCR потенциално се свързва с miR-33a-5p (фиг. 5а). За да се потвърди това откритие, последователността на lnc-DANCR-WT или lnc-DANCR-Mut беше вмъкната в плазмения репортер на луциферазата. Резултатите показаха, че свръхекспресията на miR-33a-5p очевидно намалява луциферазната активност на lnc-DANCR-WT, но не и lnc-DANCR-Mut, което предполага, че miR-33a-5p специфично се свързва с последователността на lnc-DANCR-WT към намалете луциферазния сигнал (фиг. 5б). Всъщност свръхекспресията на lnc-DANCR е намалена, докато lnc-DANCR нокдаунът е подобрен, експресията на miR-33a-5p в клетки INS-1 (фиг. 5в).
За да се изследва биологичната функция на lnc-DANCR-miR-33a-5p сигнализиране в INS-1 клетки, INS-1 клетки бяха трансфектирани с контрола, lnc-DANCR, miR-33a-5p или lnc-DANCR + miR-33a- 5p комбинация. Резултатите показаха, че lnc-DANCR повишеното регулиране насърчава, докато miR-33a-5p регулирането инхибира клетъчната пролиферация и инсулиновата концентрация на INS-1 клетките. Интересното е, че принудителната експресия на lnc-DANCR може да спаси медиирани от miR-33a-5p инхибиращи ефекти върху клетъчната пролиферация и производството на инсулин на INS-1 клетки (фиг. 5г и д).
Корелацията между lnc-DANCR, ABCA1, miR-33a-5p и кръвната глюкоза при GDM
Нивата на експресия на lnc-DANCR в 24 кръвни проби от здрави донори или бременности с GDM бяха определени чрез RT-qPCR. Резултатите показват, че нивата на експресия на lnc-DANCR са значително понижени в GDM в сравнение с тези при здрави донори (стр Фиг. 6
Дискусия
ABCA1 е регулаторен протеин за изтичане на холестерол, който регулира изтичането на холестерол, хомеостазата на фосфолипидите и метаболизма на липидите [33, 34]. Високо ниво на ABCA1 се наблюдава в ендотелните клетки на феталните капиляри от майчината страна на плацентата [35, 36]. ABCA1 регулира трансплацентарния фето-майчин липиден обмен, което предполага важната му роля за нормалното развитие на плода [37]. Съобщава се също така, че ABCA1 е понижен при пациенти с GDM [38]. В съответствие с публикациите на други [18,19,20, 38], ние не само потвърдихме понижаването на ABCA1 в плацентарните тъкани на пациенти с GDM, но също така установихме, че ABCA1 е пряка цел на miR-33a-5p в GDM. Освен това установихме, че нивата на експресия на miR-33a-5p и ABCA1 също са отрицателно корелирани при пациенти с GDM, което също е в съответствие с предишни констатации, че експресията на miR-33a-5p и ABCA1 е обратно корелирана [15,16,17 ].
Експресията на miRNAs се регулира от множество фактори, като транскрипционни фактори, епигенетична модификация, miRNA биогенеза и lncRNAs. lncRNAs често функционират като miRNA гъби, които се свързват с miRNAs и блокират способността на miRNA да свързва своята iRNA мишена [39, 40]. Съобщава се, че Lnc-DANCR е свързан с развитието, прогресирането и метастазирането на различни човешки ракови заболявания [41]. Наскоро проучвания предполагат, че lnc-DANCR улеснява прогресията на тумора на глиома, както и на остеосарком, чрез гъбене на miR-33a-5p [27, 42]. В съответствие с тези констатации, ние също потвърдихме, че lnc-DANCR се свързва с miR-33a-5p и намалява нивото на miR-33a-5p в INS-1 клетки. Наблюдава се обратна корелация между lnc-DANCR и miR-33a-5p в GDM. Свръхекспресията на lnc-DANCR улесни клетъчната пролиферация и производството на инсулин на INS-1 клетки. По-важното е, че регулирането на lnc-DANCR може да спаси инхибиращия ефект на miR-33a-5p върху INS-1 клетки.
Заключение
Настоящото проучване демонстрира, че miR-33a-5p е регулиран в GDM. Свръхекспресията на miR-33a-5p инхибира клетъчната пролиферация и производството на инсулин на INS-1 клетки. miR-33a-5p регулира функцията на INS-1 клетките чрез насочване към ABCA1. Lnc-DANCR понижава регулирането на miR-33a-5p, като действа като гъба на miR-33a-5p. Свръхекспресията на Lnc-DANCR намалява инхибиращите ефекти на miR-33a-5p върху INS-1 клетки. Нашите резултати дават нова представа за ролите на miR-33a-5p в GDM.
Наличност на данни и материали
Наборите от данни, генерирани и анализирани по време на настоящото проучване, са достъпни от съответния автор при разумна заявка.
- Скрининг, диагностика и управление на гестационен захарен диабет - американски семеен лекар
- Предварително нива на чернодробния ензим и риск от гестационен захарен диабет по време на последващо
- Хранителна терапия при гестационен захарен диабет Време за напредване на диабетната грижа
- Хранителни вещества Специален брой Хранене за гестационен диабет
- Отлагането на мазнини в панкреаса се увеличава и е свързано с функцията на бета-клетките при семейни жени