Резюме
Заден план
Да се изследва отлагането на мазнини в панкреаса и бета-клетъчната функция при семейни пациенти с частична липодистрофия (FPLD).
Методи
В проучване на напречно сечение, единадесет пациенти с FPLD и осем здрави доброволци са били съпоставени по възраст и индекс на телесна маса и са изследвани в център за препоръки. Съставът на тялото беше оценен с помощта на двуенергийна рентгенова абсорбциометрия и методът на Dixon за ядрено-магнитен резонанс беше използван за количествено определяне на панкреатичната и чернодробната мазнина. Измерва се плазмена глюкоза на гладно, инсулин, лептин, липиди и оценка на модела на хомеостаза на стойностите на инсулинова резистентност и се извършва орален глюкозен толеранс. Изчисляват се инсулиногенният индекс, индексът на инсулинова чувствителност Matsuda и индексът на разположение на бета-клетките.
Резултати
Групата FPLD представи по-високо съотношение между талията и ханша и съотношението на мастната маса и по-ниска обща маса на мастната тъкан и мастната тъкан на долните крайници. Съдържанието на панкреатична и чернодробна мазнина (log transformed) е значително по-високо в групата с FPLD (5,26 ± 1,5 срещу 4,08 ± 0,64, p = 0,034 и 0,77 ± 0,50 срещу 0,41 ± 0,18, p = 0,056, съответно). Мазнините в панкреаса са в обратна връзка с DI (r = - 0,53, p = 0,027) и HDL-холестерол (r = - 0,63, p = 0,003) и пряко свързани с WHR (r = 0,60; p = 0,009), HbA1c (r = 0,58; p = 0,01) и серумен триглицерид (r = 0,48, p = 0,034). По-високи нива на триглицериди и по-ниски нива на HDL-холестерол са наблюдавани в групата с FPLD.
Заключения
Това проучване демонстрира за първи път, че отлагането на мазнини в панкреаса се увеличава при FPLD. Освен това е доказана обратна връзка между мазнините на панкреаса и функцията на бета-клетките. Констатациите от това проучване могат да бъдат в съответствие с хипотезата за разширяемост и хипотезата на двойния цикъл.
Заден план
Липодистрофиите (LP) са клинично хетерогенна група генетични или придобити нарушения, характеризиращи се с променлива загуба на подкожна мастна тъкан [1]. Семейната частична липодистрофия (FPLD), която в момента е най-често срещаната и добре описана фамилна LP, се характеризира с намалено отлагане на подкожно (SC) мазнини, засягащо крайниците и багажника, със селективно висцерално липодепозиране и натрупване на SC мазнини в раменния пояс, врата и лицето. Пациентите с FPLD проявяват изразена инсулинова резистентност с глюкозна непоносимост или захарен диабет (DM), дислипидемия, акантоза нигриканс и висок риск от сърдечно-съдови (CV) заболявания [2,3,4]. Фенотипът на FPLD най-много прилича на фенотипа на метаболитния синдром, наблюдаван в общата популация [4]. Следователно, по-доброто разбиране на тази недостатъчно проучена патология може да разкрие важни улики за дешифриране на инсулиновата резистентност (IR) и нейните метаболитни последици.
Висцералното затлъстяване и ектопичните натрупвания на мазнини са свързани с FPLD [5,6,7]. Тези отлагания на маточна мастна тъкан може да са свързани с нарушена функция на органи и неблагоприятни кардиометаболитни ефекти. Нашата група описва увеличена епикардна мастна тъкан в кохорта от пациенти с FPLD, оценена чрез ехокардиография [8]. Липидни натрупвания в черния дроб и мускулите са наблюдавани при миши модели на наследствен LP [9]. Понастоящем област от специален интерес е възможността за отлагане на мазнини в панкреаса при пациенти с FPLD, човешки модел на инсулинова резистентност [9, 10]. Хроничното излагане на панкреатичните островчета на неестерифицирани мастни киселини се счита за потенциална основна причина за бета-клетъчна дисфункция [10]. Всъщност последните данни сочат, че съдържанието на липиди в панкреаса може да допринесе за дисфункция на бета-клетките и евентуално за последващото развитие на диабет тип 2 при чувствителни индивиди [11].
Най-точните измервания на телесните мастни натрупвания се получават с помощта на радиологични методи, а именно двуенергийна рентгенова абсорбциометрия (DXA) и ядрено-магнитен резонанс (MRI) и техники като протонна спектроскопия (H-MRS) и мазнини на основата на Dixon количествено определяне (MRI-DIXON), особено за определяне на съдържанието на мазнини в черния дроб и панкреаса [12,13,14,15]. Тези техники са валидирани срещу прякото определяне на съдържанието на триглицериди в биопсии на черния дроб на човека.
Понастоящем, доколкото ни е известно, няма налични данни за оценка на отлагането на мазнини в панкреаса на пациенти с FPLD. Освен това, връзката между отлагането на мазнини в панкреаса и черния дроб и функцията на бета-клетките не е добре проучена. Целите на това проучване бяха да се оцени съдържанието на мазнини в панкреаса и черния дроб и тяхната корелация с бета-клетъчната функция при пациенти с FPLD.
Методи
Субекти
Включени са 11 жени с FPLD от амбулаторните клиники на Serviço de Metabologia do Instituto Estadual de Diabetes e Endocrinologia do Rio de Janeiro (Рио де Жанейро, Бразилия). Диагнозата на FPLD е потвърдена чрез молекулярния анализ на LMNA ген (ABI Prism 3100 Genetic Analyzer; Applied Biosystems, Foster City, CA, USA), извършен от Молекулярна ендокринологична лаборатория на Медицинско училище Паулиста. Единадесет пациенти са имали мисенс мутация в LMNA ген: седем пациенти са имали хетерозиготен вариант p.R482W (c.1444C> T), при трима пациенти идентифицираната мутация е p.R482Q (c.1445G> A), а един пациент е показал нов хетерозиготен вариант в екзон 8 ( p.N466D (c.1396A> G), описано по-горе [7]. Пациентите принадлежат към шест различни семейства.
Контролна група от 8 здрави жени беше внимателно и последователно подбрана, за да съответства на липодистрофичната група според индекса на телесна маса (ИТМ) и възрастта. Всички контроли бяха здрави и нямаха предишни медицински състояния, които биха могли да повлияят на оценката по време на проучването.
Критериите за изключване бяха следните: бременни или кърмещи жени; тежки бъбречни или чернодробни заболявания; депресия или алкохолизъм; употреба на тиазолидиндиони (TZD) през последните 6 месеца или настояща употреба на глюкокортикоиди; и скорошна значителна загуба на тегло (≥ 3 kg през последните 3 месеца).
Протоколът за изследване е одобрен от местната комисия по етика.
Антропометрично изследване
Следните антропометрични данни бяха записани при всички участници: телесно тегло (kg), височина (m), обиколка на талията (cm), съотношение между талията и бедрата (WHR) и кръвно налягане (mmHg). ИТМ се изчислява като тегло в килограми, разделено на квадрата на височината в метри (kg/m 2). Обиколката на талията се определя в средната точка между най-ниското ребро и илиачния гребен. WHR се определя като съотношение на обиколката на талията към най-голямата обиколка на бедрата, измерено при по-големия трохантер.
Лабораторна оценка
Биохимични анализи
Кръвни проби бяха събрани между 06:30 и 08:00 ч. Сутринта след пост през нощта (12 часа). Глюкозата в плазмата се определя с помощта на глюкозо-оксидазния метод. Съдържанието на холестерол във фракциите на липопротеините и триглицеридите се измерва ензимно. Плазмените концентрации на лептин и инсулин са измерени с помощта на радиоимунологичен анализ. Нивата на глюкоза на гладно, 30, 60 и 120 минути след натоварване са определени след орален тест за толерантност към глюкоза от 75 g (OGTT).
Параметри на функцията на бета-клетка
IR се изчислява с помощта на оценката на модела на хомеостазата (HOMA-IR), като се използва следната формула: IR = инсулин на гладно × глюкоза на гладно/22,5. Инсулиногенният индекс (II) се изчислява като нарастване на инсулина над нивото на гладно за 30 минути, разделено на съответния прираст на глюкозата [16]. Тъй като секрецията на инсулин зависи от инсулиновата чувствителност, ние оценихме индекса на диспозиция на бета-клетки (DI), изчислен като продукт на II и индекса на Matsuda на инсулиновата чувствителност (II × 1/инсулин) [17, 18].
Анализ на телесните мазнини с помощта на DXA
Беше извършено DXA сканиране (софтуер LUNAR PRODIGY ADVANCE, версия 9.5, модел LNR 41569; GE Medical Systems, Waukesha, WI, USA). Количеството и разпределението на мазнините се анализират, като се използват следните променливи: обща мазнина (%), мазнина в багажника (%), мазнина в горните и долните крайници (%), мастна маса (g), централна мазнина (g) и периферна мазнина (g ). Съотношението на централната към периферната мазнина или съотношението на мастната маса (FMR) се използва за изследване на разпределението на телесните мазнини, както беше описано по-рано [5, 6, 19].
Отлагане на панкреас и чернодробна мазнина, оценено чрез MRI-DIXON
Статистически анализ
Статистическият анализ беше извършен с помощта на GraphPad InStat 3.00 за Windows 95 (GraphPad Soware, Сан Диего, Калифорния, САЩ). Параметричните данни са показани като средно ± стандартно отклонение и непараметрични, като медиана (диапазон). Несдвоена т-тестът беше използван за сравняване на параметрични променливи, а тестът на Ман-Уитни или несдвоен t-тест (коригиран от Уелч) бяха използвани за непараметрични променливи. Силата на линейната връзка между две непрекъснати променливи беше оценена с помощта на Pearson или Speerman’s Coefficient. Нивото на статистическа значимост е 5%. Логаритмично трансформирани стойности бяха използвани само за променливата на чернодробните мазнини поради голямото разсейване на стойностите.
Резултати
В нашето проучване бяха оценени 11 жени с FPLD. Десет пациенти са диагностицирани със СД тип 2 и са приемали метформин, а един е с нарушена глюкоза на гладно. Продължителността на диабета варира от 1 до 10 години. Пациентите принадлежат към 6 различни семейства, както е описано в предишни доклади [5,6,7]. Таблица 1 описва базовите характеристики на изследваната популация. FPLD и контролните групи не се различават значително по отношение на възрастта, ИТМ и обиколката на талията. Както се очакваше, групата с FPLD представи по-висока WHR и FMR и по-ниска обща маса, мазнини на трупа и крайниците. Биохимичните променливи включват по-високи триглицериди и по-ниски нива на HDL-холестерол. Лептинът е забележително по-нисък при FPLD (4,2, 2,4–29,0 ng/ml), отколкото при контролната група (19,2, 11,5–27,4 ng/ml, p = 0,028).
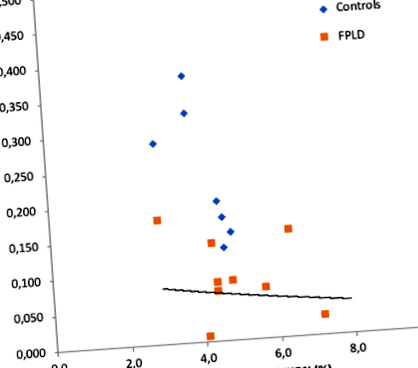
Основната констатация в това проучване е, че съдържанието на мазнини в панкреаса е значително по-високо в групата с FPLD, отколкото в контролната група (5,26 ± 1,50 срещу 4,08 ± 0,64, p = 0,034). В допълнение, DI е значително по-нисък в групата с FPLD [0,08 (0,01–0,17) срещу 0,24 (0,13–2,07) p Фиг. 1
Корелация между индекса на разположение (DI) и панкреатичната мастна тъкан, измерена по метода DIXON (r = - 0,53, p = 0,027)
Като се има предвид голямото разсейване на стойностите (вариращи от 37,3 до 1,6%), за анализ на процента на чернодробните мазнини бяха използвани логарифмично трансформирани стойности. Чернодробните мазнини също се повишават в групата с FPLD (0.77 ± 0.50 срещу 0.41 ± 0.18, p = 0.056).
Дискусия
За първи път в литературата, настоящите резултати показват, че пациентите с FPLD са повишили мазнините в панкреаса, измерени по метода MRI-DIXON. По същия начин при тези пациенти панкреатичната мастна корелация е обратно свързана с функцията на бета-клетките, което предполага, че механизмите на бета-клетъчна недостатъчност и диабет могат да бъдат свързани с липотоксичността [10,11,12].
Както беше описано по-рано, безалкохолната мастна чернодробна болест (NAFLD) е често свързана характеристика, наблюдавана с IR при пациенти с FPLD [1,2,3,4]. В нашия регистър чернодробните мазнини бяха увеличени при 8 от 11 пациенти от групата с FPLD. Въпреки че логарифмично трансформираните стойности бяха използвани за статистически анализ, средният процент на мазнини беше 11,7%, което беше подобно на констатациите от кохорта от 23 пациенти с FPLD, описани наскоро от Ajnuli et al. [20] (11,9 ± 6,3%).
Отлагането на мазнини в черния дроб и панкреаса е в съответствие с „хипотезата на двойния цикъл“, което предполага, че прогресивното натрупване на мазнини в черния дроб и панкреаса ще доведе до самоукрепващ се цикъл, водещ до бета-клетъчна дисфункция [21]. Интересното е, че Lim et al. [22] демонстрира, че след 8 седмици на много нискокалорична диета, обръщането на диабет тип 2 и пълното възстановяване на бета-клетъчната функция временно съвпадат с значително намаляване на черния дроб и панкреатичната мазнина.
Хипотезата за разширяемост предполага, че относителната неспособност на мастната тъкан да се разширява и следователно да съхранява липиди би довела до съхранение на излишните мазнини в не-мастните тъкани като черния дроб и мускулите, причинявайки IR и липотоксичност [23]. Недостигът на периферни мазнини (т.е. мазнините в краката) е отличителен белег на частичната липодистрофия [1, 2, 4]. В предишен доклад Ajnuli et al. [20] показа, че мастната маса на долната част на крака е свързана с по-високите триглицериди при пациенти с FLPD, което предполага патогенна връзка между по-високите нива на триглицеридите и неспособността да се отлагат мазнини в подбедрицата. По същия начин тези автори откриват FMR над 1,5 в кохорта от 23 възрастни жени с FPLD, което е подобно на нашето (FMR = 1,85 в групата с FPLD). По този начин, мастната тъкан в долната част на краката може да е основната причина, поради която излишната погълната енергия се натрупва в ектопичните тъкани, включително панкреаса, което води до метаболитно увреждане.
Хората с нормално тегло, метаболитно нездравословни (NWMU), напоследък се характеризират с генетични, антропометрични и методи за телесен състав [24,25,26,27]. Тези проучвания подчертават, че често срещаните генетични варианти, свързани с индекси на IR или разпределение на мазнини, са свързани с метаболитни характеристики [25] и по-ниско затлъстяване и ИТМ [24, 27], като тези, установени при моногенни липодистрофии [1, 20, 28]. Освен това, Stefan et al. [26] изследва кохорта от 981 субекта, които са били изложени на риск от метаболитни заболявания, използвайки ЯМР на цялото тяло. Сред субектите с нормално тегло,
20% са лица от NWMU, които показват високо разпространение на нисък процент на SC мазнини в краката. Когато пациентите от NWMU са сравнени с нездравословни пациенти с наднормено тегло или с наднормено тегло, е установено постепенно увеличаване на разпространението на ниската маса на мазнините в краката (β = 0,99, p
- MicroRNA-33a-5p гъби за инхибиране на β-клетъчната функция на панкреаса при гестационен захарен диабет
- Нормална функция на червата и дисфункция, свързани със запек - MD Anderson Cancer Center
- Безалкохолна мастна панкреасна болест като рисков фактор за рак на панкреаса въз основа на ендоскопски
- Неинвазивни образни тестове за рак на панкреаса Отделение по хирургия на университета в Колумбия
- Симптоми на пролапс при жени с наднормено тегло и затлъстяване преди и след отслабване - PubMed