Алекс П. Кийм
1 Катедра по биомедицинско инженерство, Мичигански технологичен университет, Хоутън, Мичиган.
Джъстин Р. Слис
1 Катедра по биомедицинско инженерство, Мичигански технологичен университет, Хоутън, Мичиган.
Узиел Мендес
1 Катедра по биомедицинско инженерство, Мичигански технологичен университет, Хоутън, Мичиган.
Емили М. Страуп
1 Катедра по биомедицинско инженерство, Мичигански технологичен университет, Хоутън, Мичиган.
Ивон Бурмистър
3 Biologische Heilmittel Heel GmbH, Баден-Баден, Германия.
Натали Цолаки
4 Scheibenhardt, Германия.
Оливър Гейлинг
2 Катедра по горско стопанство, Мичигански технологичен университет, Хоутън, Мичиган.
Джеръми Голдман
1 Катедра по биомедицинско инженерство, Мичигански технологичен университет, Хоутън, Мичиган.
Резюме
Заден план
Вторичният лимфедем е доживотно заболяване на болезнено подуване на тъканите, което често следва дисекция на аксиларни лимфни възли за лечение на рак на гърдата. Предполага се, че лошата лимфна регенерация през обструктивната тъкан на белега по време на процеса на зарастване на раната може да предразположи тъканта да се подуе на по-късна дата. Лечението на лимфедем остава неоптимално и в повечето случаи е палиативно. Целта на това проучване беше да се оцени способността на Lymphomyosot да лекува подуване на тъканите и да насърчава лимфангиогенезата в експериментални модели на миши лимфедем.
Методи
Експериментални модели на миши лимфедем бяха инжектирани с различни количества лимфомиозот и физиологичен разтвор като контрол. Измервания на подуване на опашката и затваряне на рани бяха взети и сравнени между групите. Три отделни групи мишки бяха анализирани за лимфна капилярна миграция, регенерация на лимфните съдове и набиране на макрофаги.
Резултати
Лимфомиозотът значително намалява подуването и увеличава скоростта на затваряне на хирургичната рана. Lymphomyosot не увеличава миграцията на лимфните капиляри в модела за регенерация на кожата на мишката или регенерация на лимфните съдове след дисекция на аксиларни лимфни възли на мишки.
Заключения
Лимфомиозот може да действа чрез възпалителни пътища и пътища за възстановяване на рани, за да намали експерименталния лимфедем. Способността му да регулира възпалението, както и да подпомага възстановяването на тъканите и извънклетъчното образуване, може да позволи производството на матричен мост без белези, през който мигриращите клетки и натрупаната интерстициална течност могат свободно да се разпространяват.
Въведение
Вторичният лимфедем е доживотно заболяване с повишено задържане на течности, подуване на тъканите и нарушена имунна функция поради намален лимфен дренаж. Лимфедемът често се появява след дисекция на аксиларни лимфни възли за лечение на рак на гърдата. 1 Това е един от най-честите дългосрочни странични ефекти на рака на гърдата и неговото лечение и обикновено се развива няколко години след излекуването на първоначалното увреждане, свързано с лимфата. Различни проучвания са изчислили, че от 30% до 60% от оцелелите от рак на гърдата съобщават за симптоми на лимфедем. 2 Въпреки последните подобрения в хирургичните техники, като използването на биопсия на сентинелен възел за стадиране, за разлика от пълната дисекция на аксиларен възел, рискът от лимфедем е намалял, но не е елиминиран. 1,3 Освен това пациентите с мастектомия и консервативната хирургия имат сходни нива на развитие на лимфедем. 4 Механизмите, които регулират развитието му, остават до голяма степен неизвестни и затова остава неясно защо някои пациенти развиват лимфедем, а други, които се лекуват по идентичен начин, не. 5
Лимфедемът често кара оцелелите от рак на гърдата да изпитват сериозни ограничения в ежедневните си дейности, като измеримо влияят върху цялостното им качество на живот. По-конкретно, жените с лимфедем са по-инвалидизирани, съобщават за симптоми от горния крайник (болка в рамото или ръката) и затруднения в движението на ръката, болка и подуване от оперираната гърда, повтарящи се инфекции и по-висок психологически стрес. 5,6 Лечението на лимфедем остава неоптимално и в повечето случаи е палиативно с цел предотвратяване на прогресията на заболяването, а не лечение. Понастоящем няма фармакологични лечения за подобряване на лимфното възстановяване след операция на рак на гърдата. Има широко използвани нелекуващи подходи за овладяване на отока след появата му, като компресионни облекла и ръчна лимфна дренажна терапия. 5,7
Важно е да се признае, че аксиларната дисекция премахва не само аксиларните лимфни съдове и свързаните с тях лимфни възли, но и изобилие от околните меки тъкани, като по този начин се получава голяма кухина в аксилата. Операцията се извършва в опит да се предотврати метастазирането на тумора през лимфната система, да се отстранят туморните клетки, пребиваващи в лимфната система, и да се определи стадирането на тумора за последващи лечения. Последващият процес на възстановяване на рани вътре в аксиларната кухина често води до развитие на фиброзна тъкан и образуване на белези. Установено е, че фиброзната тъкан инхибира лимфната регенерация и интерстициалните потоци, което може да предразположи тъканта нагоре по течението към обезобразяващо удебеляване и хронична инфекция на лимфедема. 5,8,9 Следователно леченията, насочени към подобряване на естественото заздравяване на мястото на раната, могат косвено да увеличат лимфангиогенезата и оттичането на интерстициална течност и да предотвратят или намалят честотата на вторичния лимфедем. 8–12 Понастоящем няма лекарства, отпускани по лекарско предписание, успешни в превенцията или лечението на фиброзни белези. 13,14
Мултикомпонентното/мултитаргетинг лекарство Lymphomyosot е показано в няколко наблюдателни проучвания, че действа върху възпалителните пътища и намалява тъканния оток с тромботична или възпалителна етиология. 30–33 Неговите компоненти в други екстракционни форми и дозировки показват, че регулират възпалението, 34–40, както и подпомагат възстановяването на тъканите и образуването на извънклетъчен матрикс чрез регулиране на матрични металопротеинази, активиране на фибробласти и синтез на колаген. 41–45 Механизмът на действие и ефективността на Lymphomyosot за специално лечение на лимфедем са неясни. Тук използвахме утвърдени експериментални модели на лимфедем и лимфангиогенеза, за да изясним дали Lymphomyosot действа за намаляване на подуването на тъканите чрез насочване към функционална лимфна регенерация, възпаление или като подпомага възстановяването на рани.
Материали и методи
Експериментално лекарство
Lymphomyosot N (Biologische Heilmittel Heel GmbH, Баден-Баден, Германия) е многокомпонентно лекарство, съдържащо силно разредени съставки. Една ампула (съдържаща течност за инжектиране на 1 ml Lymphomyosot) съдържа 0,55 mg Gentiana lutea D5, 0,55 mg Pinus sylvestris D4, 0,55 mg Scrophularia nodosa D3, 0,55 mg Equisetum hiemale D4, 1,1 mg Ferrum jodatum D12, 0,55 mg калциев фосфорикум D12, 0,55 mg Aranea diadematus D6, 0,55 mg Fumaria officinalis D4, 1,1 mg Geranium robertianum D4, 0,55 mg Levothyroxinum D12, 1,1 mg Nasturtium officinale D4, 0,55 mg Natrium sulfuricum D4, 0,55 mg Sarsaparillae radix D6, 0,55 mg mg Myosos Teucrium scorodonia D3, 0,55 mg Veronica officinalis D3, натриев хлорид и вода. Всички компоненти са приготвени съгласно Европейската фармакопея. 46 Lymphomyosot се препоръчва за лечение на лимфни заболявания 30,33 при хора чрез прилагане на 1 ампула на ден в остри случаи и в противен случай 1–3 ампули седмично. За експериментите Lymphomyosot и контролите се прилагат интраперитонеално в дози от 5 μL, 25 μL или 50 μL на животно.
Експериментални модели
Използвани са женски мишки с балб/c (Jackson Labs; 6-8 седмици). Мишките бяха анестезирани с 2,5% изофлуран, смесен с кислороден газ за хирургични процедури и бяха убити в експериментални крайни точки чрез задушаване на CO2. Всички протоколи са одобрени от Комитета за грижа и употреба на животните на Мичиганския технологичен университет. Всички мишки, използвани за експерименти, са рандомизирани, като хирургът е сляп за лечението.
Модел 1. Лимфедем на опашката: нормално заздравяване на рани
Отокът на кожата на опашката е създаден при мишки Balb/c чрез изрязване на 1-милиметрова кръгова лента от дерма (която съдържа лимфната капилярна мрежа) на 2 см от основата на опашката, оставяйки подлежащата кост, мускули, сухожилия и основни кръвоносни съдове непокътнати, подобно на предишни проучвания. 47–49 Мишките бяха разделени на четири групи (10 мишки на група) за измерване на подуване на опашката и затваряне на рани и получиха 5, 25 или 50 μL i.p. инжекции на Lymphomyosot или 50 μL физиологичен разтвор в деня на операцията и след това през ден до евтаназация на ден 30. Отделна група мишки бяха разделени на три групи (10 мишки на група) и получиха 25 или 50 μL i.p. инжекции на лимфомиозот или 50 μL физиологичен разтвор в деня на операцията и след това през ден до евтаназация на ден 9 за анализ на набирането на макрофаги в подутата кожа на опашката.
Модел 2. Опашен лимфедем: покрито заздравяване на рани
Модел за отстраняване на белези/подобрен тъкан за възстановяване на оток на кожата на опашката е създаден при мишки Balb/c чрез отстраняване на дермата, както е описано по-горе, с регенериращата област, поставена на 2 см надолу по опашката. След нараняването областта на раната беше покрита с плътно прилепващ, газопропусклив силиконов ръкав, подобен на предишни проучвания. 14,50–55 Ръкавът предпазва мястото на нараняване, позволявайки на тъканта да се възстанови по-бързо и по относително без белези. Поставянето на покрита кръгла рана на 2 см надолу по опашката не доведе до оток на дисталната кожа на опашката до ден 10. Мишките бяха разделени на две групи (10 мишки на група) и получиха 25 μL i.p. инжекции на лимфомиозот или физиологичен разтвор в деня на операцията и след това през ден до евтаназация на ден 10 за анализ на лимфната капилярна миграция.
Модел 3. Лимфедем на предния крак
Произведен е миши модел на преден крак на лимфедем, както е описано по-горе. 56 Balb/c мишки бяха анестезирани с 2.5% изофлуран, смесен с кислороден газ. 5 mm дълъг хирургичен разрез през дермата беше поставен през аксилата от дясната страна и аксиларните лимфни възли бяха идентифицирани и изрязани заедно с видими части от съдове за събиране преди и след възли под стереомикроскоп Olympus SZX7. Дермата се зашива с 6-0 конци за конец (Harvard Apparatur, Holliston, MA) и мишките се оставят да се възстановят до ден 10 или 15. Мишките се разделят на две групи (10 мишки на група) и получават 25 μL i.p. инжекции на лимфомиозот или физиологичен разтвор в деня на операцията и след това през ден до евтаназация на 10-ия ден (5 мишки на група) и 15 (5 мишки на група) за IC-Green изображения и анализ на регенерацията на лимфните съдове.
Имунофлуоресценция и имунохистохимия
Образци от опашка от модел 2 се нарязват на 10 или 100 μm надлъжни криосекции и се имунооцветяват. Имунооцветяването на криосекции на опашката протича с антитела срещу ендотелен хиалуронов рецептор-1 (LYVE-1) на лимфните съдове в дебелите участъци, за да се открият лимфните ендотелни клетки (LEC). Използвано е козе поликлонално антитяло срещу лимфно-специфичния хиалуронов рецептор LYVE-1 (R&D системи) заедно с Alexa Fluor 488 магарешко антикозе вторично антитяло (Invitrogen). Макрофаги са открити в 10 μm криосекции на кожата на опашката на мишката чрез маркиране на специфичния за макрофаги маркер F4/80. 57 Използвано е биотинилирано анти F4/80 антитяло (Serotec) заедно с конюгиран стрептавидин на Alexa Fluor 555 (Invitrogen). Клетъчните ядра в маркирани с LYVE-1 и F4/80 участъци бяха оцветени с 4 ', 6-диамино-2-фенилиндол (DAPI; Vector Laboratories, Burlingame, CA).
Физиологични измервания
Изображенията на опашката на мишката от непокрития модел на регенериращ кожен лимфедем са заснети на всеки 3 дни за всяка опашка на мишката с цветна камера DP71, монтирана на стереомикроскоп. Отокът на опашката се определя със софтуера Metamorph (Molecular Devices) чрез измерване на диаметрите на опашката от цифрови изображения на подутата опашка дистално до мястото на раната на най-подутото място. Затварянето на раната беше измерено по надлъжната ос на опашката като разстоянието между дисталната и проксималната регенерираща тъкан през мястото на раната. Процентното покритие на макрофагите беше определено в подутата кожа дистално от раната в тъканни участъци, маркирани с F4/80, с анализ на прага с помощта на софтуера Metamorph.
Изобразяване на функционални лимфни съдове чрез флуоресцентна лимфография IC-Green
Използвахме наскоро разработена образна система за откриване на функционални лимфни съдове и лимфни възли в предния крак на мишката. 58–60 Пет микролитра от 5 mg/ml разтвор на флуоресцентно близко инфрачервено багрило Indocyanine Green (ICG; Akorn) се инжектира в лапата на мишката. Откриването на ICG се извършва с електронно умножаващо устройство, свързано със заряд (CCD) (Hamamatsu, C9100-13). ICG беше осветена с масив от 760 nm светодиоди (Epitex Inc), поставени преди лентов пропускателен филтър от 760 nm (модел 760FS10-50, Andover Corporation), за да осигурят възбуждаща светлина за активиране на ICG. Изработени по поръчка филтър за отхвърляне на ленти с холографски прорез 785 nm и 763 nm (модел HNPF-785.0-2.0 и HNPF-763.0-2.0, Kaiser Optical Systems) и лентов филтър за качество на изображението 830 nm (модел 830FS20-25, Andover Corporation) поставени пред обектива на камерата за селективно отхвърляне на възбудителната светлина и преминаване на излъчената дължина на вълната от 830 nm.
Статистически методи
За всяка точка от данни са използвани поне пет животни. За повечето точки от данни бяха използвани десет животни. Данните са представени като средства със стандартни отклонения. Стойностите на Р бяха изчислени, използвайки ANOVA или t-тест на Student, както е посочено.
Резултати
Намалено подуване на тъканите чрез приложение на лимфомиозот
Лимфомиозот не повлиява регенерацията на лимфните капиляри или лимфните съдове
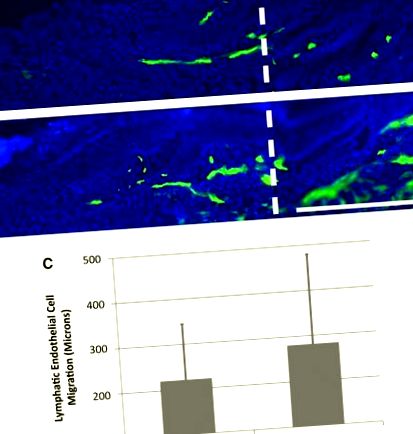
Лимфомиозот не увеличава лимфангиогенезата на лимфните капиляри. Лимфедемът в кожата на опашката на мишката се предизвиква чрез хирургично изрязване на кожата с ширина 1 mm, което е защитено със силиконов маншет. Показани са изображения на дебели крио-срезове с етикет LYVE-1 (зелен цвят) от 10-дневна следоперационна кожа на опашката за мишки, лекувани с 25 μL физиологичен разтвор (А) или наркотик (Б). Скала в долния десен панел = 0,5 mm. Вертикалната бяла пунктирана линия в A и Б. маркира дисталната граница между нативна и регенерираща тъкан. Графиката показва разстоянието на лимфната капилярна миграция в регенериращия регион в групите, третирани с физиологичен разтвор и лекарства (° С). Няма статистически разлики между тези групи; n = 10. Цветна версия на тази фигура е достъпна в онлайн статията на адрес www.liebertpub.com/lrb.
Лимфомиозот не увеличава лимфангиогенезата на лимфните съдове. Аксиларните лимфни възли бяха отстранени от мишката и лимфните съдове на предния крак бяха визуализирани чрез IC-зелена лимфангиография. Показани са неуправляван преден крак за управление (А), оперирани предни крайници на мишки, които са получили 25 μL физиологичен разтвор на 10-ия ден (Б) и ден 15 (Д), и оперира предни крака на мишки, които получиха 25 μL лекарство на 10-ия ден (° С) и ден 15 (E). Жълтата стрелка идентифицира флуоресцентен сигнал в аксилата; n = 5 на група. Цветна версия на тази фигура е достъпна в онлайн статията на адрес www.liebertpub.com/lrb.
Лимфомиозот модулира инфилтрацията на макрофагите в подутата тъкан
Обезцветяване на жълтата козина. Изображения, събрани незабавно след евтаназия за мишки, третирани със солев разтвор (А), 5 μL от лекарството (Б), 25 μL от лекарството (° С), или 50 μL от лекарството (Д) изобразяват необичаен дозозависим модел на жълтеникаво обезцветяване; n = 10 на група. Цветна версия на тази фигура е достъпна в онлайн статията на адрес www.liebertpub.com/lrb.
Дискусия
Вторичният лимфедем на горния крайник често е следствие от хирургична процедура, която премахва лимфните възли, лимфните събиращи съдове и околната тъкан от аксилата в опит да лекува рак на гърдата и да намали риска от вторични метастази. Предполага се, че лимфедемът се развива поради лоша лимфна регенерация през фиброзния белег, който се образува на мястото на операцията. 9–12,50 Следователно терапиите, които подобряват възстановяването на рани и намаляват белезите, могат да бъдат ефективни за намаляване на развитието на постхирургичен лимфедем.
Възстановяването на рани е сложен и добре организиран биологичен процес, състоящ се от три последователни фази, възпаление, пролиферация/гранулиране и ремоделиране. 15,20 Това е възпалителната фаза с нейния обширен набор от растежни фактори и медиатори, произведени от притока на гранулоцити и макрофаги, която, ако не бъде разрешена и възстановена в тяхното предивъзпалително състояние, води до излишни белези, фиброза и хронично възпалително заболяване. 15,21,23 Събития се случват рано при остро възпаление, които включват активна и координирана програма за разрешаване (напр. Преминаване към локално производство на специализирани междуклетъчни пратеници, програмирана левкоцитна смърт чрез апоптоза и последващо изчистване на умиращите клетки от фагоцити), т.е. отговорен за възстановяването на предвъзпалителното състояние и хомеостазата. 17,24,25 Многокомпонентната медицина Lymphomyosot може да е насочила един или повече от тези пътища. Резултатите от това проучване показват, че веществата в лимфомиозот могат да модулират възпалителния отговор и/или да насърчават зарастването на рани. 34,36,38,42,44
Съществуването на разнообразни пътища, допринасящи за развитието на вторичен лимфедем, посочва необходимостта от такива мултитаргетинг лекарства. Вариантните (синергични и адитивни) ефекти, медиирани от 16 различни основни съставки в Lymphomyosot, предполагат използването на това лекарство като поддържащо лечение след операции. Основните процеси като възпаление, дренаж и ремоделиране на тъкани са насочени и модулирани едновременно в ниски дози с малко странични ефекти. Lymphomyosot може да осигури ново системно или локално лекарство за терапия на рани или възстановяване на кожата, за да подобри скоростта и качеството на заздравяване, а ефектът му върху модулирането на възпалението може да помогне за предотвратяване на хронични възпалителни състояния и предотвратяване на белези и фиброза.
Перспектива
Предполага се, че вторичният лимфедем се развива поради лоша лимфна регенерация през фиброзния белег, който се развива на мястото на операцията в опит за лечение на рак на гърдата. Може да се окаже, че сложността на възстановяването на рани при възрастни и многобройните клетъчни и извънклетъчни пътища, показани при вторичен лимфедем, са пряко повлияни от мулти-таргетното лекарство Lymphomyosot. Основните процеси на възпаление, дренаж и ремоделиране на тъкани са насочени и модулирани едновременно в ниски дози с малко странични ефекти. Тези резултати предоставят възможност за изследване на потенциалните терапевтични ефекти, които Lymphomyosot може да осигури като ново системно или локално лекарство за терапия на рани или възстановяване на кожата, за да се подобри скоростта и качеството на зарастване.
- Лечение на диабет тип 2 за възрастни FARXIGA® (дапаглифлозин)
- Този домашен сироп топи мазнините, подобрява зрението, слуха и паметта
- Отслабването подобрява инконтиненцията и пролапса на тазовите органи 2011-07-01 AHC Media Continuing Medical
- Какво е Saxenda, новият блокбастър за отслабване HuffPost Life
- Какво се случва в тялото ми! Разпространение на лимфедем