Резюме
Заден план
Предишни проучвания при телеост демонстрират адаптивната стратегия за поддържане на чернодробната липидна хомеостаза в определени граници. Излишъкът от прием на мазнини може да предизвика ненормално отлагане на липиди в черния дроб, но не и на мастната тъкан. Молекулярният механизъм между нарушената липидна хомеостаза и влошеното отлагане на липиди в черния дроб обаче не е изяснен добре при рибите.
Методи
Бяха формулирани четири изонитрогенни диети с различни нива на мазнини (2, 7, 12 и 17%), наречени съответно L2, L7, L12 и L17, и хранени с китайски костур (44,50 ± 0,25 g) до привидно насищане в продължение на пет седмици. Измерват се индекс на растеж, концентрации на триглицериди и експресия на гени, участващи в липидния метаболизъм.
Резултати
Максималната ефективност на растежа и приема на храна са наблюдавани в групата L12. Съдържанието на липиди в черния дроб и серума са сравними в групите L2, L7 и L12, докато те са се увеличили значително в групата L17. Хистологичният анализ също така демонстрира, че масови липидни капчици се появяват в хепатоцитите и след това индуцират чернодробна стеатоза в група L17. В сравнение с L2 групата, липолитичните гени, свързани с мастни киселини (FA), се транспортират (lpl & hl) и FAs β-окисление (cpt1 & cs) бяха увеличени в групата L7 и L12. Относителни нива на иРНК на глюконеогенезата (настолен компютър, чук & g6pase) също бяха увеличени, за разлика от тях, липогенните гени (srebp1, съгл & фас) бяха намалени. В сравнение с групата L12, групата L17 има по-високи нива на иРНК на транспорта на FAs и липогенезата. Но липолитичните гени, свързани с β-окислението на FAs, са стабилни и нивата на тРНК на глюконеогенезата вместо това са регулирани надолу.
Заключения
В рамките на определена граница увеличението на хранителните мазнини в групата L7 и L12 благоприятства намаляването на консумацията на протеини и подобряването на растежа при китайския костур. Това се дължи на хомеостазата на пула от чернодробен триглицерид (TG) и серумна глюкоза чрез насърчаване на FA-окислението и глюконеогенезата съответно. Както увеличаването на липогенезата, така и отсъствието на β-окисление на FA в групата L17 може да предизвика етерификация на FA, наистина, инхибирането на глюконеогенезата също може да влоши натрупването на триглицериди в черния дроб и да предизвика чернодробна стеатоза.
Заден план
Диетичните мазнини биха могли да осигурят висока енергия и незаменими мастни киселини (EFA), за да задоволят бързия темп на растеж и нуждите от физиологичен липид при повечето култивирани риби [1,2,3,4,5]. В определени граници повишаването на нивото на мазнините в храната може да подобри използването на фуражите [6] и да защити по някакъв начин срещу метаболизма на протеина за енергия [7, 8], особено при месоядните видове риби. Диетите с високо съдържание на мазнини обаче доведоха до засилено отлагане на мазнини в рибното тяло, индуцирани метаболитни нарушения, включително синдром на мастния черен дроб [9], анормален оксидативен статус [10] и променена хранителна стойност, органолептични и физични свойства [6]. Много констатации от изследването разкриват, че варирането на нивото на мазнините в храната трябва да бъде внимателно оценено, тъй като това може да повлияе на липидните метаболитни стратегии и липидния депозит [2, 11,12,13,14,15,16,17].
Въпреки че различните видове риби имат различна толерантност към екзогенния прием на мазнини, естественият подбор дава на рибите способността да съхраняват липиди в различни органи, когато хранителните мазнини са в изобилие, от друга страна, ускорява мобилизацията на липиди за осигуряване на енергия. Като цяло, с увеличаващия се прием на хранителни мазнини, съдържанието на липиди в рибеното тяло също се увеличава постепенно [6, 16, 18,19,20,21]. Интересното е, че приоритетното място на отлагане на мазнини е специфично за видовете при рибите. Няколко вида риби съхраняват за предпочитане липидите (главно TG) в мезентериума и вътрешностите, като амур (Ctenopharyngodon idella) [10, 11, 14, 17] и Нилска тилапия (Oreochromis niloticus) [12], докато атлантическата сьомга (Салмо салар) би предпочел да съхранява липиди в мускулите, но не и в черния дроб [13]. Селективната стратегия може да допринесе за намаляване на потенциалния риск от мастни натрупвания в черния дроб. Освен това хомеостазата на чернодробните липиди може да зависи от чернодробните митохондриални и пероксизомни окислителни способности. Тъй като активирането на чернодробното митохондриално окисление може да ускори разграждането на свободните мастни киселини (FFA) чрез карнитин палмитоилтрансфераза I (CPT1) и след това да освободи аденозин трифосфат (ATP) за осигуряване на енергия през цикъла на трикарбоксилната киселина (TCA) [22].
Методи
Етично одобрение
Всички експериментални процедури следваха указанията за животински протокол и бяха одобрени от Аграрния университет Huazhong (Ухан, Китай).
Животни и хранене
Китайски костур са получени от компания за развитие на селското стопанство в Уху и са култивирани в рибната къща на Аграрния университет Хуачжун (Ухан, Китай). Преди експеримента всички риби биха приели изкуствената диета след аклиматизация [34]. Четири диети бяха формулирани с различен градиентен липид (2, 7, 12 и 17%, съответно) и кодирани като L2, L7, L12 и L17 група (Таблица 1). Всички диетични съставки са закупени от Gaolong Feed Technology Co., Ltd. (Ухан, Китай). След това бяха избрани общо 144 риби и подредени произволно в 12 резервоара (350 L) с постоянен поток от филтрирана вода. Плътността на зарибяване е била 12 риби (44,50 ± 0,25 g риба - 1) на резервоар и всяка диета е била подредена в три екземпляра. По време на периода на култивиране, всички риби са били хранени два пъти на ден в 8.30 ч. И 17.30 ч. До видимо насищане. Температурата на водата се поддържа на 24 ± 2 ° C и водата се сменя два пъти седмично с помощта на циркулационна водна система.
Вземане на проби и химически анализи
След 5-седмично изпитване за хранене, всички риби се гладуват в продължение на 24 часа и се евтаназират с MS-222 (Argent Chemical Laboratories, Redmond, WA, USA), след което се претеглят и преброяват. За всяко третиране шест риби бяха произволно уловени и съхранявани във фризер при - 20 ° C, докато се използват за химически анализ на цялото тяло. Взема се кръв от опашната вена на шест риби от всяка група и се съхранява при 4 ° С за една нощ, след което се центрофугира (2500 g, 20 минути) за серумни проби. Серумните проби бяха замразени при - 80 ° C до анализ. Проби от тъкани за откриване на липидно съдържание, като черен дроб, мезентерия и висцерална мастна тъкан, се дисектират от шест риби при всяко третиране и след това се съхраняват при - 20 ° C. Чернодробният соматичен индекс (HSI), мезентериалният индекс на мазнините (MFI) и висцералният соматичен индекс (VSI) са изчислени веднага след анатомия [HSI = теглото на черния дроб/телесно тегло (%), VSI = теглото на висцералната мастна тъкан/телесно тегло (%) и MFI = теглото на мезентериалната мазнина/телесно тегло (%)]. Други шест риби на третиране са избрани на случаен принцип за молекулярни експерименти и чернодробната тъкан (0,5 g) за анализ на експресията на гени бързо се замразява в течен азот и след това се съхранява при - 80 ° C за изолиране на РНК и последващ анализ.
Химичните анализи, включително анализите на диетата и състава на цялото тяло, бяха определени по стандартни методи [35]. Влагата се анализира чрез сушене при 105 ° С в продължение на 6 часа. Определянето на суров протеин (N × 6,25) беше проведено чрез използване на системата Kjeltec след разграждане на киселина (K8400 Kjeltec Analyzer, Fossana Lyticab, Швеция). Суровият липид се измерва чрез използване на етер-екстракция със Soxtec System HT (SE-A6, Alvah, Китай). Пепелта се определя чрез горене с муфелна пещ (SX2–4-10, Zhengda Electric Technology Co., Ltd., Китай) при 550 ° C за 12 часа.
Биохимичните анализи бяха фокусирани върху откриването на серумни индекси, включително GLU (глюкоза), TC (общ холестерол), TG (общ триглицерид), HDL (липопротеин с висока плътност), LDL (липопротеин с ниска плътност) и AST (аспартат аминотрансфераза) . Всички тези индекси се определят с автоматичен биохимичен анализатор [Abbott Aeroset Analyzer (Abbott Laboratories, USA)] в болница Zhongnan (Ухан, Китай).
Хистологичен анализ и реактиви
Чернодробните тъкани от три риби от всяка група бяха събрани и незабавно фиксирани с използване на 4% неутрален буфериран формалдехид в продължение на 4 дни. След дехидратиране и вграждане в парафин, тъканна секция беше нарязана на 5 μm за оцветяване с хематоксилин и еозин (H&E) (Каталожен номер G1005-100; Servicebio Biotech Technology Co., Ltd., Wuhan, Китай). За замразената секция и оцветяването с маслено червено О, чернодробните проби веднага се замразяват с течен азот и се съхраняват при - 80 ° C. Серийните замразени секции бяха нарязани на 8 μm за оцветяване с маслено червено О. Изсушените предметни стъкла се измиват чрез потапяне един или два пъти в 70% алкохол и след това се поставят върху абсорбираща повърхност и се покриват с разтвор Oil Red O (Каталожен номер G1016; Servicebio Biotech Technology Co., Ltd., Wuhan, Китай) за 5 минути. Чернодробните секции бяха разгледани при увеличение 40 пъти. Три слайда от всяка група бяха включени в количественото определяне и 5 полета бяха избрани произволно на всеки слайд. За всяко поле броят на клетъчните ядра в наблюдението H&E и относителната площ на липидната капчица в наблюдението Oil Red O са количествено определени от софтуера Image J (Национален здравен институт) след предишни доклади [36, 37]. Съдържанието на TG в черния дроб, висцералната мастна тъкан и мускулите е извършено от производителя на комплекта за анализ на триглицериди (Каталожен номер F001; Институт по биоинженеринг Jiancheng, Нанкин, Китай).
Изолация на РНК и обратна транскрипция
Преди изолирането на РНК чернодробните тъкани бяха извадени от хладилника - 80 ° C и размразени върху леда. Тризол реагент (код № 9108; TaKaRa, Япония) се използва като лизисен буфер за чернодробни тъкани, добавя се 1 ml с 0,1 g чернодробна проба. Следвайки инструкциите на производителя, РНК се пречиства чрез фенол/хлороформ екстракция на лизатната супернатанта, последвано от утаяване с етанол. Екстрахираната РНК се разтваря в 50–100 μL вода без RNase (Код № 9750; TaKaRa, Япония). Интегралността на РНК се изследва с електрофореза в агарозен гел. Концентрацията на проби от РНК се определя количествено с BioTek Synergy ™ 2 Multi-detector Microplate Reader (BioTek Instruments, USA). След това 1 μg от общата РНК е използвана за обратна транскрипция с HiScript® II обратна транскриптаза (код № R201–01/02; Vazyme, Китай) в 20 μL реакционен обем. Синтезираната cDNA се съхранява при - 20 ° C до по-нататъшна употреба.
QPCR анализ в реално време
Статистически анализ
Статистическите анализи бяха извършени със софтуера SPSS 19.0. Нормалността и хомогенността на дисперсиите за всички данни бяха съответно оценени чрез теста на Шапиро-Уилк и теста на Левен. Разликите в средните стойности са тествани чрез тестове на Дънкан с множество диапазони с еднопосочен дисперсионен анализ (ANOVA), като статистическата значимост се счита за ниво от 5%.
Резултати
Ефективност на растежа и използване на фуражите
След 5 седмично изпитване за хранене, използването на фуража и ефективността на растежа са представени в Таблица 3. От група L2 до L12 приемът на храна (FI) не показва значителна разлика, но крайното тегло (FW), наддаване на тегло (WG), специфично съотношението на растеж (SGR) и задържането на протеин (PR) бяха прогресивно повишени. Всички горепосочени индекси са намалени значително в групата L17 в сравнение с групата L12.
Ефекти от хранителните нива на мазнини върху местата за отлагане на липиди
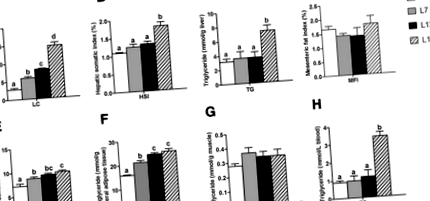
Съдържанието на липиди (LC) в рибеното тяло постепенно се повишава с повишените хранителни мазнини от 2 до 17% (фиг. 1а). Съдържанието на MFI и TG в мускулите не показват разлика между четирите групи (фиг. 1г и g). В сравнение с L2 групата, съдържанието на VSI и TG във висцералната мастна тъкан се увеличава значително както в групата L7, така и в L12 (Фиг. 1д, f). Съдържанието на HSI и TG в черния дроб и серума не показват разлика между L2, L7 и L12 групата (Фиг. 1b, c и h). В сравнение с групата L12, съдържанието на HSI и TG в черния дроб и серума се повишава значително в групата L17, но съдържанието на VSI и TG във висцералната мастна тъкан са стабилни.
Ефекти от хранителните нива на мазнини върху серумните индекси
Концентрациите на серумни TC, HDL, LDL и GLU са показани в таблица 4. Концентрацията на глюкоза в серума се увеличава постепенно от група L2 до група L12, но рязко намалява в групата L17. Серумните TC, LDL и HDL са се увеличили значително в групата L17 в сравнение с други групи.
Ефекти от хранителните нива на мазнини върху чернодробната тъкан
Прекомерният прием на мазнини обикновено корелира с извънматочното отлагане на TG в черния дроб. За да се изследва дали диетите с високо съдържание на мазнини могат да предизвикат чернодробна стеатоза при китайския костур, извършихме оцветяване с масло в червено О и H&E оцветяване на чернодробни секции (фиг. 2). Масленочервеното оцветяване с О потвърждава, че броят на червените точки (липидни капчици) не показва очевидна разлика между групата L2, L7 и L12, но рязко се е увеличил в групата L17 (Фиг. 2а). В действителност, H&E оцветяването показва, че чернодробните клетки се появяват малки вакуоли постепенно от група L2 към група L12, но в група L17 вакуолата се увеличава рязко и след това притиска клетъчните ядра до ръба (фиг. 2б). Тези резултати бяха допълнително потвърдени от количествено определената площ за липидни капчици при оцветяването с Маслено червено О и от броя на клетъчните ядра в H&E оцветяването. Относителната площ на липидната капка в групата L17 е значително по-голяма от другите групи, от друга страна, броят на клетъчните ядра е намалял само в групата L17 (Фиг. 2в, d). Това означава, че чернодробните клетки са страдали от патологична реакция, предизвикана от TG инфилтрация. В допълнение, ензимната активност на AST в кръвта, причиняваща чернодробно увреждане, беше значително повишена в групата L17 в сравнение с други групи (Фиг. 2д).
Експресия на гени на глюкозен и липиден метаболизъм в черния дроб
Дискусия
Предложен модел на липидна метаболитна стратегия в китайския костур, отговарящ на подходящ прием на мазнини. L7 и L12 представляват диети, съдържащи 7 и 12% липидно съдържание, което е оптималният диапазон на липидно ниво за растеж и използване на рибите в настоящото проучване. В черния дроб повишеното усвояване на FFAs може да предизвика β-окисление на FAs и след това да инхибира липогенезата, за да поддържа стабилизацията на TG пула. Ацетил-КоА, получен от β-окислението на FAs, може да участва в TCA цикъл за осигуряване на енергия. В действителност, субстратът-глицерол, получен от диетичната TG хидролиза, ще участва в глюконеогенезата и след това ще предотврати натрупването на TG в черния дроб. В този модел хомеостазата на чернодробния пул TG и серумната глюкоза се осъществява чрез сътрудничеството на бета-окислението на FAs и глюконеогенезата
В допълнение беше забелязано, че съдържанието на липиди в цялото тяло на китайския костур постепенно се повишава от L2 до L12 група, но съдържанието на TG в черния дроб и мускулите е стабилно, от друга страна, както съдържанието на TG във висцералната мастна тъкан, така и VSI бяха значително увеличени. Диетичните мазнини (предимно TG) ще бъдат усвоени и абсорбирани в червата и след това хидролизирани в лумена на червата от панкреатични липази, окончателно оформени в FFA. FFAs бяха непрекъснато транспортирани от липопротеини липаза в кръвта и абсорбирани в черния дроб или мастната тъкан за естерификация [50, 51]. В това проучване се предполага, че висцералната мастна тъкан може да бъде приоритетно място за отлагане на липиди в цялото тяло в групата L7 и L12. Подобни резултати са докладвани в предишни проучвания [4, 10, 12, 14, 16, 17]. Освен това се предполага, че хомеостазата на чернодробните липиди се дължи отчасти на висцералната мастна тъкан, която също е участвала в съхраняването на TG.
Предложен модел на чернодробно отлагане на TG в китайски костур в отговор на прием на високо съдържание на мазнини. L17 представлява диети, съдържащи 17% съдържание на липиди, което не е от полза за използването на чернодробните липиди и метаболизма в настоящото проучване. В черния дроб излишният прием на хранителни мазнини може да ускори естерификацията на FFAs при липса на β-окисление на FAs. Всъщност допълнителното усвояване на FFA може да осигури масовия субстрат на Acyl-CoA за липогенеза чрез регулиране на srebp1. Рязко повишената липогенеза може ефективно да инхибира глюконеогенезата и да влоши отлагането на TG в черния дроб, въпреки че част от новосинтезиран TG е доставен в периферните тъкани чрез VLDL в кръвта
Заключение
В заключение, с увеличаването на приема на хранителни мазнини в групата L7 и L12, допълнителното усвояване на FFAs и глицерол, получени от хидролиза на триглицериди, би ускорило съответно β-окислението на FAs и глюконеогенезата. Отрицателната регулация на β-окисляването на FAs може ефективно да потисне липогенезата и след това да изключи естерификацията на FFA. Тези процедури са от решаващо значение за поддържане на хомеостазата на чернодробния пул TG и серумната глюкоза, всъщност подобряват ефективността на растежа и намаляват консумацията на диетични протеини. Диетата с високо съдържание на мазнини в група L17 може лесно да наруши чернодробната липидна хомеостаза и да предизвика метаболитно разстройство на липидите, причинено от липсата на липолиза и влошаване на липогенезата. В допълнение, инхибирането на глюконеогенезата може също да влоши отлагането на TG в черния дроб и след това да индуцира чернодробната стеатоза. Както чернодробното увреждане, така и намаляването на серумната глюкоза могат да влошат нормалния физиологичен статус и да забавят скоростта на растеж при китайския костур. Като цяло, нашето проучване разкри основната стимулация между нарушената липидна хомеостаза и влошеното отлагане на липиди в черния дроб и може да даде последици за изследването на синдрома на мастния черен дроб при риби с телеост.
- Диетичният модел в средиземноморски стил подобрява свързаната с рака умора и качеството на живот при мъжете с
- Liu Wen, Fei Fei Sun и още китайски модели в родния град Beauty Traditions Vogue
- Имунният отговор срещу кръгли червеи Toxocara помага да се обясни болестта - ScienceDaily
- Имунотерапията предлага нова стратегия за лечение на рак на мемориал на саркома Sloan Kettering
- Как да се храним според традиционната китайска медицина; Източна акупунктура и уелнес плантация,