1 Нефрологичен отдел, Отделение по вътрешни болести, Обща болница с три услуги, Национален медицински център за отбрана, № 325, раздел 2, път Cheng-Gong, Neihu, Тайпе 114, Тайван
Резюме
1. Въведение
2. Механизми на загуба на мускули при пациенти на хемодиализа
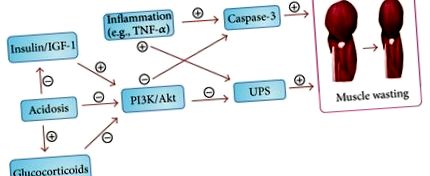
Изхабяването на мускулите се определя от сложни механизми и няколко от тях са документирани, за да обяснят загубата на мускул при пациенти с ХБН със и без HD (Фигура 1).
2.1. Убиквитин-протеазомна система
2.2. Каспаза-3 протеолитичен път
Каспаза-3 е протеаза, която участва в клетъчната апоптоза. Той разцепва актиомиозин в миофибриларни комплекси и генерира 14 kDa актинов фрагмент. Активирането на каспаза-3 ускорява разграждането на протеина в мускулите. Повишени нива на 14 kDa актинов фрагмент са разкрити в мускулни биопсии, получени от пациенти с диагноза ESRD при поддържащо HD или от тези, които са претърпели нараняване. По-високите нива на 14 kDa актинов фрагмент разкриват активно загуба на мускулна маса при пациенти с катаболни състояния и предполагат, че нивата на 14 kDa актинов фрагмент могат да се използват като биомаркер за разграждане на мускулния протеин [13, 14].
2.3. Инсулин, инсулиноподобен фактор на растеж-1 и инсулинова резистентност
Инсулинът е основен регулатор в модулацията на протеиновия синтез и разграждането на скелетните мускули. Метаболитният ефект на инсулина върху обмяната на мускулни протеини се характеризира с потискане на разграждането на протеина във фосфатидилинозитол 3-киназа (PI3K)/Akt-зависим път. Инсулинът се свързва с инсулиновия рецептор (IR) на клетъчната мембрана и активира вътрешната активност на тирозин киназата в цитозола. Протеините на инсулиновия рецепторен субстрат (IRS) в цитозола се фосфорилират чрез активиран IR. PI3K се състои от p85 регулаторни и p110 каталитични субединици и се превръща в активиран ензим след свързване с фосфорилираните IRS протеини. Активираният PI3K катализира производството на фосфатидилинозитол (3,4,5) трифосфат, който активира серин киназата Akt чрез фосфорилиране. Фосфорилираният-Akt (p-Akt) влияе на различни регулатори, участващи в метаболитните процеси в скелетните мускули. Намалената активност на p-Akt стимулира експресията на конюгиращи ензими Е3, атрогин-1/MAFbx и MuRF1 в мускулите. Активираният IRS също активира MEK/ERK митоген-активиран протеинов (MAP) киназен път, който участва в регулирането на много критични биологични процеси, включително клетъчна пролиферация, диференциация и смърт [12, 15].
Инсулиновата резистентност води до нарушено сигнализиране за инсулин/IGF-1 в скелетните мускули. Нарушеното сигнализиране за инсулин/IGF-1 води до намалено ниво на p-Akt в мускула, което причинява потискане на PI3K/Akt пътя и разграждане на мускулния протеин. Натрупващите се доказателства демонстрират ускорено активиране на протеолитичния път на каспаза-3 и намалено ниво на p-Akt в скелетната мускулатура при пациенти, проявяващи инсулинова резистентност, излишък от ангиотензин II, възпаление, ацидоза и ХБН [16, 17]. Добре установено е, че пациентите с диагноза ХБН страдат от повишена инсулинова резистентност, което може да допринесе за загуба на мускулна маса [18].
Възпалението също е основна последица както от ХБН, така и от HD и многобройни възпалителни медиатори са доказали, че модулират свързаните с инсулина сигнални пътища в скелетните мускули. Възпалителни фактори като фактор на туморна некроза-α (TNF-α) потискат сигнализирането на инсулиновия рецептор чрез инхибиране и разграждане на IRS в скелетните мускули [19]. В допълнение, TNF-α активира каспаза-3 и NF-κB, който стимулира активирането на UPS, което води до загуба на мускули [14, 20].
2.4. Глюкокортикоиди
Бъбрекът обикновено отделя кортизол и неговите водоразтворими метаболити, а при пациенти с ХБН се съобщава за повишени серумни нива на кортизол поради удължения серумен полуживот на кортизол при напреднала бъбречна недостатъчност [21]. Глюкокортикоидите активират глюкокортикоидните рецептори, които могат директно да се свържат с p85 субединицата на PI3K, което води до загуба на мускули чрез потискане на p-Akt. Освен това са съобщени повишени нива на p85 субединицата при пациенти с ХБН [22, 23]. Глюкокортикоидите също индуцират регулиране на UPS, атрогин-1 и MuRF1, което може да доведе до разграждане на мускулния протеин [24].
2.5. Метаболитна ацидоза
Метаболитната ацидоза е универсална характеристика при повечето пациенти с диагноза ХБН, които имат скорост на гломерулна филтрация (GFR), която е намаляла до по-малко от 20% до 25% от нормалната честота. Доказано е, че метаболитната ацидоза причинява отрицателен азотен баланс и намалява синтеза на албумин, което води до загуба на мускули. В допълнение, метаболитната ацидоза причинява разграждане на мускулния протеин чрез активиране на UPS и каспаза-3, а намаленото вътреклетъчно рН в мускулните клетки нарушава сигнализирането на PI3K и p-Akt [14, 25–27]. Освен това се съобщава за намалена концентрация на растежен хормон, ниско ниво на IGF-1 и повишено производство на глюкокортикоиди при лица с метаболитна ацидоза, което отчасти може да обясни високото разпространение на загуба на мускулна маса при пациенти с ХБН [28, 29].
2.6. Полови хормони
Добре известно е, че както естрогенът, така и тестостеронът влияят върху синтеза и разграждането на протеините и че тестостеронът оказва по-виден ефект върху обмяната на мускулните протеини, отколкото естрогенът. Ниското ниво на тестостерон може да предизвика разграждане на мускулния протеин чрез нарушено сигнализиране на IGF-1 и да насърчи мускулния катаболизъм чрез регулиране на експресията на миостатин [30]. Данните показват, че ниските концентрации на тестостерон са широко разпространени при възрастни хора и пациенти с ХБН и че нивата на ниски тестостерон са тясно свързани с загубата на мускулна маса и смъртността при пациенти с HD [31, 32]. По този начин андрогенният дефицит може да бъде включен в сложните механизми, които са в основата на загубата на мускули при пациенти с ХБН.
3. Терапевтични граници на загуба на мускули при пациенти на хемодиализа
За да се подобри качеството на живот и дългосрочната прогноза на пациентите, при пациенти с HD е необходимо разработване на ефективни терапевтични стратегии за загуба на мускулна маса. Неотдавнашният напредък в разбирането на молекулярните механизми, свързани с ХБН, свързано с загуба на мускули, дава нова надежда за разработването на набор от нови терапии. Съобщава се, че следните терапевтични интервенции са ефективни за подобряване на мускулната сила при пациенти с ХБН (Таблица 1).
3.1. Упражнение за издръжливост и съпротива
Съобщава се, че упражненията за издръжливост (аеробни) и устойчивост (анаеробни или силови тренировки) намаляват загубата на мускулна маса при пациенти с HD. Упражнението за съпротива предизвиква мускулно съкращение, което може да увеличи силата, анаеробната издръжливост и размера на скелетните мускули. Упражнението за съпротива може да бъде разделено на традиционно вдигане на сила и олимпийско вдигане. Както упражненията за издръжливост, така и упражненията за съпротива могат да доведат до повишена сила и сила на скелетните мускули [33].
Програма за упражнения за съпротива трябва да се изпълнява постепенно и поне два пъти седмично и трябва да включва тренировка за всички основни мускулни групи. При пациенти с HD с нарушен физически капацитет и изразена мускулна атрофия, упражненията за съпротива намаляват загубата на мускули и увеличават мускулните влакна, въз основа на хистологични изследвания [42]. Съобщава се, че серумните нива на възпалителни фактори, като С-реактивен протеин и интерлевкин-6, намаляват след 12-седмично упражнение на резистентност [43].
3.2. Лечение на инсулинова резистентност
Инсулиновата резистентност предизвиква загуба на мускули чрез сложни механизми, включително сигнални пътища за инсулин/IGF-1 и PI3K/Akt. Подобряването на инсулиновата резистентност е от решаващо значение за предотвратяване на загуба на мускулна маса при пациенти с диагноза HD. Аеробните упражнения при пациенти с HD са ефективни за подобряване на инсулиновата резистентност [40]. Тиазолидиндионите, които са инсулинови сенсибилизатори, се използват широко при лечението на диабет тип 2 и е доказано, че подобряват инсулиновата резистентност чрез активиране на PI3K/Akt пътя чрез иницииране на IRS сигнализиране. Тъй като катаболизмът на тиазолидиндионите се проявява главно в черния дроб, той е потенциално лекарство за подобряване на инсулиновата резистентност при пациенти с HD [44–46]. Тиазолидиндион трябва да се прилага с повишено внимание поради повишен риск от сърдечно-съдови инциденти и рак на пикочния мехур [47]. Ограничените данни за хора обаче подкрепят основната роля на инсулиновите сенсибилизатори за загуба на мускулна маса при пациенти с HD.
3.3. Корекция на метаболитна ацидоза
Метаболитната ацидоза е неизбежно състояние при пациенти с ХБН, особено тези с HD [48-50]. Доказано е, че добавка на натриев бикарбонат (NaHCO3) подобрява растежа при кърмачета и деца с ацидоза [51]. В допълнение, загубата на протеин в мускула е приблизително 2 пъти по-висока при пациенти със серумни нива на NaHCO3 22,6 mM [52]. Тези данни предполагат, че поддържането на серумното ниво на NaHCO3> 22,6 mM може да бъде терапевтична цел за намаляване на загубата на мускулна маса при пациенти с HD с метаболитна ацидоза.
3.4. Хормонална терапия
Намалено ниво на серумен тестостерон често се среща при пациенти с диагноза напреднала ХБН и при поддържащо HD и нарушената IGF-1 сигнализация може да участва в механизма на медиирано от андроген дефицит мускулно разхищение. При мъже с хипогонадизъм тестостероновите добавки за 12 седмици подобряват мускулната маса и сила [53, 54]. При пациенти с HD, телесният състав и физическата функция се подобряват значително след лечение с анаболен стероид, 19-нортестостерон (нандролон деканоат) [55]. Прилагането на 100 mg нандролон седмично в продължение на 24 седмици увеличава чистата телесна маса приблизително 2 пъти. Въпреки че нандролон деканоатът е ефективен за подобряване на загубата на мускули, неговите странични ефекти, включително гинекомастия, еректилна дисфункция и повишени сърдечно-съдови рискове, трябва да бъдат причина за повишено внимание [56].
3.5. Хранене
В допълнение към стимулантите за апетит, директните хранителни добавки са от съществено значение за намаляване на загубата на мускули. Перорални, ентерални или парентерални хранителни добавки трябва да се имат предвид, ако се появи неразрешена анорексия. Систематичен преглед и мета-анализ на 18 проучвания показват, че ентералните хранителни добавки при пациенти с HD водят до повишен общ прием на енергия и протеини и повишени нива на серумен албумин с 0,23 g/dL [62]. Пероралното хранене самостоятелно и в комбинация с интрадиализно парентерално хранене при пациенти с диагноза HD разкрива подобни резултати, включително подобряване на индекса на телесна маса, повишени нива на серумен албумин и преалбумин, намалена 2-годишна смъртност и намалени хоспитализации [63–65].
4. Заключение
Изхабяването на мускулите при пациенти с HD е причинено от сложни механизми и агенти, включително UPS, каспаза-3, инсулин/IGF-1, глюкокортикоиди, метаболитна ацидоза и сигнални пътища, свързани със полови хормони. Разработването на нови лекарства, насочени към UPS, каспаза-3 и инсулин/IGF-1, предлага нова надежда за лечение на мускулна загуба. Корекцията на метаболитната ацидоза с натриев бикарбонат намалява разграждането на мускулния протеин. Мегестрол ацетат и нандролон деканоат са клинично достъпни и могат да се прилагат за намаляване на загубата на мускулна маса. Адекватните хранителни добавки са жизненоважни, защото те могат да подобрят мускулната маса и да намалят смъртността. Упражнението за издръжливост не само намалява загубата на мускули, но също така подобрява сърдечната фракция на изтласкване, кръвното налягане и инсулиновата резистентност. Последните постижения в разбирането на молекулярните механизми на загуба на мускулна маса предоставят възможности за разрешаване на този клиничен проблем.
Конфликт на интереси
Авторите заявяват, че нямат конфликт на интереси.
Благодарности
Тази работа беше подкрепена от безвъзмездни средства от Националния научен съвет, Тайван (NSC 99-2628-B-016-002-MY3 и NSC 102-2314-B-016-006-MY3) и Обща болница Tri-Service (TSGH-C100 -011-015-S02 и TSGH-C101-006-011-015-S02).
Препратки
- Причини за загуба на мускули, симптоми, рискови фактори, лечение и профилактика Medlife
- Загубата на тегло при пациенти на хемодиализа след хоспитализация е свързана с продължителността на престоя и
- Възпаление, органомегалия и загуба на мускули въпреки хиперфагия при миши модел на изгаряне
- Lishou Strong Slimming капсула Терапевтични стоки Администрация (TGA)
- Омир Симпсън, обвинен за Великобритания; s Проблем със затлъстяването